苯丙酮尿症(phenylketonuria,PKU)是一种先 天性遗传代谢性疾病,由于肝脏内苯丙氨酸羟化 酶的缺乏,导致患儿体内苯丙氨酸(PHE)无法转 化为酪氨酸引起。如果早期不及时诊断和治疗, 患儿体内PHE蓄积而导致其神经系统发生不可逆 的损伤 [1] ,影响患儿的智能发育,出现智能落后或 痴呆。一旦确诊,其治疗方针即很明确:在临床 医师或营养师指导下进行低PHE饮食治疗,将血 PHE浓度控制在一定的范围内,避免其对中枢神 经系统不可逆的损伤 [2] 。因此,PKU治疗的首要目 标是维持血浆PHE浓度在合适的、理想的范围内, 在英国 [1] 和美国 [3] 推荐范围为120~360μmol/L(英 国标准中亦说明对于学龄期的PKU患儿,可接受 上限480μmol/L)。本项临床研究的试验药品肠内 营养粉剂AA-PKU2是不含PHE的氨基酸混合粉 剂,遵照临床医师或营养师的指导剂量服用本品 并结合适当的低PHE饮食,可控制血PHE浓度水 平在治疗目标范围内。
2009年7月至2011年5月以浙江大学医学院 附属儿童医院为主要研究单位,联合中日友好医 院、北京大学第一医院、山东省济南市妇幼保健 院、上海交通大学医学院附属新华医院及广东省 广州市妇幼保健院参加,共入组1岁至7岁4个 月PKU患儿121例,其中男70例,女51例。入 选标准包括:年龄1~8岁;经临床与实验室检查 确诊为PKU(诊断标准参考卫生部颁发的新生儿 筛查诊疗常规);诊断时实验室检查血PHE浓度高于360μmol/L;生命体征稳定;家长或法定监 护人签署知情同意书。排除标准包括:患有其他 遗传代谢性疾病(如四氢生物蝶呤缺乏症);对 研究药物成分过敏;低出生体重(小于2500 g) 与早产儿(小于37周孕期);患有神经系统性 疾病;患有完全性肠道梗阻;患有顽固性腹泻等 需要进行肠道休息处理;患有严重腹腔内感染; 患有肿瘤或人类免疫缺陷病毒阳性;肝功能异常 (SGPT/ALT或SGOT/AST大于正常值上限);肾 功能异常(血肌酐大于正常值上限);患有严重 的全身性疾病(如心血管系统、呼吸系统、消化 系统、内分泌系统、泌尿生殖系统疾病等)且病 情不稳定;免疫功能受损(如淋巴瘤、艾滋病、 Wiskott-Aldrich综合征)或有恶性疾病史;本试验 前30 d内参加了其他的药物临床试验;研究者判 断患儿依从性差,无法按照要求完成研究。本研 究经医院伦理委员会批准,所有研究对象的家长 或法定监护人签署知情同意书。
前瞻、开放、自身前后对照、多中心设计。 筛选合格入组后予患儿AA-PKU2(由英国SHS International Limited提供),根据《儿科学》第四 版对“儿童各种营养素及能量每日需要量”的建 议值 [4] ,本试验药物推荐剂量为:176~192 g/d(1~3 岁患儿),212~232 g/d(4~6岁患儿),具体使用 剂量(包括7~8岁年龄段PKU患儿的使用剂量) 和浓度由医师或营养师决定。整个治疗周期为32 周,分别在治疗8周和32周后进行有效性评价; 安全性指标血常规、尿常规、肝肾功能分别在治 疗前、治疗8周、32周后进行检测,并在整个研 究过程中监测不良事件(反应)的发生情况。
主要疗效指标为血PHE浓度;次要有效性指 标包括身高、体重、头围、血清营养学指标、智力 测定(1~4岁Gesell法;>4岁WPPSI或WISR-R法)。
实验室检查指标(血常规、尿常规、肝肾功能) 变化情况以及不良事件(反应)发生情况。
采用SAS 9.1.3软件包分析,正态分布的计量 资料用均数±标准差(x±s)表示,非正态分布 的计量资料用中位数表示。正态分布且方差齐性 资料组内前后比较采用配对t检验,非正态分布或 方差不齐资料组内前后比较采用Wilcoxon符号秩 和检验;计数资料采用频数(构成比)进行描述; P<0.05为差异有统计学意义。
共入组121例(男70例,女51例),平均 年龄38±22月龄,整个研究过程中脱落17例, 脱落率为14.0%。有效性指标在符合方案集数据库 中分析,安全性指标在全分析集数据库中分析。
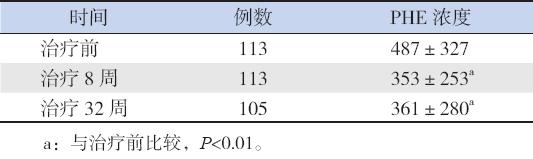
与治疗前比较,治疗8、32周的血PHE浓度 均明显下降(分别S=1425.5、1048.5,P<0.0001, P=0.0005),分别下降了101、90μmol/L(中位数), 见表1。治疗8、32周后血PHE浓度控制在目标 范围内(<360μmol/L)的控制率分别为65.5%和 66.7%。
| 表 1治疗前后血PHE浓度的比较 (x±s,μmol/L) |
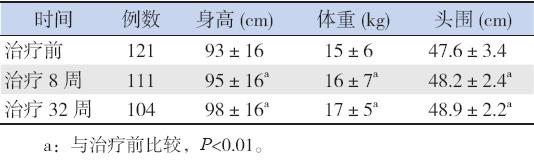
与治疗前比较,AA-PKU2治疗8周后患儿 身高、体重和头围均显著增加(分别S=2831.0、 1768.0、1027.5,均P<0.0001),身高、体重和头 围分别增加了1.8 cm、0.6 kg、0.3 cm(中位数);AA-PKU2治疗32周后患儿身高、体重和头围亦均 显著增加(分别S=2525.0、2514.5、2117.0,均 P<0.0001),身高、体重和头围分别增加了5.6 cm、 2.0 kg、1.0 cm(中位数)。见表2。
| 表 2治疗前后身高、体重、头围的比较 (x±s) |
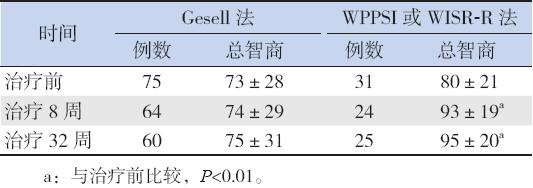
应用Gesell法评估的患儿中,治疗8周和32 周后总智商与治疗前相比,差异无统计学意义(分 别t=1.76、1.89,P=0.0836、0.0641),但分别增 加了0.5、1.9,显示了改善的趋势;应用WPPSI 或WISR-R法评估的患儿中,治疗8周与32周后 总智商较治疗前明显提高(分别t=5.63、5.59,均 P<0.0001),总智商分别增加了11、14(中位数)。 见表3。
| 表 3治疗前后总智商的比较 (x±s) |
治疗8周和32周后血清总蛋白、白蛋白、前 白蛋白、总胆固醇、甘油三酯、低密度脂蛋白、高 密度脂蛋白与治疗前基本相当,均在正常范围内。
在整个临床研究过程中,不良事件发生例次 181次,发生例数66例,多为上呼吸道感染与腹 泻(上呼吸道感染发生例次126次,腹泻发生例 次10次);严重不良事件1例,患儿因纳呆,便 秘伴发热咳嗽住院治疗,出院诊断为“胃肠炎”, 研究者判断与试验药物可能无关。与研究药物相 关的不良事件即不良反应发生3例(2.5%,3例次), 均为轻度腹泻,对症处理或无需处理均完全恢复 并适应AA-PKU2饮食治疗。
由于PKU是先天遗传代谢性疾病,目前尚无 根治方法,治疗方法虽然不复杂,但治疗周期长(提 倡终身饮食控制或至少12岁前严格饮食控制), 故对PKU患儿及其抚养人对本病治疗的长期依从 性是一个考验,尤其是PKU幼儿的维持治疗。 2002年的一项大规模的多中心研究报道认为,由 于依从性问题,PKU患者的血PHE浓度实际上并 不能如标准要求的那样被严格控制,小于10岁的 患儿中,有30%超过规定浓度,而对于15岁及更 大的儿童,这一比例达到80%,说明饮食控制在 实施上仍存在一定困难,尤其对于较大的儿童 [5] 。
本项临床研究的试验药品肠内营养粉剂AA- PKU2是不含PHE的肠内营养粉剂,含有其他必 需和非必需氨基酸、碳水化合物、维生素、矿物 质和微量元素。其中蛋白当量为25%,碳水化合 物51%,所有的成份均为人体日常所需的营养物 质,既能补充氨基酸又能补充碳水化合物、维生 素、矿物质和微量元素等多种营养成份,同时限 制PHE的摄入,可有效控制PHE浓度,预防智能 发育障碍,满足正常发育生长。
本研究所有入组患儿遵照临床医师或营 养师的指导剂量服用AA-PKU2 32周并结合低 PHE饮食,在治疗8周和32周后血PHE控制在 360μmol/L内的控制率分别为65.5%与66.7%。一 项在欧洲的调查显示 [6] :患者血PHE水平达到当 地或者国家目标值的平均比例为1岁以下88%, 1~10岁为74%。本研究的入组患儿年龄为1~8岁, 患者血PHE水平达到当地或者国家目标值的平均 比例与文献报道相似 [5, 6] 。其他未控制在360μmol/L 以内的患儿考虑与患儿未严格按照规定剂量服药或 未严格控制其他辅食的摄入有关。
智能方面,本研究在采用Gesell法评估的 1~4岁的患儿中,AA-PKU2治疗8、32周后总 智商与治疗前相比差异虽无统计学意义,但有改 善趋势;在采用韦氏法评估的4岁以上患儿中, 治疗8周和32周后的总智商较治疗前有明显提 高,说明AA-PKU2治疗对1~8岁的PKU患儿智 能发育有益,此结果与国内外的相关文献报道一 致。Clarke等 [7] 的双盲、对照研究结果显示,未 严格进行饮食限制的青少年PKU患者存在神经精神缺陷,且与整体智能障碍不成比例,但这种 缺陷可通过饮食限制部分逆转和改善;国内王志 新等 [8] 也报道低PHE饮食治疗可降低PKU患儿 血PHE浓度,其脑白质病变及智商均有部分改 善,提示PKU患者脑白质病变及智力损害是部 分可逆的。Seashore等 [9] 报道,如果PKU幼儿 不限制饮食,智能水平可衰退,且与不限制饮食 的程度和时间相关,但如果饮食限制,PHE浓度 控制在理想范围内,其智能水平将有所改善。段 建华等 [10] 的研究结果显示,饮食治疗部分配合 组PKU患儿各能区智能发育评分均值均低于完全 配合治疗组,而不配合治疗组智力发育水平则明 显落后于完全配合治疗组,而这3组患儿的疾病 基础情况是相同的。说明不配合饮食治疗患儿的 智能水平会大大落后于配合治疗的患儿。徐发亮 等 [11] 对19例PKU患儿进行了观察,其中8例患 儿进行了低PHE饮食治疗,另外11例患儿未进行 治疗,给予普通饮食,监测2组患儿智能发育情况。 结果显示,治疗前2组患儿发育商无显著性差别, 治疗后低PHE饮食治疗组智能水平明显高于未进 行饮食治疗组。进一步说明了应用不含PHE或低 PHE的产品控制血PHE浓度水平在一定的目标范 围内对避免中枢神经系统的损伤、维持PKU患儿 正常的智能发育有重要意义。
本研究结果还显示,肠内营养粉剂AA-PKU2 能满足患儿正常生长发育的需要。AA-PKU2治疗8 周和32周后患儿的身高、体重、头围较治疗前明 显增长,与同年龄段的正常儿童发育水平相当 [12] 。 李晓雯等 [13] 进行了一项低PHE饮食治疗PKU的 临床研究,也证明了应用不含PHE的治疗产品对 PKU患儿进行饮食治疗可满足患儿的正常生长发 育。
本研究不仅对AA-PKU2治疗的有效性进行 了研究,对其安全性也进行了观察。在整个临床 研究过程中,与研究药物相关的不良事件即不良 反应发生3例(共3例次,2.5%),均为轻度腹 泻,经对症处理或无需处理均完全恢复并适应AA- PKU2饮食治疗,说明AA-PKU2治疗的安全性、 耐受性良好。
总之,通过对肠内营养粉剂AA-PKU2的有效 性与安全性临床研究结果的分析,证明AA-PKU2 能有效控制1~8岁患儿的血PHE浓度在360μmol/L以内,满足1~8岁患儿正常生长发育的需要,并且 通过有效控制患儿血PHE浓度,可改善患儿的智 力发育,且安全性良好。
| [1] | Dobson JC, Williamson ML, Azen C, et al. Intellectual assessment of 111 four-year-old children with phenylketonuria[J]. Pediatrics, 1977, 60(6): 822-827. |
| [2] | Recommendations on the dietary management of phenylketonuria. Report of Medical Research Council Working Party on Phenylketonuria[J]. Arch Dis Child, 1993, 68(3): 426-427. |
| [3] | National Institutes of Health Consensus Development Panel. National Institutes of Health Consensus Development Conference Statement: phenylketonuria: screening and management[J]. Pediatrics, 2001,108(4): 972-982. |
| [4] | 王慕逖. 儿科学[M].第4版.北京:人民卫生出版社, 1996: 53. |
| [5] | Walter JH, White FJ, Hall SK, et al. How practical are recommend ations for dietary control in phenylketonuria?[J]. Lacent, 2002, 360(9326): 55-57. |
| [6] | MacDonald A, Gokmen-Ozel H, van Rijn M, et al. The reality of dietary compliance in the management of phenylketonuria[J]. J Inherit Metab Dis, 2010, 33(6): 665-670. |
| [7] | Clarke JT, Gates RD, Hogan SE, et al. Neuropsychological studies on adolescents with phenylketonuria returned to phenylalanine-restricted diets[J]. Am J Ment Retard, 1987, 92(3): 255-262. |
| [8] | 王志新, 周忠蜀, 喻唯民. 苯丙酮尿症患儿治疗前后脑白质病变的观察[J]. 中国当代儿科杂志, 2006, 8(1): 13-16. |
| [9] | Seashore MR, Friedman E, Novelly RA, et al. Loss of intellectual function in children with phenylketonuria after relaxation of dietary phenylalanine restriction[J]. Pediatrics, 1985, 75(2): 226-232. |
| [10] | 段建华, 秦金莉, 张玉敏. 苯丙酮尿症(经典型)患儿智力发育与治疗依从性关系初探[J]. 中国妇幼保健杂志, 2004, 8(1): 27-28. |
| [11] | 徐发亮, 黄素霞. 饮食治疗对苯丙酮尿症患儿的影响[J]. 青海医药杂志, 2008, 38(1): 24-26. |
| [12] | 九市儿童体格发育调查协作组,首都儿科研究所. 中国七岁以下儿童体重、身长/身高和头围生长标准值及标准化生长曲线[J]. 中华儿科杂志, 2009, 47(3): 173-178. |
| [13] | 李晓雯, 喻维民, 王琳, 等. 低苯丙氨酸饮食治疗苯丙酮尿症的临床研究[J]. 中国优生与遗传杂志, 2006, 14(2): 112-113. |
 2014, Vol. 16
2014, Vol. 16