特发性中枢性性早熟(idiopathic central precocious puberty,ICPP)是儿童常见的内分泌疾 病,发病率女孩高于男孩。除第二性征提前出现、 月经提前来潮外,相当一部分患儿存在骨龄提前, 骨骺提前闭合,最终导致成年身高受到影响。目前, 促性腺激素释放激素类似物(gonadotropin releasing hormone analogs,GnRHa)是治疗ICPP最有效的药 物,它竞争结合受体、抑制促性腺激素的分泌, 促使性征消退,并有效延缓骨骼成熟从而达到改 善患儿最终成年身高的目的。但治疗过程中部分 患儿尤其是骨龄≥10岁的患儿可能出现较明显的 生长抑制,甚至减缓到生长迟缓水平,以致不能 显著改善终身高,甚至低于靶身高 [1]。
GnRHa联合重组人生长激素(recombinant human growth hormone,rhGH)治疗可能是改变这 种情况的手段之一,但结果存在争议,且大多为 单中心、小样本的研究结果,缺乏长期平行对照 研究 [2, 3] 。2010年卫生部在《性早熟诊疗指南(试 行)》中提出,“GnRHa治疗中部分患者生长减 速明显,小样本资料显示联合应用rhGH可改善生 长速率或成年身高,但目前仍缺乏大样本、随机 对照研究资料,故不推荐常规联合应用”。因此, 本研究通过多中心合作、对照比较骨龄≥10岁的 中国ICPP女童采用单独GnRHa或联合rhGH治疗 后的接近成年身高改善情况,希冀为骨龄≥10岁 ICPP女童的临床治疗提供参考意义。
浙江大学医学院附属第一医院儿科、温州医 科大学附属育英儿童医院、苏州大学附属儿童医 院、四川大学附属华西二院儿科、厦门大学附属 第一医院儿科、福建省福州儿童医院确诊的ICPP 女童124例,根据研究纳入标准及排除标准后符 合研究条件的共80例,平均年龄9.0±0.7岁。
纳入研究的样本必须同时符合以下条件: (1)临床诊断为ICPP女童 [4] ,且促黄体生成 素(LH)峰值>5.0 IU/L,LH/促卵泡生成激素 (FSH)>0.6;(2)初治年龄>8岁并且10岁 ≤骨龄<12岁;(3)在2009年12月底前结束 药物治疗,在2012年1月至2013年5月期间随 访达到接近成年身高(身高增长<1 cm/年); (4)连续单独应用GnRHa治疗18个月及以上或 连续应用GnRHa 18个月及以上并在治疗期间联合 rhGH用药6个月及以上,停止GnRHa治疗后单用 rhGH不超过2个月;(5)GnRHa开始治疗时生 长潜力受损明显,即治疗基线时根据骨龄预测的身 高标准差≤-1.0 SDS。排除标准包括:(1)器质 性中枢性性早熟,如各类颅内肿瘤所致的中枢性性 早熟;(2)LHRH激发试验后LH峰值>5.0 IU/L 但LH/FSH<0.6者;(3)外周性性早熟转化为 中枢性性早熟,如先天性肾上腺皮质增生症等; (4)合并先天性甲状腺功能低下、生长激素缺乏, 肝、肾功能不全,心、肺、免疫系统、血液系统 等疾病者。
GnRH首剂100μg/kg (30 kg以上3.75 mg),每4周1次(间隔时间不 超过5周),剂量个体化,根据性腺轴功能抑制 情况(包括性征、性激素水平和骨龄进展)进行 调整,最大量为3.75 mg/次。治疗过程中每3个 月检查第二性征以及测量身高、体重;每3个月 复查简易GnRH激发试验 [5] (注射后1 h检测血清 LH、FSH),如LH激发值在青春前期值则表示剂 量合适。每6个月复查骨龄和子宫、卵巢B超1次。 在GnRHa治疗过程中身高增长速度减慢至4 cm/年 或以下,且近半年预测成年身高(PAH)无明显 改善者在患儿及其监护人同意时联合rhGH治疗, 使用rhGH前必须经详细检查排除rhGH使用禁忌 症。rhGH剂量每日0.12~0.15 IU/kg并在随访过程 中定期观察糖脂代谢指标(空腹血糖、胰岛素、 糖化血红蛋白)、甲状腺功能指标、胰岛素样生 长因子(IGF1)、胰岛素样生长因子-3(IGFBP3),如有异常不宜继续使用rhGH者需排除出组。根据 有无联用rhGH分成两组:GnRHa与rhGH联合治 疗组(31例)及GnRHa单用组(49例)。
骨龄测定采用Greulich-Pyle 法(参照2001年华中科技大学同济医学院附属同 济医院、中华医学会儿科学分会儿科遗传代谢内 分泌学组编绘的骨龄评定手册评定,统一培训, 各中心负责人评定3次,取平均值作为骨龄), 预测成年身高评定用Payley-Pinneau法(表示为 PAH-BA);遗传靶身高=(父亲的身高+母亲 的身高-13 cm)/2;身高以标准差分值(SDS) 为参数计算单位,以2005年九省市女童身高参 照值计算对应年龄身高的标准差分值(HtSDS) [6] 和对应骨龄的HtSDS(HtSDSBA)。用于评估身 高改善的指标有接近成年身高,身高净获(接近 成年身高与治疗前骨龄预测成年身高的差值); 其他评估指标有骨龄的差值/实际年龄的差值 (△BA/△CA),标准化体块指数(BMI Z值 [7, 8] )。
采用SPSS 16.0统计学软件处理和分析数据。 正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验,治疗前后比较采 用配对t检验;非正态分布的计量资料以中位数(四 分位数)[P50(P25,P75)]表示,组间比较采用秩 和检验。对各项参数进行一元线性回归分析,以是 否达到遗传身高为因变量进行二元多因素logistic逐 步回归分析。P<0.05为差异有统计学意义。
GnRHa+rhGH联合治疗组共31例,乳房发
育年龄平均在7.7±0.5岁,治疗年龄平均在9.2±
0.7岁,骨龄在11.2±0.5岁。GnRHa单用组49例,
乳房发育年龄平均在7.6±0.8岁,治疗年龄平均
在8.9±0.6岁,骨龄约11.0±0.5岁(表1)。乳
房发育年龄、治疗时年龄、治疗时骨龄、治疗时
身高、预测成年身高、预测身高标准差(HtSDS-BA)、
BMI、BMI Z值、遗传身高等两组间比较差异均无
统计学意义(P>0.05)。两组间子宫、卵巢容积大小、
LH峰值、FSH峰值以及LH/FSH比值比较差异亦
均无统计学意义(P>0.05)。见表1。
| 表 1两组间治疗前一般资料比较 |
GnRHa+rhGH联合治疗组GnRHa平均治疗时 间25±7(月),初始平均剂量106±10μg/kg; 开始联合应用rhGH时间为1.2±0.8年,rhGH 平均治疗时间13±7(月),rhGH剂量为每日 0.14±0.02 IU/kg。GnRHa单用组平均治疗26±9 (月),初始平均剂量105±11μg/kg。两组间 GnRHa用药疗程、初始剂量差异均无统计学意义 (分别t=-0.352,0.468;P=0.726,0.641)。
GnRHa+rhGH联合治疗组停止治疗时平均身 高为149±6 cm,预测成年身高达到161±5 cm, HtSDS-BA停药时为-0.7(-0.87,-0.44),与治疗 前比较有显著改善(Z=-4.272,P<0.001),预测 成年身高超过遗传靶身高4.27(1.12,8.66)cm。在观察结束时接近成年身高157±6 cm,超出遗传 靶身高0.90(-3.0,3.75)cm,差异无统计学意义 (Z=-1.098,P=0.272),较药物治疗前身高净获 4.68(1.82,8.35)cm,但与停药时预测终身高的 差值为-2.79(-4.59,-0.55)cm,低于成年女性 身高(-0.12±0.96)SD。
GnRHa单用组停止治疗时身高为145±5 cm, 预测成年身高158±5 cm,HtSDS-BA停药时为 -1.2(-1.69,-0.77),与治疗前比较有显著改 善(Z=-5.508,P<0.001),预测成年身高超过 遗传靶身高1.25(-2.14,4.74)cm,在观察结 束时接近成年身高157±4 cm,超出遗传靶身高 0.20(-2.25,2.5)cm,差异无统计学意义(Z= -0.196,P=0.845)。较药物治疗前身高净获3.89 (0.84,7.25)cm,但与停药时预测终身高的差 值为-1.33(-4.55,1.29)cm,低于成年女性身高(-0.36±0.78)SD。
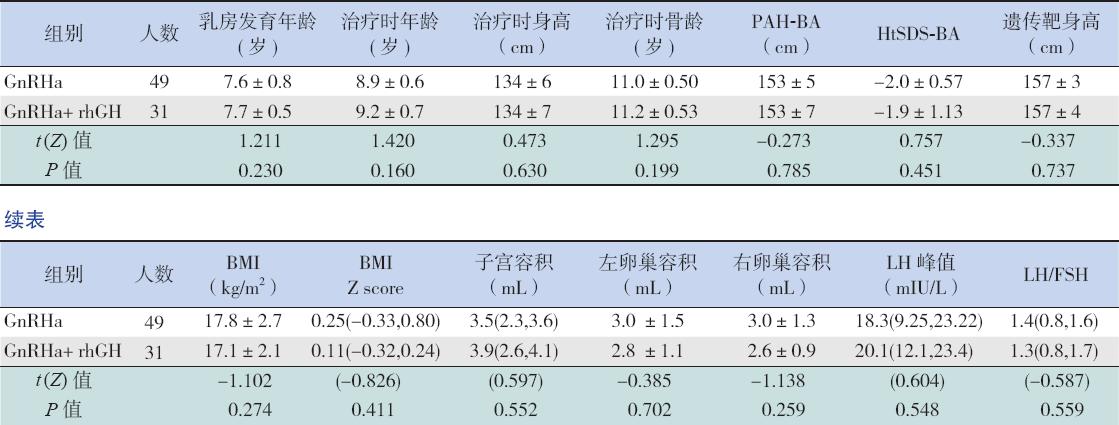
GnRHa+rhGH联合治疗组与GnRHa单用组 比较,两组治疗前、后预测成年身高及接近成 年身高差异无统计学意义(P>0.05)(图 1)。 治疗期间,GnRHa+rhGH联合治疗组生长速率 达6.7±1.8 cm/年,明显高于GnRHa单用组的 5.0±1.4 cm/年(t=4.482,P<0.001)。最终观察 时,GnRHa+rhGH联合用药组在接近成年身高、身 高净获、治疗后接近成年身高与停止治疗时骨骼 预测身高之差(PAH-BA)、接近成年身高与遗传 靶身高之差等指标均略优于GnRHa单用组,但差 异无统计学意义(P>0.05)(图 2)。HtSDS-BA停 药时及HtSDS-BA的治疗前后差值,GnRHa+rhGH 联合治疗组明显优于GnRHa单用组(分别Z= -3.373,-3.56,均P<0.01)(图 3)。
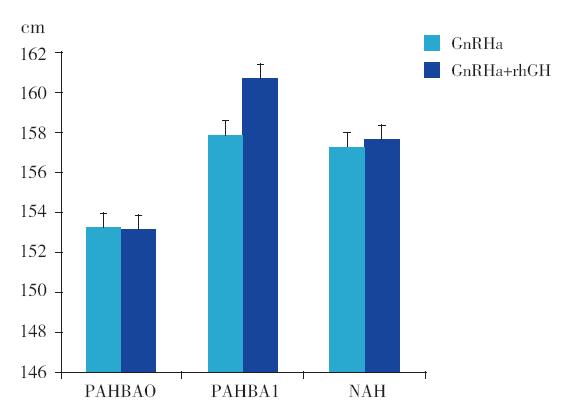 |
图 1 两组治疗前后预测成年身高及接近成年身高的比较 PAHBA0指治疗前预测成年身高,PAHBA1指治疗后停药时预测成年身高,NAH指观察结束时接近成年身高。 |
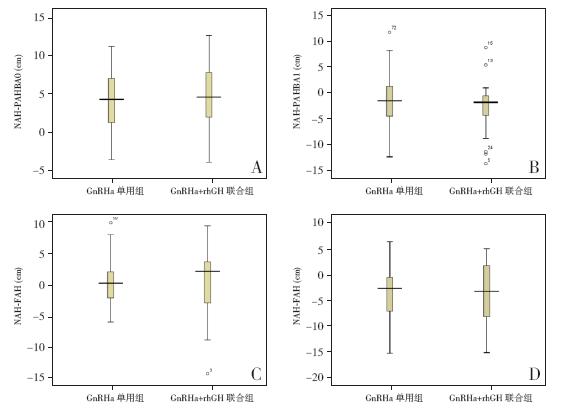 |
图 2 两组患儿身高改善指标比较 A:接近成年身高与 治疗前骨龄预测身高之差比较。B:接近成年身高与停止治疗时骨 龄预测身高之差比较;C:接近成年身高与遗传靶身高之差比较; D:治疗前骨龄预测身高与遗传靶身高之差比较。 |
 |
图 3 两组治疗前、停药时及观察结束时身高标准差比较 A:治疗前骨龄预测身高标准差;B:治疗2年停药时 骨龄预测身高标准差;C:观察结束时接近成年身高标准差;a:与GnRHa单用治疗组比较,P<0.001。 |
对各项指标进行相关分析时发现,与观察 结束时接近成年身高相关的指标有遗传靶身高 (r=0.423,P<0.001)、治疗时(基线)身高 (r=0.581,P<0.001)、HtSDS治疗时(r=0.532, P<0.001)、治疗时骨龄(r=0.199,P=0.077)、 HtSDS-BA治疗时(r=0.548,P<0.001)、PAH-BA 治疗时(r=0.548,P<0.001)、联用rhGH治疗时 的HtSDS(r=0.528,P<0.001)、联用rhGH时的 骨龄(r=0.302,P=0.014)、PAH-BA联用rhGH时 (r=0.596,P<0.001)。GnRHa及rhGH药物治疗 的剂量、疗程与接近成年身高无显著相关性。进 一步以是否达到遗传身高为因变量对上述相关因 子进行二元多因素logistic逐步回归分析发现最终 只有遗传靶身高(Wald=11.108,P=0.001)和治疗 基线时预测身高(Wald=12.358,P<0.001)进入回 归方程,其表达式为21.128-0.377×遗传靶身高+ 0.249×PAH-BA治疗时。
所有观察对象未发现明显药物不良反应, GnRHa+rhGH联合治疗组的骨龄的差值/实际年 龄的差值(△BA/△CA)平均为0.51±0.17, GnRHa单用组平均在0.50±0.26,两组间比 较差异无统计学意义(t=0.262,P=0.794)。 GnRHa+rhGH联合治疗组治疗后的BMI Z score为 0.06(-0.33,0.33),与治疗前比较差异无统计学 意义(Z=-0.098,P=0.922);GnRHa单用组治疗 后的BMI Z score为0.573(-0.08,1.33),较治疗 前平均增加0.25(-0.65,0.74),与治疗前比较 差异有统计学意义(Z=-2.282,P=0.022)。
Lazar等 [1] 的研究表明,对于年龄6~8岁的中 枢性性早熟女童经GnRHa治疗至少2年后,发现 成年身高较治疗前预测身高明显改善、与遗传靶 身高基本相仿;对于实际年龄>8岁的55名青春 期快速进展女童,治疗时年龄8.9±0.5岁,遗传身 高156.9±4.7 cm,BA-CA 2.3±0.6岁,治疗基线 时预测身高152.8±6.8 cm(HtSDS-BA:-1.1±0.7), 治疗后成年终身高153.9±4.6 cm,表明治疗 后的成年身高与治疗前预测身高相仿,但均未达到遗传靶身高,提示GnRHa治疗对改善此 类女童终身高不理想。本研究发现,对于年龄 >8岁且骨龄≥10岁但<12岁的ICPP女童,经 GnRHa联合rhGH或单独GnRHa治疗后,联合治 疗组身高平均增加4.68 cm,GnRHa单用组身高平 均增加3.89 cm,差异无统计学意义。研究结果为 什么与Lazar等的不同?一是国外那组资料为青春 期快速进展,生长潜力受损可能更为严重;二是 我国目前骨龄的评定及身高预测应用的是国外标 准,可能存在人群种族遗传背景的差异。本研究 结果提示,无论是两药联合应用还是单独GnRHa 治疗,均有可能在一定程度上改善骨龄<12岁的 ICPP女童的成年终身高。
对联合rhGH治疗能否解决ICPP患者应用 GnRHa后的生长减速、能否改善成年身高仍存在 争议。国外研究表明,GnRHa与rhGH联合治疗至 少2年以上,较单独GnRHa治疗组终身高的改善 更为明显 [9, 10] 。但Lanes等 [11] 对10位青春期非生 长激素缺乏的矮小的儿童采用GnRHa与rhGH(每 日0.1 U/kg,每周注射6 d)联合治疗30个月,发 现未能改善成年身高。后一研究存在的问题是样本 量少及rhGH剂量过小。在治疗非生长激素缺乏的 矮小儿童时,rhGH每日0.15 IU/kg比0.1 IU/kg改 善成年身高的作用明显 [12] 。本研究表明,联合治 疗组生长速率明显高于GnRHa单用组,在停止治 疗时,按骨龄的身高标准差分值以及治疗前后预测 终身高的差值,两药联合治疗组均优于GnRHa单 用组,差异有统计学意义。但是,最终两组在接近 成年身高时,生长潜能丢失的改善、接近成年身高 与遗传靶身高的差值等数据的比较,两药联合治疗 组虽略优于GnRHa单用组,但差异无统计学意义。 与国外研究比较,本研究存在的缺陷是联合rhGH 治疗周期太短(平均1年),有必要扩大样本量, 延长联合治疗周期做进一步研究。
本研究发现,两组患儿停药时的预测成年身 高与接近成年身高的差值变异范围很大,且大多 为负值。这不但说明对ICPP患者,按骨龄预测终 身高的不准确性 [1] ,更提示我们,停药时按骨龄预 测终身高很可能被高估,这也间接导致GnRHa与 rhGh联合治疗的过早停药决定,在临床治疗中应 引起重视。对影响成年终身高的各因素进行二元 多因素logistic逐步回归分析发现只有遗传靶身高和治疗基线时预测身高进入回归方程,说明对终 身高起决定作用的是遗传靶身高和治疗基线时的 预测身高,而GnRHa和/或联合GH药物治疗仅 仅起到部分改善终身高的作用。两组病例治疗过 程中未发现明显的药物不良反应,BMI Z值在联合 治疗组未发生变化而在单独GnRHa治疗后有明显 增加,这再次证实了GnRHa和rhGH两种药物良 好的安全性以及对体脂的影响。
综上,对骨龄≥10岁但<12岁的ICCP女童, GnRHa与rhGH联合治疗或单独GnRHa治疗,均有 可能在一定程度上改善其成年终身高,但过短时 间(<1年)的联用治疗优势不明显。对ICCP患儿 按骨龄预测成年身高的评估需要慎重,尤其在停 药时的预测容易被高估。
| [1] | Lazar L, Padoa A, Philip M. Growth pattern and final height after cessation of gonadotropin-suppressive therapy in girls with central sexual precocity [J]. J Clin Endocrinol Metab, 2007, 92(9): 3483-3492. |
| [2] | 李筠,梁黎,孙莉颖,等. 联合应用促性腺激素类似物和生长激素治疗女性初潮后特发性中枢性性早熟[J]. 中华儿科杂志, 2005, 43(8): 627-628. |
| [3] | 杜俊君, 赵凯, 阮莉莉, 等. 促性腺激素释放素类似物联合人重组生长激素治疗青春期特发性矮小女童[J]. 中外医疗, 2009, 28(33): 68-69. |
| [4] | 中华医学会儿科学分会内分泌遗传代谢学组. 中枢性(真性)性早熟诊治指南[J]. 中华儿科杂志, 2007, 45(6): 426-427. |
| [5] | 刘箐华, 田国力, 许洪平, 等. 简易化黄体生成素释放激素激发试验诊断性早熟[J]. 实用儿科临床杂志, 2007, 22(8): 593-594. |
| [6] | 李辉, 季成叶, 宗心南, 等. 中国0~18岁儿童、青少年身高、体重的标准化生长曲线[J]. 中华儿科杂志, 2009, 47(7): 487-492. |
| [7] | 梁黎, 傅君芬. 儿童肥胖与代谢综合征[M]. 北京:人民卫生出版社, 2012: 10. |
| [8] | 陈雪峰, 梁黎, 傅君芬, 等. 中国儿童青少年形体学测量指数调查[J]. 中华流行病学杂志, 2012, 33(5): 449-545. |
| [9] | Kamp, GA, Mul D, Waelkens JJ, et al. A randomized controlled trial of Three years growth hormone and conadotropin-releasing hormone agonist treatment in children with idiopathic short stature and intrauterine growth retardation[J]. J Clin Endocrinol Metab, 2001, 28(7): 2969-2975. |
| [10] | van Gool SA, Kamp GA, Visser-van Balen H, et al. Final height outcome after three years of growth hormone and gonadotropin-releasing hormone agonist treatment in short adolescents with relatively early puberty[J]. J Clin Endocrinol Metab, 2007, 92(4): 1402-1408. |
| [11] | Lanes R, Gunczler P. Final height after combined growth hormone and gonadotrophin-releasing hormone analogue therapy in short healthy children entering into normally timed puberty[J]. Clin Endocrinol (Oxf), 1998, 49(2): 197-202. |
| [12] | Lem AJ, van der Kaay DC, de Ridder MA, et al. Adult height in short children born SGA treated with growth hormone and gonadotropin releasing hormone analog: results of a randomized, dose-response GH trial[J]. J Clin Endocrinol Metab, 2012, 97(11): 4096-4105. |
 2014, Vol. 16
2014, Vol. 16