宫内生长迟缓(intrauterine growth retardation, IUGR)又称小于胎龄儿(small for gestational age,SGA),引起IUGR的病因很多,包括胎 儿、胎盘、母体等因素,但目前仍有40%左 右IUGR发生于临床未发现明显病因的正常 妊娠中 [1] 。近年来,相关资料显示在许多国 家和地区IUGR早产儿的发生率有逐年上升趋 势 [2, 3] 。IUGR早产儿出生后容易患各种感染性疾病, 甚至危及生命,这与其免疫功能不完善存在相关 性 [4, 5] 。目前,对IUGR早产儿的免疫功能的研究尚 处于早期阶段,有关于IUGR早产儿的T淋巴细胞 免疫功能研究报道不多,且结果不一。因此本研究 拟通过测定IUGR早产儿出生时至校正胎龄38周 时外周血T淋巴细胞亚群的水平变化来研究IUGR 早产儿生后T淋巴细胞亚群的功能。
选取2011年6月至2012年 7月间我院收治的67例早产儿为研究对象,其中 IUGR早产儿29例,适于胎龄(AGA)早产儿38例; 另选取我院产科同期分娩的健康足月儿20例为对 照组。IUGR的诊断标准为出生体重低于同孕龄新 生儿平均体重的2个标准差;或低于同孕龄正常 体重的第10个百分位数 [6]。
(1)早产儿胎龄范围: 30周≤胎龄≤34周;(2)生后一般情况良好, 生命体征平稳,在自然条件下血氧饱和度正常; (3)自然受孕和自然分娩的单胎妊娠。
(1)母亲既往有营养不良、 反复流产、糖尿病、严重贫血、肝炎等病史; (2)母孕期有妊娠高血压综合征,有输血及使用 免疫球蛋白史;(3)新生儿出生时有重度窒息、 宫内感染、溶血性黄疸、遗传代谢性疾病史; (4)早产儿出生至校正胎龄38周期间有脑室内 出血、慢性肺疾病等合并症;(5)所有研究对象 在观察期间有合并感染性疾病,如坏死性小肠结 肠炎(NEC)、败血症等。
出生24 h内及早产儿校正胎龄38周时抽取外 周静脉血2 mL,采用FACSCalibur流式细胞仪、 Sysmex全自动血液分析仪自动检测T淋巴细胞亚 群百分值及白细胞、淋巴细胞、T淋巴细胞绝对计 数。本研究获得家长书面知情同意。
应用SPSS 13.0统计软件对数据进行统计处 理。计量资料采用均数±标准差(x±s)表示, 两组间比较采用t检验,多组间比较采用单因素方 差分析,P<0.05为差异有统计学意义。
2011年6月至2012年7月入住我院新生儿 科早产儿共1126例,其中符合IUGR早产儿29 例(2.58%),男18例,女11例,出生体重为 1296±328 g,胎龄32.4±3.3周;AGA早产儿38 例(3.37%),其中男20例,女18例,出生体重 为1745±250 g,胎龄33.1±2.5周;对照组20例, 其中男9例,女11例,出生体重3173±523 g, 胎龄38.3±3.5周。IUGR早产儿与AGA早产儿胎 龄差异无统计学意义(t=0.624,P>0.05)。
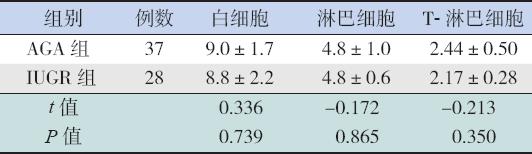
出生后24 h内IUGR早产儿CD3 + 、CD4 + 水平低于AGA组和对照组,差异有统计学意 义(均P<0.05),AGA早产儿CD3+、CD4+及 CD4 + /CD8 + 明显低于对照组(均P<0.05)。IUGR 早产儿CD8 + 及CD4 + /CD8 + 低于对照组,差异 有统计学意义(均P<0.05);三组间白细胞绝 对计数差异无统计学意义;IUGR早产儿淋巴 细胞绝对计数低于对照组(P<0.05)。IUGR早 产儿、AGA早产儿T淋巴细胞绝对计数低于对 照组(均P<0.05),且IUGR早产儿T淋巴细 胞绝对计数低于AGA组(P<0.05),见表1。
| 表 13组出生后24 h内白细胞及T淋巴细胞亚群水平比较 (x±s) |
校正胎龄38周时IUGR与AGA组早产儿外 周血白细胞、淋巴细胞及T淋巴细胞绝对计数比 较差异无统计学意义(P>0.05),见表2。
| 表 2IUGR与AGA组早产儿校正胎龄38周时白细胞水平比较 (x±s,×109/L) |
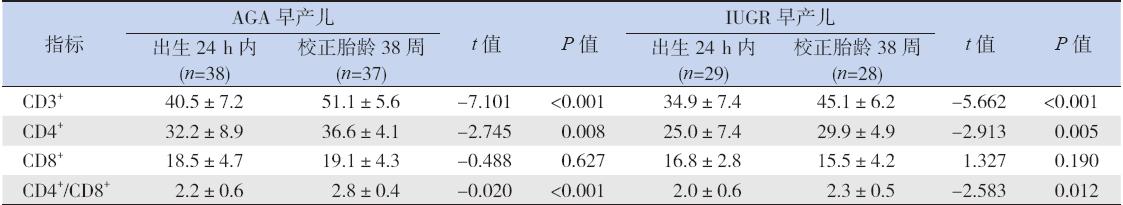
IUGR和AGA组早产儿校正胎龄38周时 CD3 + 、CD4 + 及CD4 + /CD8 + 高于出生后24 h内,差 异有统计学意义(P<0.05);CD8+在两组早产儿 出生24 h内和校正胎龄38周时比较差异无统计学 意义(P>0.05)。校正胎龄38周时IUGR早产儿 CD3 + 、CD4 + 、CD8 + 及CD4 + /CD8 + 低于AGA早产 儿(分别t=-4.092、-6.007、-3.329和-3.918,均P<0.01)。见表3。
| 表 3IUGR和AGA组早产儿出生24 h内与校正胎龄38周时T淋巴细胞亚群水平比较 (x±s,%) |
T淋巴细胞中与临床联系极为密切的是 CD4 + 、CD8 + T细胞,其水平变化及平衡状态反映 机体细胞免疫功能。有研究报道,早产儿IgA、 IgG、IgM水平低于足月儿,其中IgG水平更低, 可能的原因是由于早产儿过早娩出未能在母体内 获得足够的IgG [7] ;有研究结果显示,早产儿在出 生早期(<7 d)外周血CD3 + 、CD4 + 、CD8 + 、和 CD4 + /CD8 + 低于足月儿,提示早产儿的免疫系统发 育不完善 [8, 9] 。本研究发现AGA早产儿出生后24 h 内CD3 + 、CD4 + 及CD4 + /CD8 + 低于健康足月儿,与 上述报道相似。目前,有关IUGR早产儿T淋巴细 胞亚群功能的研究报道尚少,Thilaganathan等 [10] 报道19例24~37周IUGR的早产儿外周血T淋巴 细胞亚群CD3 + 、CD4 + 、CD8 + 及CD4 + /CD8 + 低于同 胎龄的AGA早产儿,分析其原因可能由于IUGR早产儿胎盘功能不全所致。杨明今等 [11] 报道, IUGR组(胎龄36.88±2.29周)外周血CD3 + 、 CD4 + 、CD4 + /CD8 + 高于同胎龄AGA组,认为其结 果系IUGR早产儿宫内不良环境包括缺氧、潜在感 染、微量元素缺乏等对胎儿的不良刺激所致,机 制不详。
本研究结果显示,IUGR早产儿生后24 h 内CD3 + 、CD4 + 、CD8 + 及CD4 + /CD8 + 低于足月 儿,CD3 + 和CD4 + 水平低于AGA早产儿,与 Thilaganatha等 [10] 研究结果相似,提示IUGR早产 儿存在T淋巴细胞免疫功能缺陷。导致IUGR的因 素存在个体差异,可能是营养不良、感染、缺氧、 胎盘、胎儿本身,这些因素致胎儿在胸腺等发育 过程中出现异常情况,国外有报道导致IUGR的主 要原因为子宫胎盘功能不全 [12] ,本研究对象排除 了常见的或已明确可能导致IUGR的一些疾病(包 括母亲、胎儿、胎盘方面),属于原因不明的特发性IUGR早产儿,上述结果的差异不排除与研究 对象的宫内、母亲、胎儿本身情况不同有关。
文献报道,正常早产儿生后3个月CD3 + 、 CD4 + 、CD8 + 与足月儿比较已无差异 [13] 。亦有报道 正常早产儿生后1个月时T淋巴细胞数量即能达 到正常新生儿水平 [14] 。显示正常早产儿生后T淋 巴细胞免疫功能在不断完善,呈快速追赶趋势, 可能是因为早产儿生后数周内胸腺快速增长,相 对快于足月儿,本研究未将早产儿与足月儿的后 期对比纳入研究范畴。校正胎龄38周时,IUGR、 AGA早产儿CD3 + 、CD4 + 、CD4 + /CD8 + 高于生后 24 h内,表明IUGR、AGA早产儿生后T淋巴细 胞亚群数量都呈逐渐增加趋势。校正胎龄38周 时IUGR早产儿CD3 + 、CD4 + 、CD8 + 及CD4 + /CD8 + 均低于AGA早产儿,提示IUGR早产儿免疫功能 已受到损伤,这种损伤将持续到生后一段时间。 IUGR患儿随访追踪的早期研究报道,IUGR患儿 T淋巴细胞出生时明显低于对照组,这种情况可能 持续到生后至少1年,甚至青春期 [15] 。动物模型 发现出生前和或出生后营养不良导致的这种损伤 可持续至成年期,甚至下一代 [16] 。目前有关IUGR 的T淋巴细胞功能的相关实验尚不多,需更多的 基础研究,包括动物模型的建立和相关机制的探 讨。
IUGR早产儿生后24 h内的外周血T淋巴细 胞绝对计数低于AGA早产儿及足月儿。总体情况, IUGR早产儿外周血T淋巴细胞亚群绝对计数变化 与外周血CD3 + T淋巴细胞变化相似。
综上,IUGR早产儿T淋巴细胞亚群功能低于 AGA早产儿及健康足月儿,这种相对免疫低下状 态将持续到生后一段时间,IUGR早产儿早期易合 并严重感染,其感染不易控制,与其T淋巴细胞 功能低下有关。对IUGR早产儿应加强管理和监控, 必要时给予免疫支持。
| [1] | 魏克伦, 杨于嘉, 姚裕家, 等.中国城市早产儿流行病学初步调查报告[J].中国当代儿科杂志, 2005, 7(1): 25-28. |
| [2] | Chauhan SP, Gupta LM, Hendrix NW, et al. Intrauterine growth restriction: comparison of American College of Obstetricians and Gynecologists practice bulletin with other national guidelines[J]. Am J Obstet Gynecol, 2009, 200(4): 409. |
| [3] | Sharma AA, Jen R, Butler A, et al. The developing human preterm neonatal immune system: a case for more research in this area[J]. Clin Immunol, 2012, 145(1): 61-68. |
| [4] | Rees S, Harding R, Walker D. An adverse intrauterine environment: implications for injury and altered development of the brain[J]. Int J Dev Neurosci, 2008, 26(1): 3-11. |
| [5] | Ojeda NB, Grigore D, Alexander BT. Intrauterine growth restriction: fetal programming of hypertension and kidney disease[J]. Adv Chronic Kidney Dis, 2008, 15(2): 101-106. |
| [6] | 邵晓梅,叶鸿瑁,丘小汕. 实用新生儿学[M]. 第四版.北京:人民卫生出版社,2011:71-75. |
| [7] | Field CJ. The immunological components of human milk and their effect on immune development in infants[J]. J Nutr, 2005, 135(1): 1-4. |
| [8] | Adkins B. T-cell function in newborn mice and humans[J]. Immunol Today, 1999, 20(7): 330-335. |
| [9] | 张红珊,苏浩彬,魏菁, 等.不同胎龄及出生体重早产儿T淋巴细胞亚群水平及影响因素[J]. 广东医学, 2007, 28(3): 457-458. |
| [10] | Thilaganathan B, Plachouras N, Makrydimas G, et al. Fetal immunodeficiency: a consequence of placental insufficiency[J]. BJOG, 1993, 100(11): 1000-1004. |
| [11] | 杨明今, 沈月华, 刘志伟, 等. 新生儿 AGA 与 SGA 的 T 细胞亚群分布探讨[C].//中华医学会第五次全国围产医学学术会议论文汇编, 2005: 256-257. |
| [12] | Aluvihare VR, Kallikourdis M, Betz AG. Regulatory T cells mediate maternal tolerance to the fetus[J]. Nat Immunol, 2004, 5(3): 266-271. |
| [13] | Bo L, Wang F, Zhu J, et al. Granulocyte-colony stimulating factor (G-CSF) and granulocyte-macrophage colony stimulating factor (GM-CSF) for sepsis: a meta-analysis[J]. Critical Care, 2011, 15(1): R58. |
| [14] | Kuhn P, Messer J, Paupe A, et al. A multicenter, randomized, placebo-controlled trial of prophylactic recombinant granulocyte-colony stimulating factor in preterm neonates with neutropenia[J]. J Pediatr, 2009, 155(3): 324-330. |
| [15] | McDade TW, Beck MA, Kuzawa C, et al. Prenatal undernutrition, postnatal environments, and antibody response to vaccination in adolescence[J]. Am J Clin Nutr, 2001, 74(4): 543-548. |
| [16] | Neumann CG, Stiehm ER, Zahradnick J, et al. Immune function in intrauterine growth retardation[J]. Nutr Res, 1998, 18(2): 201-224. |
 2014, Vol. 16
2014, Vol. 16