川崎病(Kawasaki disease,KD)又称为皮肤 黏膜淋巴结综合征,是一种好发于5岁以下儿童 和婴幼儿的急性全身血管炎性疾病,以合并冠状 动脉损害(coronary artery lesion,CAL)最为严重, 目前该病已取代风湿热成为儿童后天获得性心脏 病的首位原因之一 [1, 2] 。其发病机制尚不清楚,目前多认为KD是全身中小血管非特异性炎性反应, 从而导致全身血管内皮细胞乃至血管壁全层炎症 性损伤。抵抗素和内脂素是近年新发现的脂肪因 子,与组织损伤及修复和炎症反应关系密切 [3] ;研 究发现抵抗素和内脂素在KD患儿急性期血清中表 达明显升高 [4] 。然而,目前关于抵抗素和内脂素在 丙种球蛋白(intravenous immune globulin,IVIG)治 疗KD前后含量变化的研究较少,仅仅是抵抗素和 内脂素在KD治疗前表达升高,并未就IVIG治疗 后其含量作相关研究。本文重点观察KD患儿血清 抵抗素和内脂素含量的变化以及IVIG治疗后对其 含量的影响,以期探讨监测KD患儿治疗前后血清 抵抗素和内脂素含量变化的临床意义。
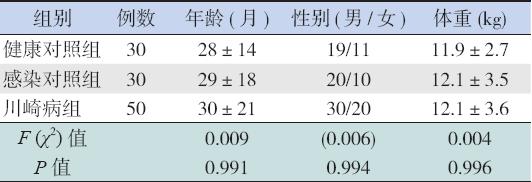
选择2011年1月至2013年1月于三峡大学 人民医院门诊就诊和住院的KD患儿50例为研究 对象,均符合2002年日本厚生劳动省川崎病研究 协作组第5次修订诊断标准 [1] ,其中男30例,女 20例,平均年龄30±21个月。另外选择来自我院 体检中心行健康体检的30例健康儿童和于我科住 院的30例患急性感染性疾病患儿(包括12例支 气管炎、8例咽炎、6例胃肠炎和4例幼儿急疹) 作为对照。3组儿童在年龄、性别和体重上差异无 统计学意义(表1)。所有KD患儿均接受口服阿 司匹林和IVIG(2 g/kg)治疗,使用IVIG 48 h后 患儿仍持续发热,则视为IVIG治疗无效。CAL包 括扩张、狭窄或冠状动脉瘤。CAL诊断标准参照《诸 福棠实用儿科学》 [5] 。研究方案经医院伦理委员会 批准并由家长签署知情同意书。
| 表 13组儿童的一般资料 (x±s或例) |
肝素抗凝管分 别留取KD患儿急性期IVIG治疗前及治疗48 h后 的静脉血各5 mL,以及感染对照组和健康对照组 儿童的静脉血5 mL,立即分离血清,-80℃冰箱保 存。双抗ELISA法同批检测3组血清抵抗素和内 脂素水平,操作步骤严格按照试剂盒说明书进行。 450 nm波长测量吸光度值(A值),并绘制标准 曲线,求出这两种脂肪因子的浓度。抵抗素和内 脂素ELISA试剂盒购自美国GBD公司。
KD患儿IVIG治疗前的血白 细胞和CRP等生化指标检测均由我院检验科完成。
采用SPSS 13.0统计软件对数据进行统计学分 析,计量资料以均数±标准差(x±s)表示,两 组间比较采用独立样本或配对t检验,多组间比较 采用单因素方差分析,组间两两比较采用SNK-q 检验;计数资料采用百分比(%)表示,组间比较 采用χ2检验,当理论频数在1~<5时采用校正的χ2 检验,P<0.05为差异有统计学意义。
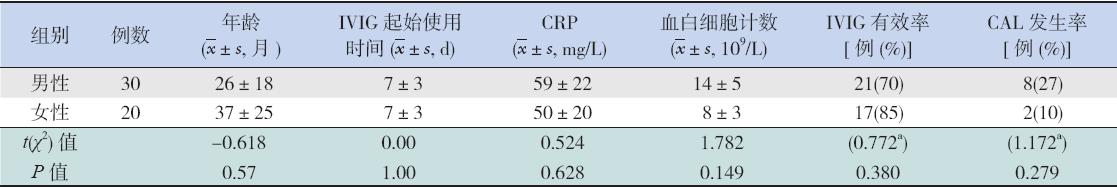
50例KD患儿中,38例患儿对IVIG有效 (76%),其中男21例,女17例,不同性别患儿 在年龄、IVIG起始使用时间、CRP水平、血白细 胞计数、IVIG有效率以及CAL发生率上比较差异 均无统计学意义(均P>0.05);全部KD患儿均 行超声心动图检查,发现10例患儿出现CAL,但 均未发现冠状动脉瘤形成。见表2。
| 表 2KD患儿的临床资料 |
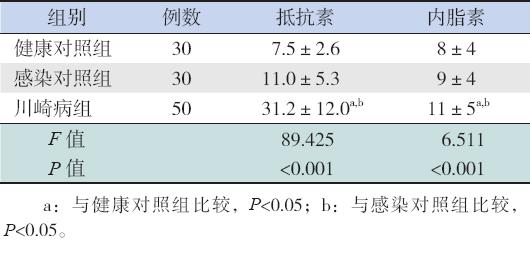
3组儿童的血清抵抗素和内脂素水平差异均有 统计学意义(均P<0.001)。其中KD组患儿的血 清抵抗素和内脂素水平均明显高于健康对照组及 感染对照组(均P<0.05)。见表3。
| 表 33组儿童血清抵抗素和内脂素的表达比较 (x±s,ng/mL) |
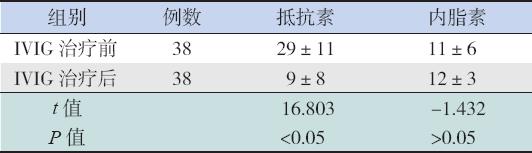
38例IVIG治疗有效的KD患儿中,治疗后血清抵抗素水平较治疗前明显下降(P<0.05);内脂 素水平在治疗前后差异无统计学意义(P>0.05)。 见表4。
| 表 4IVIG治疗有效的KD患儿治疗前后血清抵抗素和内脂素水平比较 (x±s,ng/mL) |
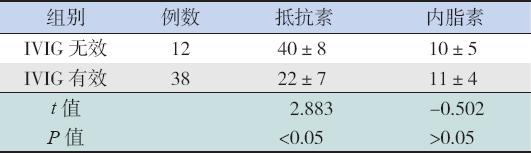
38例IVIG治疗有效患儿治疗前血清抵抗素水 平明显低于12例IVIG治疗无效患儿(P<0.05);治疗前血清内脂素水平在IVIG治疗有效及无效患 儿间差异无统计学意义(P>0.05)。见表5。
| 表 5IVIG治疗有效与无效KD患儿治疗前抵抗素和内脂素水平比较 (x±s,ng/mL) |
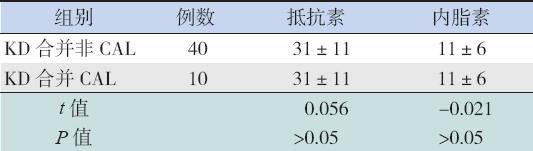
3KD合并CAL患儿血清抵抗素和内脂素水平 与KD合并非CAL患儿比较,差异均无统计学意 义(均P>0.05)。见表6。
| 表 6KD合并CAL与非CAL患儿血清抵抗素和内脂素水平比较 (x±s,ng/mL) |
KD是一种以全身血管炎为主要病理特点的疾 病,表现为内皮细胞水肿和炎症细胞浸润。其发 病机制目前尚未清楚,一般认为是单核/巨噬细胞 参与的免疫激活,一氧化氮参与的血管损伤,以 及血管内皮功能紊乱和损伤等导致的全身中小血 管的炎症反应[6]。
抵抗素是2001年发现的存在于血清中富含半 胱氨酸的分泌性蛋白,属于抵抗素样分子家族成 员,人的抵抗素主要在外周血单核细胞中表达, 并在向巨噬细胞分化时表达增加。体外实验提示, 抵抗素可能与单核和巨噬细胞的功能有关 [7] 。本研 究中KD组患儿急性期血清抵抗素含量明显高于感 染对照和健康对照儿童,这和王晓岩等 [4] 研究结 果一致,所以推测KD患儿血清抵抗素的高表达可 能是与巨噬细胞高表达有关。有研究发现,抵抗 素可通过激活NF-κB途径增加血管细胞黏附分子 等表达,促进单核细胞与内皮细胞黏附,导致内 皮功能紊乱,从而趋化更多的单核细胞分化为巨 噬细胞,引起高抵抗素血症,作用于中小血管, 导致血管炎症反应 [8] 。总之,这些都提示抵抗素可 能参与了KD的内皮损伤和血管炎症反应。
静脉注射IVIG治疗是目前公认的治疗KD的 首选方案;可能机制是IVIG能封闭血液中的单核 细胞、血小板或血管内皮细胞表面的Fc受体,从 而阻断了血管表面的免疫炎症反应。应用IVIG的 起始时间是KD合并CAL的危险因素之一 [8] 。本 研究KD患儿使用IVIG的时间为4~10 d,与既往 研究一致 [9] 。结果发现静脉注射IVIG治疗48 h能 明显降低KD患儿急性期血清抵抗素的含量,这进 一步提示抵抗素参与了KD的血管炎症反应。同时 本研究发现IVIG治疗无效KD患儿组血清抵抗素 较治疗有效组明显升高,提示早期检测抵抗素浓 度有助于判断KD患儿IVIG治疗效果。
内脂素是脂肪因子家族的新添成员,主要在 脂肪组织中特异表达,其作为一种促炎因子参与 了肥胖的炎症过程 [9, 10] 。同样,内脂素在败血症抗 中性粒细胞凋亡的过程中发挥了重要作用 [11] ,在 急性肺损伤动物模型支气管肺泡灌洗液和循环中 内脂素水平增加 [12] ;这些都提示内脂素与炎症反 应关系密切。本研究中KD患儿急性期血清内脂素 含量明显升高,这提示内脂素可能参与了KD的炎 症反应。另外,本研究中IVIG治疗前后KD患儿 内脂素水平并无明显差异,这与抵抗素治疗前后 的变化并不一致。然而,有研究发现KD患儿急性 期内脂素含量和抵抗素含量呈明显正相关 [4] ,可能 原因是:内脂素仅仅是KD血管炎症反应的效应分 子,并未进一步诱导血管内皮功能紊乱,其具体 原因尚需深入研究探讨。
脂肪组织分泌的多种脂肪因子广泛地影响和 调节机体的能量代谢,并在维持正常机体的炎症 反应、血管内皮细胞和平滑肌细胞功能等多方面具有重要影响。本研究表明KD患儿血清中抵抗素 和内脂素可能参与了KD的疾病发生和发展;抵抗 素可以作为KD有效治疗的预测指标之一,具体机 制尚需进一步研究。
| [1] | Ayusawa M, Sonobe T, Uemura S, et al. Revision of diagnostic guidelines for Kawasaki disease(the 5th revisededition)[J]. Pediatrint, 2005, 47(2): 232-234. |
| [2] | Kowalczyk M, Turska-Kmiec A, Ziolkowska L, et al. Symptoms, diagnosis and characteristic abnormalities in the coronary arteries in Kawasaki disease in children[J]. Med Wieku Rozwoj, 2010, 14(4): 344-349. |
| [3] | Tilg H, Moschen AR. Adipocytokines: mediators linking adipose tissue, inflammation and immunity[J]. Nat Rev Immunol, 2006, 6(10): 772-783. |
| [4] | 王晓岩, 黄友敏, 张伟丽. 川崎病患儿内脂素和抵抗素的含量变化[J]. 中华临床医师杂志, 2011, 5(3): 866-867. |
| [5] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7版. 北京: 人民卫生出版社, 2002: 1119-1120. |
| [6] | Takahashi K, Oharaseki T, Yokouchi Y. Pathogenesis of Kawasaki disease[J]. Clin Exp Immunol, 2011, 164 Suppl 1: 20-22. |
| [7] | Kakizaki S, Sohara N, Yamazaki Y, et al. Elevated plasma resistin concentrations in patients with liver cirrhosis[J]. J Gastroenterol Hepatol, 2008, 23(1): 73-77. |
| [8] | Verma S, Li SH, Wang CH, et al. Resistin promotes endothelial cell activation: further evidence of adipokine-endothelial interaction[J]. Circulation, 2003, 108(6): 736-740. |
| [9] | 胡景伟, 杨凌, 郑承宁, 等. 川崎病并发冠状动脉病变的临床特点[J]. 中国当代儿科杂志, 2010, 12(3): 228-230. |
| [10] | Fukuhara A, Matsuda M, Nishizawa M, et al. Visfatin: a protein secreted by visceral fat that mimics the effects of insulin[J]. Science, 2005, 307(5708): 426-430. |
| [11] | Li RZ, Ma Xn, Hu XF, et al. Elevated visfatin levels in obese children are related to proinflammatory factors[J]. J Pediatr Endocrinol Metab, 2013, 26(1-2): 111-118. |
| [12] | Jia SH, Li Y, Parodo J, et al. Pre-B cell colony-enhancing factor inhibits neutrophil apoptosis in experimental inflammation and clinical sepsis[J]. J Clin Invest, 2004, 113(9): 1318-1327. |
 2014, Vol. 16
2014, Vol. 16