川崎病(Kawasaki disease,KD)是一种好发于 5岁以下儿童的急性全身性非特异性的血管炎综合 征,目前KD的病因和发病机制还不完全清楚, 一般认为血管内皮细胞损伤是KD的基础病变。髓系相关蛋白8、14(myeloid-related protein-8 and -14,MRP-8、-14)是S100钙结合蛋白家族成员, 主要通过钙离子依赖性方式形成特殊的异二聚体 MRP-8/MRP-14而发挥作用。已有研究表明MRP- 8/MRP-14蛋白复合体能与内皮细胞结合,导致血 管内皮细胞损伤 [1] ,在系统性血管炎的炎性活动中 起重要作用 [2] 。鉴于KD的基本病理改变及MRP- 8/MRP-14对内皮细胞的作用,有理由认为MRP- 8/MRP-14高表达在KD的发生过程中起重要作用, 为了明确二者之间关系,本研究对41例KD患儿 和40例一般发热患儿的血清MRP-8/MRP-14含量 和循环单个核细胞MRP-8 mRNA、MRP-14 mRNA 表达进行了检测并与循环内皮细胞数(circulating endothelial cells,CECs)进行比较,报道如下。
选取2010年3月至2011年9月于荆门市第 一人民医院儿科住院的41例KD患儿为研究对象 其中男24例,女17例,年龄2个月~5岁,所有 患儿均符合2004年美国儿科学会和心脏病学会联 合制定的川崎病诊断标准 [3] ,且回顾性诊断没有误 诊。根据彩色多普勒超声诊断是否合并冠状动脉 扩张,将41例KD患儿分为冠状动脉扩张KD组 (n=15)和冠状动脉无扩张KD组(n=26),同时 选取同期年龄和性别相匹配的急性上呼吸道感染 发热患儿40例为对照组。
采集所有患儿外周静脉血 5 mL,其中1 mL用EDTA抗凝后离心分离血浆 于-70℃冰箱保存待测MRP8/MRP14;余4 mL肝 素抗凝后即刻分离外周血单个核细胞,一部分于 12 h内提取RNA用于RT-PCR的检测,一部分用 于流式细胞检测。
人MRP-8/MRP-14 ELISA试 剂盒由美国R&D systems公司生产,CD45-PE- Cy5、CD146-PE单抗均由美国Beton-Dickinson公司生产。
用纯化的人MRP-8/MRP-14抗体包被微孔 板,制成固相抗体。在包被MRP-8/MRP-14单抗 的微孔中加入待检标本,再与生物素化的人MRP- 8/MRP-14抗体结合,形成免疫复合物连接在板上, 洗涤后再加入辣根过氧化物酶标记的链霉亲和 素,彻底洗涤后加入TMB显色液显色,酶标仪在 450 nm波长下测定吸光度值,通过标准曲线计算 样品中MRP-8/MRP-14浓度。
采用Ficoll分 离外周血单个核细胞,抽提总RNA,逆转录合 成cDNA。引物用Primer 5.0软件设计,由武汉意 德生物技术有限公司设计合成,MRP-14上游引 物:5'-TCCACCAATACTCTGTGAAGCTG-3',下 游引物:5'-CCTCCATGATGTGTTCTATGACC-3', 片段长度201 bp;MRP-8上游引物: 5'-AATTGCTAGAGACGAGTGTCCTCA-3',下 游引物:5'-TGCCACGCCCATCTTTATCA-3', 片段长度105 bp;GAPDH上游引物: 5'-GCACCGTCAAGGCTGAGAAC-3',下游引物: 5'-ATGGTGGTGAAGACGCCAGT-3',片段长度 271 bp。PCR反应体系:10×PCR buffer 5μL, 10 mM dNTPMix 5μL,RT-PCR产物cDNA 2μL,上、 下游引物(20μmol/L)各0.5μL,Taqpolymerase 0.25μL,灭菌水补足总反应体系体积为50μL。反 应条件:94℃预变性5 min;94℃变性45 s,55℃ 退火50 s,72℃延伸1 min,30个循环;72℃再延 伸10 min。PCR产物于2%琼脂糖凝胶上进行电泳, 采用Kodak Digital Science System DC40凝胶成像系 统对图像进行采集,应用图像分析软件进行各条 带平均灰度值分析,以同时扩增的GAPDH为内参 照,用目的基因条带灰度与GAPDH条带灰度比值 表示目的基因相对表达量。
Ficoll分离外周 血单个核细胞,取50μL备测细胞悬液到已加入 10μL CD45-PE-Cy5、CD146-PE的专用流式试管中,振荡混匀,室温避光孵育15 min,加入溶血 剂500μL,振荡混匀,室温避光孵育10 min,完 全溶血后在15 min内上流式细胞仪检测。根据同 期患者血常规检查结果中每毫升淋巴细胞(L)及 单核细胞(M)绝对数,结合流式细胞仪测得的内 皮细胞与单个核细胞比例(R%)计算每毫升中的 CECs:CECs=(L+M)×R%。
采用SPSS 17.0统计学软件对数据进行统计 学分析。计量资料采用均数±标准差(x±s)表 示,多组间比较采用F检验,组间两两比较采用 SNK-q检验,MRP-8/MRP-14含量与CECs的关系 采用Pearson积差相关分析法进行分析。P<0.05为 差异有统计学意义。
3组间血清MRP-8/MRP-14含量差异有统计 学意义(F=396.87,P<0.001),其中冠状动脉扩 张KD组MRP-8/MRP-14含量(1799±250 ng/mL) 高于冠状动脉无扩张KD组(1185±195 ng/mL) (P<0.05),且两组的MRP-8/MRP-14含量均高于 对照组(280±139 ng/mL)(均P<0.05)。
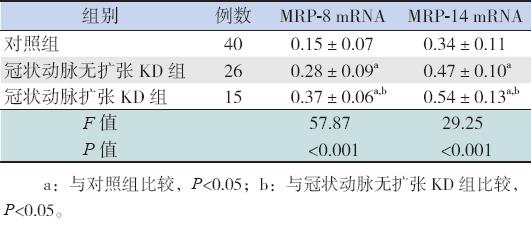
冠状动脉扩张KD组MRP-8和MRP-14 mRNA表达水平均高于冠状动脉无扩张KD组(均 P<0.05),且两组MRP-8和MRP-14 mRNA表达 水平均高于对照组(均P<0.05)。见图 1,表1。
 |
图 1 各组MRP-8及MRP-14 mRNA RT-PCR电泳图 M:Marker;1:对照组;2:冠状动脉无扩张KD组;3:冠状动脉扩张KD组。 |
| 表 1各组血清MRP-8和MRP-14 mRNA水平比较 (x±s) |
3组间CECs差异均有统计学意义(F=133.23、 P<0.001),其中冠状动脉扩张KD组CECs(588± 110/mL)高于冠状动脉无扩张KD组(392± 160/mL)(P<0.05),且两组CECs均高于对照组 (66±43/mL)(均P<0.05)。见图 2。
 |
图 2 各组CECs流式细胞仪检测图 图中方框内所示为各组CECs。 |
Pearson积差相关分析显示,KD患儿CECs与 血清MRP-8/MRP-14含量呈显著正相关(r=0.69, P<0.05)。见图 3。
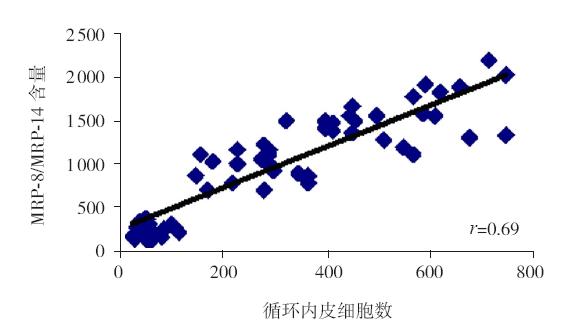 |
图 3 CECs与血清MRP-8/MRP-14含量线性相关图 |
KD是一种好发于5岁以下儿童的急性全身性 非特异性的血管炎综合征,容易侵犯冠状动脉, 部分患儿形成冠状动脉瘤,是引起儿童后天性心 脏病的主要原因 [4] ,至今KD的病因和发病机制还 不完全清楚。一般认为KD可能的发病机制是在具 有遗传易感体质基础上,由于感染因素的影响而 发生的异常免疫应答导致T淋巴细胞、B淋巴细胞 及单核-巨噬细胞激活后释放细胞因子,引起血 管内皮细胞的损伤而出现相应的临床表现 [5]。
MRP-8、MRP-14又称S100A8、S100A9蛋 白,是S100钙结合蛋白家族成员,主要通过钙离 子依赖性方式形成特殊的异二聚体MRP-8/MRP- 14而发挥作用 [6] 。MRP-8/MRP-14具有广泛的细 胞内和细胞外生物学功能,能被特异性地分泌至 炎症病灶处,是中性粒细胞化学趋化性和黏附性 强有力的诱导剂,并与炎症高度相关 [7] ,在各种 急慢性炎性病变中起主要作用,如类风湿性关节 炎、炎性肠病都发现MRP-8/MRP-14二聚体浓度 升高 [8, 9] 。已有研究表明MRP-8/MRP-14蛋白复合 体能通过硫酸乙酰肝素蛋白多糖或羧基-N-葡 聚糖作用与内皮细胞结合 [10] ,表明MRP-8/MRP- 14与血管内皮细胞有重要的相互作用。在体外人 类微血管内皮细胞中MRP-8/MRP-14能诱导血栓 形成导致血小板粘附、聚集和炎症反应,增加血 管内皮细胞的通透性,破坏内皮细胞单层的完整性,表明MRP-8/MRP-14与系统性血管炎的炎 性活动密切相关。
本研究检测了41例KD患儿和40例普通发 热患儿血清MRP-8/MRP-14二聚体含量和外周血 单个核细胞MRP-8、MRP-14 mRNA表达,结果显 示KD患儿血清MRP-8/MRP-14二聚体含量和外周 血单个核细胞MRP-8、MRP-14 mRNA表达均明显 高于对照组,且上述指标在伴有冠状动脉扩张的 KD患儿中要高于无冠状动脉扩张的KD患儿,证 实MRP-8、MRP-14在KD的发病中起重要作用, 是引起冠状动脉扩张的重要因素,推测KD发病过 程中存在免疫系统的异常激活,活化的T细胞、B 细胞、中性粒细胞、单核/巨噬细胞分泌MRP-8、 MRP-14从而介导了血管内皮细胞的损伤,但致病 因素如何激活炎性细胞导致MRP-8、MRP-14的高 表达机制还不清楚。
CECs为脱落的血管内皮细胞,20世纪70 年代由Bouvier提出,能表达较为具有特异性的 CD146膜糖蛋白,在正常人血中数量极少,而在 很多血管损伤性疾病如肿瘤形成和心血管疾病等 情况下数量可明显增加,可作为血管损伤的标记 物 [12, 13, 14, 15] 。本研究在检测MRP-8、MRP-14 mRNA的 同时采用特异性的CD-146单抗标记并与外周血白 细胞作比较通过流式细胞仪检测了CECs,结果显 示KD患儿CECs较因急性上呼吸道感染而发热的 普通发热患儿明显增加,且伴有冠状动脉扩张的 KD患儿CECs高于无冠状动脉扩张的KD患儿, 进一步证实血管内皮细胞的损伤是KD发病并导 致冠状动脉扩张的重要原因。通过MRP-8/MRP-14 与CECs进行Pearson积差相关性分析显示二者呈 正相关,说明KD患儿血管内皮细胞的损伤系由 MRP-8/MRP-14介导所致,具体作用的分子机制还 需进一步研究明确。
| [1] | Robinson MJ, Tessier P, Poulsom R, et al. The S100 family heterodimer, MRP-8/14, binds with high affinity to heparin and heparan sulfate glycosaminoglycans on endothelial cells[J]. J Biol Chem, 2002, 277(5): 3658-3665. |
| [2] | Pepper RJ, Hamour S, Chavele KM, et al. Leukocyte and serum S100A8/S100A9 expression reflects disease activity in ANCA-associated vasculitis and glomerulonephritis[J]. Kidney Int, 2013, 83(6): 1150-1158. |
| [3] | Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis,treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association[J]. Circulation, 2004, 110(17): 2747-2771. |
| [4] | 李焰, 王献民, 柳颐龄, 等. 川崎病患儿并发冠状动脉病变的危险因素分析[J]. 中国当代儿科杂志, 2012, 14(12): 938-941. |
| [5] | 段超, 杜忠东, 王玉, 等. 川崎病冠脉瘤患儿远期血管内皮功能的研究[J]. 中国当代儿科杂志, 2011, 13(5): 373-376. |
| [6] | Roth J, Vogl T, Sorg C, et al. Phagocyte-specific S100 proteins: a novel group of proinflammatory molecules[J]. Trends Immunol, 2003, 24(4): 155-158. |
| [7] | Maiseyeu A, Badgeley MA, Kampfrath T, et al. In vivo targeting of inflammation-associated myeloid-related protein 8/14 via gadolinium immunonanoparticles[J]. Arterioscler Thromb Vasc Biol, 2012, 32(4): 962-970. |
| [8] | Holzinger D, Frosch M, Kastrup A, et al. The Toll-like receptor 4 agonist MRP8/14 protein complex is a sensitive indicator for disease activity and predicts relapses in systemic-onset juvenile idiopathic arthritis[J]. Ann Rheum Dis, 2012, 71(6): 974-980. |
| [9] | Manolakis AC, Kapsoritakis AN, Tiaka EK, et al. Calprotectin, calgranulin C, and other members of the S100 protein family in inflammatory bowel disease[J]. Dig Dis Sci, 2011, 56(6): 1601-1611. |
| [10] | Viemann D, Barczyk K, Vogl T, et al. MRP8/MRP14 impairs endothelial integrity and induces a caspase-dependent and independent cell death programn[J]. Blood, 2007, 109(6): 2453-2460. |
| [11] | Donato R. Intracellular and extracellular roles of S100 proteins[J]. Microsc Res Tech, 2003, 60(6): 540-551. |
| [12] | Bertolini F, Shaked Y, Mancuso P. On the clinical relevance of circulating endothelial cells and platelets in prostate cancer[J]. Br J Cancer, 2013, 108(6): 1387. |
| [13] | Lampka M, Grabczewska Z, Jendryczka-Mackiewicz E, et al. Circulating endothelial cells in coronary artery disease[J]. Kardiol Pol, 2010, 68(10): 1100-1105. |
| [14] | Campioni D, Zauli G, Gambetti S, et al. In vitro characterization of circulating endothelial progenitor cells isolated from patients with acute coronary syndrome[J]. PLoS One, 2013, 8(2): e56377. |
| [15] | Erdbruegger U, Dhaygude A, Haubitz M, et al. Circulating endothelial cells: markers and mediators of vascular damage[J]. Curr Stem Cell Res Ther, 2010, 5(4): 294-302. |
 2014, Vol. 16
2014, Vol. 16