亚甲基四氢叶酸还原酶(MTHFR)缺陷(MIM #236250)又被称为高同型半胱氨酸血症2型,是 一种少见的常染色体隐性遗传性疾病。MTHFR缺 陷导致血液叶酸、5-甲基四氢叶酸降低,同型半 胱氨酸水平升高,蛋氨酸降低,引起一系列病理 改变 [1] 。患者个体差异很大,临床症状缺乏特异性。 严重者于婴儿期起病,主要表现为智力运动落后、 癫癎和小头畸形,甚至早期死亡。轻症患者于学 龄期至成年发病,可表现为精神障碍、共济失调 或亚急性联合变性症状,少数患者无症状 [2] 。本文 拟就1例MTHFR缺陷导致的高同型半胱氨酸血症 合并脑叶酸缺乏症的精神分裂症学龄儿童病例进 行分析,并结合文献进行综述。
同型半胱氨酸在体内有两条代谢通路,一是 通过胱硫醚合成酶的催化形成胱硫醚,二是通过 蛋氨酸合成酶和5-甲基四氢叶酸的作用合成蛋氨 酸 [3] 。MTHFR缺陷导致5,10-亚甲基四氢叶酸向5- 甲基四氢叶酸的转化受限,继而引起5-甲基四氢 叶酸缺乏、高同型半胱氨酸血症和低蛋氨酸血症 [4] 。 此外,5-甲基四氢叶酸是血液和脑脊液循环中的 主要叶酸形式,参与多种物质代谢,MTHFR缺乏 患者血液及脑脊液中的叶酸水平下降,引起继发 性脑叶酸缺乏症 [5, 6, 7] 。高同型半胱氨酸血症、低蛋 氨酸血症、脑叶酸缺乏可能是导致MTHFR缺陷患 者的神经系统损伤的共同原因 [6, 7] 。
早发型MTHFR缺陷患者多于婴儿期起病, 病情严重,表现为智力运动落后、癫癎和小头畸形, 一些患者出现呼吸暂停。晚发型患者可于儿童至 成年发病,可表现为精神障碍、癫癎、共济失调 或类似维生素B12缺乏引起的亚急性联合变性样症 状 [7, 8] 。脑血管血栓是晚发型患者较为常见的死亡 原因 [9] 。此外,有报道患者出现类似Angelman综 合征的表现 [10] 。少数患者脑磁共振扫描可见脑萎 缩和脱髓鞘改变 [11] 。部分患者可能终身无症状 [8] 。
晚发型MTHFR缺陷患者以神经精神障碍为 主,缺乏特异性,临床诊断困难,对于原因不明的智力运动落后、癫癎、精神障碍、共济失调、 亚急性联合变性症状的患者需考虑该病的可能, 及早进行生化检查。血液及尿液总同型半胱氨酸 浓度测定是发现本病的关键技术,患者血及尿液 总同型半胱氨酸水平多显著升高 [2] 。为鉴别维生素 B12缺乏、叶酸缺乏、甲基丙二酸尿症合并同型半 胱氨酸血症等其他原因所导致的高同型半胱氨酸 血症,需检测患者血液维生素B12、叶酸、氨基酸、 酯酰肉碱及尿液有机酸谱 [12, 13] 。MTHFR缺陷患者 体内5-甲基四氢叶酸水平下降,引起继发性的血 清叶酸和蛋氨酸降低,血液酯酰肉碱谱及尿液有 机酸谱正常,脑脊液中叶酸、5-甲基四氢叶酸水 平降低 [2] 。虽然本病为叶酸代谢障碍,但患者血液 常规化验一般不合并大细胞贫血 [6] 。
基因诊断或酶活性检测是确诊的关键技术。 MTHFR活性检测可采用肝细胞、淋巴细胞、白细 胞、成纤维细胞,但需注意细胞周期对酶活性的 影响 [14] 。编码MTHFR的MTHFR基因位于染色体 1p36.3,含有11个外显子,现已报道了20多种致 病突变可导致严重的MTHFR酶活性缺陷 [15] 。此外, 关于MTHFR基因热点突变的研究也受到了多学科 广泛关注,可能与高血压、冠心病、胎儿神经管 缺陷、唐氏综合征等疾病有关 [16, 17, 18] 。
多数MTHFR缺陷患者可通过药物治疗获得良 好的控制,主要方法为口服甜菜碱(3~6 g/d,最 大量可达10 g/d)和亚叶酸(0.5~1.5 mg/kg·d)。 甜菜碱可帮助同型半胱氨酸通过甜菜碱甲基转移 酶转化成蛋氨酸。但大脑中不存在甜菜碱甲基转 移酶,5-甲基四氢叶酸是唯一能通过血脑屏障的 叶酸形式,因此亚叶酸是治疗MTHFR缺陷必不可 少的药物。对于合并贫血、营养不良、慢性胃肠 疾病、癫癎、精神障碍等合并症的患者,应给相 应营养支持与对症治疗 [19, 20] 。
早期治疗可有效防止MTHFR缺陷患者神经 系统损害及心脑血管损伤,最理想的治疗是出生 后即开始治疗。但是,目前尚缺乏适宜的新生儿 筛查技术进行血液总半胱氨酸检测以发现MTHFR 缺陷 [21] 。对于同型半胱氨酸血症1型,新生儿 筛查的原理为检测血液内升高的蛋氨酸,但是, MTHFR缺陷患者血液蛋氨酸降低或正常,通过目 前的新生儿筛查不能被检出。
患儿,男,13岁,因精神异常2年就诊。患 儿11岁起无明显诱因出现精神异常,表现为惊恐、 幻听、学习困难、入睡困难、脾气暴躁、发呆、 无故大笑、自言自语,后逐渐出现动作慢、反应慢。 有时述头痛、头晕,不伴抽搐、呕吐。于北京大 学第六医院就诊,被诊断为“精神分裂症” [24] ,口 服利培酮片、芮达、奥氮平等治疗1年余,症状 无明显好转,休学1年。近1年来便秘,易疲劳。
患儿为第1胎,在胎龄36周经剖宫产出生, 生后无窒息等围产期异常。11岁之前体格、智力 及运动发育正常,发病前为小学6年级学生,成 绩良好。父母健康,非近亲结婚,家族中无类似疾病家族史。
头围55 cm,身高170 cm,体重60 kg,无表 观畸形,心、肺、腹体查无异常。头颅、脊柱、 颅神经检查无异常。步态正常,四肢肌力、肌张 力正常,双膝腱反射对称适中,双侧踝阵挛阴性, 双侧巴氏征阴性。
血常规检查未见明显异常。血氨140μmol/L(正 常值<60μmol/L)。血糖、肝功能、肾功能、心肌 酶谱检查未见异常。脑电图检查未见异常。头颅 磁共振扫描未见明显异常。
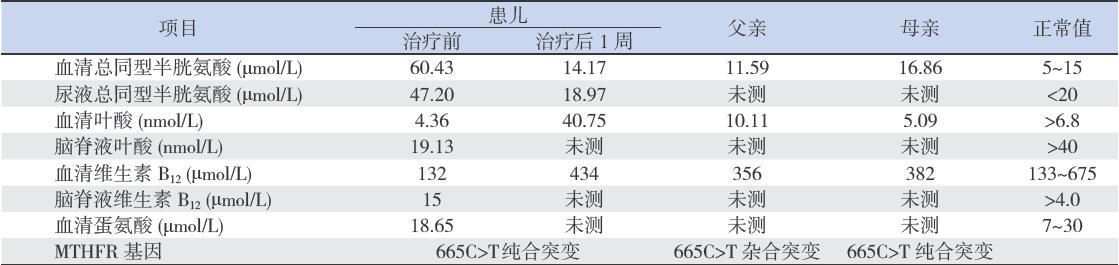
血液氨基酸、酯酰肉碱谱分析和尿液有机酸 分析未见异常,排除典型的氨基酸、脂肪酸和有 机酸代谢性疾病。血液及尿液总同型半胱氨酸显 著增高,血清及脑脊液叶酸降低,血清维生素B12 略低。父亲血清总同型半胱氨酸、叶酸及维生素 B12水平正常。母亲血清总同型半胱氨酸增高,叶 酸降低(表1)。
| 表 1患儿及其父母生化及基因分析结果 |
MTHFR基因家系分析(表1,图 1):患儿 存在665C>T(A222V)纯合突变,父亲为665C>T 杂合突变携带者,母亲存在665C>T纯合突变。结 合母亲的生化检测结果,母亲亦为MTHFR缺乏症 患者,但无明显临床症状。
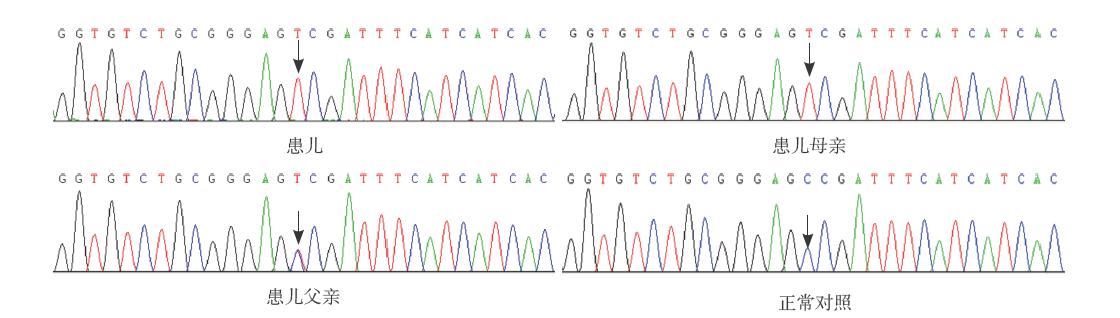 |
图 1 患儿及其父母MTHFR基因部分序列 患儿存在665C>T(A222V)纯合突变,父亲为665C>T杂合突变携带者,母亲存在665C>T纯合突变。箭头所指为MTHFR基因c.665位点。 |
患儿表现为晚期儿童期发生的精神障碍,无 其他系统症状,血、尿同型半胱氨酸水平明显升高, 血液、脑脊液中的叶酸水平显著降低,MTHFR基 因分析证实665C>T(A222V)纯合突变,符合 MTHFR缺陷所致高同型半胱氨酸血症2型诊断, 合并继发性脑叶酸缺乏症、精神分裂症。
确诊后开始口服亚叶酸钙15 mg/d,甜菜碱 1 g/d,维生素B6 20 mg/次,2次/d,肌内注射维 生素B12 1 mg/d。治疗1周后复查,患儿症状有所 好转,恐惧减轻,与家人语言及情感交流增多, 动作缓慢有所改善,但仍有发呆、无故大笑、不 敢独处的现象,血、尿总同型半胱氨酸水平降低 至正常,血清叶酸水平恢复正常((表1)。治疗 1月后随访,患儿恐惧现象明显好转,睡眠好,无 发呆、无故大笑发作,能与家人正常交流,抗精 神障碍药物逐渐减量。治疗3个月后复查,患儿 情绪活泼,精神状况正常,复学后适应良好。现 在14岁,治疗后1年,初中一年级学生,正常就读, 亚叶酸钙、甜菜碱、维生素B12维持治疗。
MTHFR缺陷是较常见的遗传性叶酸代谢障碍 性疾病之一,也是遗传性高同型半胱氨酸血症的 主要病种之一。MTHFR是叶酸参与的同型半胱氨 酸再甲基化过程中的关键酶。患者的临床表现多 样,可导致神经精神损害、智力运动落后、血管 疾病等,严重患者早期死亡,温和型可终身无症状。 本例起病隐匿,无明显发病诱因,11岁之前健康, 11岁之后出现精神障碍,临床表现符合“精神分 裂症”诊断 [24] ,近2年的精神类药物治疗无明显 疗效。血、尿总同型半胱氨酸水平显著增高,符 合高同型半胱氨酸血症诊断。患儿血、脑脊液的 叶酸水平降低,提示MTHFR缺乏,经基因检测发 现MTHFR基因665C>T纯合突变(即既往文献报 道的677 C>T突变 [25] ),确诊为MTHFR缺陷,为 我国首例通过脑脊液叶酸测定及基因分析确诊的 MTHFR缺陷儿童病例。
1975年国外报道了以精神分裂症发病的 MTHFR缺陷的病例 [26] 。患者为15岁女孩,表现为无明显诱因的妄想、幻觉、紧张,精神科治 疗无效,对吡哆醇和叶酸治疗有反应。从此,关 于MTHFR与精神分裂症的相关性受到了广泛关 注。Lewis等 [27] 在2005年对MTHFR和精神分裂 症进行meta分析,结果提示MTHFR缺陷是导致 精神分裂症的高危因素之一。Allen等 [28] 2008年 对1211例精神分裂症患者和1729例对照患者进 行了meta分析,结果发现MTHFR基因677C>T 和2289C>T突变与精神分裂症密切相关,这两种 突变都会造成MTHFR活性下降。我国邓红等 [29] 在2002年对115个精神分裂症家系患者进行了 MTHFR基因677C>T突变与精神分裂症的连锁不 平衡分析,分析结果表明发病年龄在25岁以下的 患者中,MTHFR基因突变与精神分裂症存在连锁 不平衡关系,提示677C>T突变可能为精神分裂症 的易感基因之一。以上研究显示,MTHFR缺乏与 精神分裂症有一定的相关性。对于精神分裂症患 者应注意患者血清及尿液总同型半胱氨酸和叶酸 水平,必要时进行脑脊液叶酸测定及基因检查, 协助病因诊断。665C>T突变是全球较高的致病突 变,Wilcken等 [30] 对来自16个地区的7000名新 生儿进行筛查,携带者高达19.8%,在中国北方人 群中较为常见。665C>T纯合突变导致MTHFR活 性下降,患者血中同型半胱氨酸水平明显升高 [31] 。
MTHFR缺乏患者对亚叶酸、甜菜碱等药物反 应良好,对于青少年期发病的精神分裂症患儿应 注意进行鉴别诊断,争取早期正确的对因治疗。
小结:MTHFR缺陷是遗传代谢病中可治疗 的疾病之一,早期诊断、亚叶酸及甜菜碱等药物 治疗是改善预后的关键。患者的临床表现多样, 可自新生儿至成年发病,晚发型患者可表现为精 神障碍、亚急性联合变性样症状、癫癎等神经精 神异常,血清总同型半胱氨酸、维生素B12、叶酸 测定有助于诊断与鉴别诊断。通过脑脊液5-甲基 四氢叶酸测定,可鉴别原发及继发性脑叶酸缺乏 症,指导患者的长期治疗。MTHFR基因分析不仅 有助于确诊,也是进行患者家系遗传指导的关键。 本研究通过上述生化与基因分析确诊了我国首例 MTHFR缺陷导致的学童精神分裂症,经亚叶酸钙、 维生素B12、维生素B6、甜菜碱补充治疗后,患者 病情逐步改善,回归正常生活。儿童精神分裂症 的病因与治疗是儿童精神神经科学研究的疑难领域,一些遗传代谢病患者通过有效干预可能获得 康复。
| [1] | Matthews RG, Sheppard C, Goulding C. Methylenetetrahydrofolate reductase and methionine synthase: biochemistry and molecular biology[J]. Eur J Pediatr, 1998, 157(Suppl 2): S54-S59. |
| [2] | Bakker RC, Brandjes DP. Hyperhomocysteinaemia and associated disease[J]. Pharm World Sci, 1997, 19(3): 126-132. |
| [3] | 董滟,雷敏,董慧君. 高同型半胱氨酸血症的研究进展[J].中华现代内科学杂志, 2007, 4(9): 808-810. |
| [4] | 刘建伟,吴多斌,叶玲,等. PCR-RFLP 法检测MTHFR基因C677T 突变[J].中国老年学杂志, 2003, 23(4): 210-212. |
| [5] | Hyland K, Shoffner J, Heales SJ. Cerebral folate deficiency[J]. J Inherit Metab Dis, 2010, 33(5): 563-570. |
| [6] | 王成硕, 张罗, 韩德民. 标准化尘螨变应原疫苗治疗变应性鼻炎的疗效和安全性评估[J]. 首都医科大学学报, 2005, 26(3): 246-248. |
| [7] | 王峤,杨艳玲. 脑叶酸缺乏症诊断和治疗的研究进展[J]. 中华儿科杂志,2012, 50 (11): 874-877. |
| [8] | Haworth JC, Dilling LA, Surtees RA, et al. Symptomatic and asymptomatic methylenetetrahydrofolate reductase deficiency in two adult brothers[J]. Am J Med Genet, 1993, 45(5): 572-576. |
| [9] | Prasad AN, Rupar CA, Prasad C. Methylenetetrahydrofolate reductase (MTHFR) deficiency and infantile epilepsy[J]. Brain Dev, 2011, 33(9): 758-769. |
| [10] | Arn PH, Williams CA, Zori RT, et al. Methylenetetrahydrofolate reductase deficiency in a patient with phenotypic findings of Angelman syndrome[J]. Am J Med Genet, 1998, 77(3): 198-200. |
| [11] | Engelbrecht V, Rassek M, Huismann J, et al. MR and proton MR spectroscopy of the brain in hyperhomocysteinemia caused by methylenetetrahydrofolate reductasedeficiency[J]. AJNR Am J Neuroradiol, 1997, 18(3): 536-539. |
| [12] | Sayami S, 张尧, 杨艳玲. 同型半胱氨酸血症的临床研究进展[J]. 中国医刊, 2008, 43(12): 29-31. |
| [13] | 刘玉鹏, 马艳艳, 吴桐菲, 等. 早发型甲基丙二酸尿症160例新生儿期异常表现[J]. 中华儿科杂志,2012,50(6): 410-414. |
| [14] | Rosenblatt DS, Lue-Shing H, Arzoumanian A, et al. Methylenetetrahydrofolate reductase deficiency: thermolability of residual MR activity,methionione synthase activity, and methylcobalamin levels in cultured fibroblasts[J]. Biochem Med Met Biol, 1992, 47(3): 221-225. |
| [15] | Goyette P, Christensen B, Rosenblatt DS, et al. Severe and mild mutations in cis for the methyleneterahydrofolate gene, and descripyion of 5 novel mutations in MTHFR[J]. Am J Hum Genet, 1996, 59(6): 1268-1275. |
| [16] | Klerk M, Verhoef P, Clarke R, et al. MTHFR 677C-T polymorphism and risk of coronary heart disease: a meta-analysis[J]. JAMA, 2002, 288(16): 2023-2031. |
| [17] | Motulsky AG. Nutritional ecogenetics: homocysteine-related arteriosclerotic vascular disease, neural tube defects, and folic acid[J]. Am J Hum Genet, 1996, 58(3): 17-20. |
| [18] | Qian X, Lu Z, Tan M, et al. A meta-analysis of association between C677T polymorphism in the methylenetetrahydrofolate reductase gene and hypertension[J]. Eur J Hum, Genet, 2007, 15(12): 1239-1245. |
| [19] | Ronge E, Kjellman B. Long term treatment with betaine in methylenetetrahydrofolate reductase deficiency[J]. Arch Dis Child, 1996, 74(3): 239-241. |
| [20] | Schiff M, Benoist JF, Tilea B, et al. Isolated remethylation disorders: do our treatments benefit patients?[J]. J Inherit Metab Dis, 2011, 34(1):137-145. |
| [21] | 顾学范, 叶军, 韩连书. 上海地区遗传代谢病的新生儿筛查[J]. 临床儿科杂志, 2009, 27(2): 101-105. |
| [22] | Christensen E, Brandt NJ. Prenatal diagnosis of 5,10-methylenete-trahydrofolate reductase deficiency[J]. New Eng J Med, 1985, 313(1): 50-51. |
| [23] | Morel CF, Scott P, Christensen E, et al. Prenatal diagnosis for severe methylenetetrahydrofolate reductase deficiency by linkage analysis and enzymatic assay[J]. Mol Genet Metab, 2005, 85(2):115-120. |
| [24] | 曹静. 儿童期精神分裂症的研究进展[J]. 医学理论与实践, 2013, 26 (9): 1146-1148. |
| [25] | Fredriksen A, Meyer K, Ueland PM, et al. Large-scale population-based metabolic phenotyping of thirteen genetic polymorphisms related to one-carbon metabolism[J]. Hum Mutat, 2007, 28(9): 856-865. |
| [26] | Freeman JM, Finkelstein JD, Mudd SH. Folate-responsive homocystinuria and "schizophrenia". A defect in methylation due to deficient 5,10-methylenetetrahydrofolate reductase activity[J]. N Engl J Med, 1975, 292(10): 491-496. |
| [27] | Lewis SJ, Zammit S, Gunnell D, et al. A meta-analysis of the MTHFR C677T polymorphism and schizophrenia risk[J]. Am J Med Genet B Neuropsychiatr Genet, 2005, 135B(1): 2-4. |
| [28] | Allen NC, Bagade S, McQueen MB, et al. Systematic meta-analyses and field synopsis of genetic association studies in schizophrenia: the SzGene database[J]. Nat Genet, 2008, 40(7): 827-834. |
| [29] | 邓红, 刘协和, 蔡贵庆, 等. 甲叉四氢叶酸还原酶C677T与精神分裂症的连锁不平衡研究[J]. 中华医学遗传学杂, 2002, 19(3):198-200. |
| [30] | Wilcken B, Bamforth F, Li Z, et al. Geographical and ethnic variation of the 677C-T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide[J]. J Med Genet, 2003, 40(8): 619-625. |
| [31] | Frosst P, Blom HJ, Milos R, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase[J]. Nat Genet, 1995, 10(1): 111-113. |
 2014, Vol. 16
2014, Vol. 16