缺氧缺血性脑病(hypoxic ischemic encephalo- pathy,HIE)是新生儿期十分常见的脑损伤,但是至 今为止,对该疾病的治疗仍停留在对症处理及减轻 脑损伤后遗症的一些方法上 [1] ,还没有发现促进损 伤神经再生的有效方法。因此,目前急需进行对于 缺氧缺血性脑损伤(hypoxic ischemic brain damage HIBD)后促进神经再生的新方法的研究 [2] 。中枢 神经系统再生受抑制的一个主要原因在于损伤轴突 所处的环境中有大量的髓鞘抑制因子,最近的研究 表明以MAG、Nogo-A和Omgp为主要的抑制因子[3]。 这3种髓鞘抑制因子在HIBD神经再生中是通过 与受体NgR结合,形成受体复合物后发挥抑制作 用 [4, 5, 6, 7] 。已有一些文章表明抑制NgR可以促进损伤 神经再生 [8] ,但是也有一些文章表明髓鞘抑制因子 在NgR敲除鼠和野生鼠中的抑制神经再生作用无 差异 [9] 。因此,很有可能存在第二个受体介导髓鞘 抑制因子的抑制作用。配对免疫球蛋白B(paired Immunoglobulin-like receptor B,PirB)首先被发现表 达于免疫系统细胞上,直到最近才发现也表达在 神经细胞上 [10] 。与NgR一样,PirB可以与MAG、 Nogo-A和Omgp结合并发挥神经再生抑制作用。同 时阻止NgR和PirB可能可以完全阻止髓鞘抑制因 子对损伤神经再生的抑制作用,对敲除NgR的神 经元用抗PirB抗体处理后能部分阻断通过Nogo-66 而发生的抑制损伤神经再生作用 [11] 。这些实验结 果均表明联合阻止NgR和PirB可能会促进损伤神 经的再生。
本研究假设抑制PirB可以通过阻止抑制因 子传导通路从而刺激损伤神经再生,另外,由于 PirB和NgR都是髓鞘抑制因子的受体,而NgR是 通过Rho-ROCK信号通路而发挥抑制作用的,因 此本研究假设PirB也是通过这一信号通路发挥作 用。本实验将探讨PirB在HIBD新生大鼠脑组织 中的含量及表达变化,并测定Rho激酶(ROCK) 的活性变化,以便探讨PirB抑制HIBD神经再生 可能的信号通路,旨在为寻求促进损伤神经再生 的新方法而奠定基础。
一抗PirB(C19,美国Santa Cruze公司);二抗生物素标记兔抗羊IgG、SP免疫组化Kit试剂 盒、DAB显色试剂盒(北京中山公司);RIPA裂 解液(上海申能博彩生物科技有限公司);丽春 红S染色试剂和考马斯亮蓝染色试剂(美国Sigma 公司);PVDF膜(德国罗氏公司);Western blot Kit(美国KPL公司);PirB、β-actin引物(上海 捷倍思基因技术有限公司);总RNA提取试剂盒 (MBI公司);First Strand CDNA synthesis Kit、 dNTPmix、BCA试剂盒(深圳晶美生物有限工程公 司);DEPC(成都云鸿科技公司)。
66只清洁级健康7 d龄Sprague-Dawley新生 大鼠(购于华西实验动物中心),随机选取6只 为抗PirB抗体组,余60只大鼠被随机分为假手术 组及HIBD组,每组30只。新生大鼠仰卧位固定, 乙醚吸入麻醉,切开皮肤及皮下组织,分离右侧 颈总动脉,并用7-0灭菌丝线结扎,缝合皮下 组织及皮肤,并再次消毒皮肤。整个手术过程在 15 min内完成。术后将大鼠置于常氧空气中 30 min后,将其放进8%O2、92%N2混合气体的 低氧舱处理3 h,流量为2 L/min,低氧处理结束后 的新生鼠放回含常氧的母鼠笼中饲养。假手术组 仅将丝线穿过右侧颈总动脉而不做结扎及缺氧处 理,HIBD组在完成结扎手术及缺氧处理后,两组 分别在0 h、6 h、12 h、24 h和72 h各处死6只大 鼠。抗PirB抗体组在完成结扎手术及缺氧处理后 即刻从脑室内注入PirB抗体,于72 h后处死。
用3%戊巴比妥钠15~ 20 mg/kg对每个时间点动物作腹腔内麻醉,打开腹 腔麻醉后新生鼠的胸腔,用20 mL注射器于左心室 灌注生理盐水,同时在右心房处剪一切口,至流出 液体变清为止。再灌注4%多聚甲醛、0.1 mol/L PBS 100 mL,至肝脏明显变白及肺脏明显水肿后断头取 全脑,并立即将之保存于4%多聚甲醛、0.1 mol/L PBS溶液中固定72 h以上。将固定的鼠脑从视交叉 后2~6 mm处做脑组织冠状切面,取视交叉之后的 脑组织块经梯度酒精脱水、二甲苯透明后行石蜡包 埋,切片后裱于载玻片上备用。切片厚度为5μm, 每5张切片取1张,每个动物脑组织共取3张切片, 每张切片随机选5个视野观察。
标本脱蜡置水,3%H2O2浸泡消除内源性过氧化物酶,蒸馏水洗 5 min,两次,柠檬酸修复液抗原修复,3%正常羊 血清封闭,滴加PirB一抗,37℃孵育0.5 h,然后 4℃过夜,滴加二抗,37℃孵育1 h,滴加SP,再 37℃孵育1 h,DAB显色试剂盒显色,苏木素复染, 脱水、透明、封片。
提取脑组织蛋白质,假手术组及HIBD组各 时间点各6例标本,冰浴中取脑组织100 mg加入 1 mL RIPA和10μL PMSF,用1 mL TIP管直接吸打 冰里放置30 min,离心,采用紫外可见分光光度 仪测定蛋白浓度,各样本稀释为5μg/μL,-70℃ 冰箱保存;配置好分离胶后,取样本上样,恒压 120 V电泳1 h,凝胶转移至固相支持物,膜封闭, 杂交显色(一抗为C19),进行图像采集及统计学 分析。
分别取假手术组和HIBD组新生大鼠术后各 时间点的右侧大脑皮层组织约40 mg置于DEPC 处理过的1.5 mL EP管中,加入1 mL TRIzol剧烈 振荡,离心后将上清液移至DEPC处理的EP管 中,行脑组织总RNA提取,用紫外分光光度仪 测得总RNA提取物的A260/280值在1.6~2.0之 间,再将提取的总RNA行1%琼脂糖凝胶电泳, 将模板RNA、Oligo(dT)与DEPC处理水轻微混 匀,孵育后冰上冷却离心。根据NCBI Genebank 中大鼠PirB、β-actin基因序列行引物设计,PirB 上游引物:5'-TCGGGGAAAATTCAGGAA-3',下 游引物:5'-GAGA-AATCTCTAGCTTTATTT-3', 片段长度:124 bp;β-actin上游引物: 5'-CGTAAAGACCTCTATGCCAA-3',下游引物: 5'-AGCCATGCCAAATGTGTCAT-3',片段长度 387 bp。cDNA的合成参照逆转录酶使用说明书 进行。反应体系(50μL):模板cDNA 1μL, 10×Buffer 5μL,dNTP mix(2.5 mM)1μL,上、 下游引物(10μM)各1μL,Taq多聚酶0.5μL, ddH2O补足体积至50μL。反应条件:94℃预变性 3 min;94℃变性30 s,55℃(PirB)/53℃(β-actin) 退火30 s,72℃延伸32 s(PirB)/40 s(β-actin), 32(PirB)/28(β-actin)个循环;最后72℃延伸 8 min。PCR扩增产物0.5μL和上样缓冲液0.3μL 点样于1%琼脂糖凝胶上,50 V电泳1 h后照相。用图像分析仪测照片上扩增产物的平均灰度,计 算出目的基因条带灰度值与内参β-actin条带灰度 值的比值作为目的基因的相对表达量。
标本匀浆后加0.5 mL预冷细胞裂解液,4℃、 12000 rpm离心10 min后收集上清,BCA法平衡 每组蛋白总浓度,准备A蛋白-Sepharosez珠及其 PirB一抗复合物,按每50μL A蛋白-Sepharosez 珠中加入10μL PirB一抗(C19),4℃孵育1 h, 8000 rpm离心5 min,PBS洗涤3次,加50μL PBS,取100μg总蛋白,加入A蛋白-Sepharosez 珠PirB一抗复合物后离心,蛋白上清储于-20℃ 冰箱备用;制备电泳凝胶、进行SDS-PAGE、转膜 和免疫反应,以GADPH作为内参对照,最后进行 ECL曝光及条带半定量分析。
应用SPSS 13.0统计软件对数据进行统计学分 析,计量资料以均数±标准差(x±s)表示,两 组均数的比较采用t检验;多组间均数比较采用单 因素方差分析,组间两两比较采用LSD-t检验, P<0.05为差异有统计学意义。
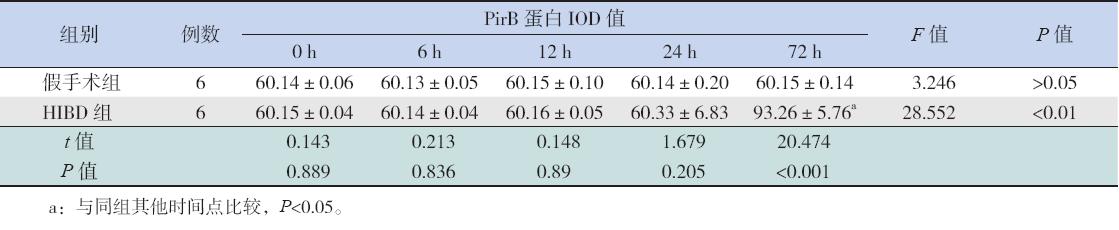
本实验首先采用免疫组化法测定了HIBD组 新生大鼠在各时间点脑组织中PirB的表达,结果 表明HIBD组72 h时的PirB阳性表达(黄褐色) 明显增加,与HIBD后0 h及假手术组相比差异均 有统计学意义(均P<0.05)。而假手术组各时间 点PirB差异均无统计学意义(均P>0.05)。见图 1, 表1。
| 表 1假手术组与HIBD组PirB表达水平比较 (x±s) |
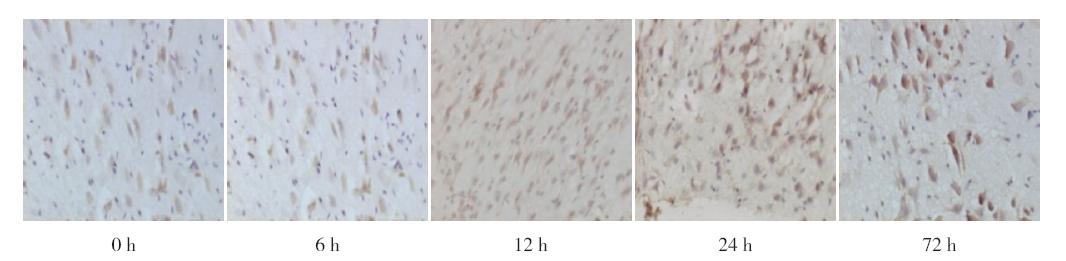 |
图 1 HIBD新生大鼠脑组织各时间点免疫组化图像 (DAB显色,×200) 黄褐色为PirB阳性表达。 |
Western blot检测结果与免疫组化结果一致, PirB蛋白表达在HIBD 72 h后的新生鼠脑组织中明 显增加,与其他时间点比较差异均有统计学意义(均 P<0.05),见图 2。
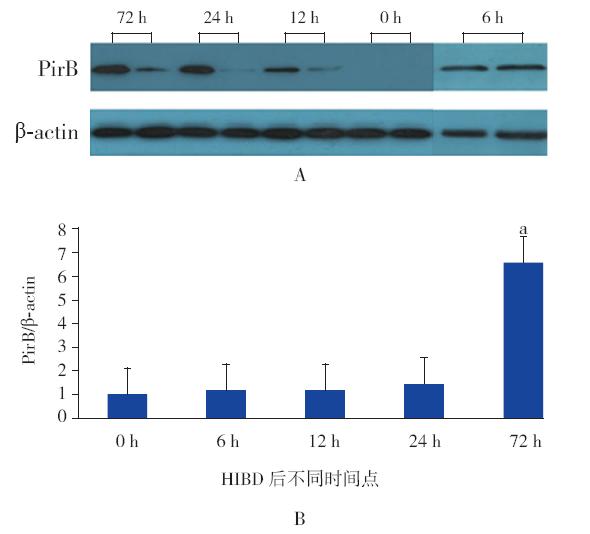 |
图 2 Western blot检测HIBD组新生鼠各时间点脑组 织PirB表达水平(n=6) A:Western blot条带图;B:Western blot的半定量分析结果。a:与0 h、6 h、12 h和24 h相比, P<0.05。 |
与免疫组化和Western blot结果一致,PirB mRNA在HIBD 72 h后的新生鼠脑组织中明显增 加。与其他时间点比较差异均有统计学意义(均 P<0.05),见图 3。
 |
图 3 RT-PCR检测HIBD组新生鼠各时间点脑组织 PirB mRNA表达水平(n=6) A:RT-PCR电泳图;B:RT-PCR 的半定量分析结果。a:与0 h、6 h、12 h和24 h相比,P<0.05。 |
鉴于HIBD 72 h后脑组织中PirB蛋白及 mRNA明显增加,因此本实验主要观察HIBD 72 h 组中ROCK蛋白活性的变化,以及加入抗PirB抗 体对HIBD大鼠ROCK蛋白活性的影响。结果表明造模成功后72 h,HIBD组ROCK蛋白活性较假 手术组增加(P<0.05),抗PirB抗体组ROCK蛋 白活性较HIBD组降低(P<0.05)。表明ROCK蛋 白活性在HIBD新生鼠脑组织中增加,而且这种酶 活性的增加可以被抗PirB抗体所阻断。见图 4。
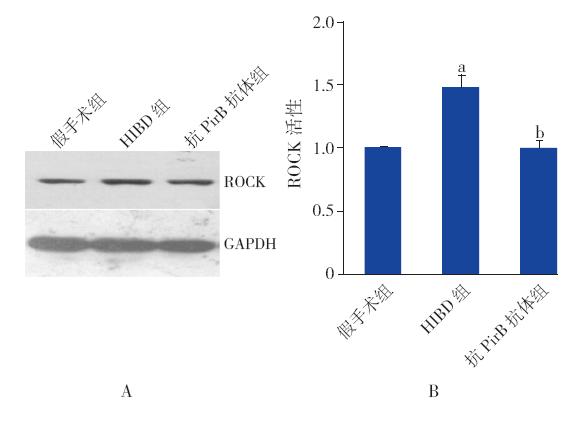 |
图 4 HIBD 72 h后ROCK蛋白活性在各组新生大鼠 脑组织中的变化(n=6) A:免疫沉淀条带图;B:免疫沉淀的 半定量分析结果。a:与假手术组相比,P<0.05;b:与HIBD组相 比,P<0.05。 |
HIBD是围生期窒息幸存儿中最为常见的致残 原因 [12] 。虽然到目前为止研究了各种各样的神经 保护措施,但是由于神经损伤的不可逆性,对于 HIE的治疗手段仍然十分有限。研究表明HIE预 后与神经损伤程度密切相关,本课题组以前的研究 观察到新生鼠脑组织HIBD后神经坏死,那么HI 损伤后成功的神经再生对HIBD的治疗十分重要。
ROCK在髓鞘抑制因子与其受体NgR结合后 发挥抑制神经再生作用的信号传递通路中发挥着 重要的作用。因此,本实验探索ROCK在PirB抑 制HI损伤神经再生中是否也发挥着同样重要的作 用。鉴于有研究表明,在中枢神经系统髓鞘中有 几种髓鞘抑制蛋白与抑制损伤神经再生相关,它 们是MAG、Nogo-A和Omgp,抑制蛋白要通过它 们的受体NgR发挥作用,而NgR发挥抑制作用要 通过RhoA-ROCK信号通路,因此本研究想通过实 验表明PirB是否也与抑制损伤神经再生有一定作 用,而这一作用是否也是通过ROCK信号通路介导。 形态学研究发现,HIBD新生大鼠脑组织中存在 着明显的神经元坏死表现 [13] 。另外,本课题组前 期的实验研究表明髓鞘抑制因子Nogo-A及其受体 NgR在HIBD脑组织中含量升高 [14] ,2007年有研 究提出Nogo-A抗体可导致HIBD新生大鼠脑组织 Nogo-A蛋白表达明显减少,对神经细胞再生的抑 制作用减弱 [15] 。2012年的研究表明PirB抑制新生大鼠HI损伤神经元细胞再生 [16, 17] ,提示Nogo-A、 NgR和PirB在阻止损伤神经再生方面起着一定作 用。目前表明Nogo-A、NgR的抑制机制是Nogo-A 通过与NgR-P75NTR受体复合物相结合,将抑制 信号传递至ROCK,再激活一系列瀑布反应,最终 导致细胞骨架结构重建而抑制损伤神经元再生。 由于PirB是新近发现的Nogo-A的另一种功能性受 体,因此本研究推测抑制PirB可能也可以通过抑 制ROCK的表达继而起到促进损伤神经元再生的 目的。
为了表明PirB在HIBD新生鼠的脑组织中含 量是否增加,本研究在免疫组化中用针对PirB胞 内段的特异性抗体,对不同HI时间点脑组织中 PirB的含量进行比较,发现HIBD后72 h新生鼠 脑组织中PirB的分布及含量增加,主要分布于大 脑皮层、海马及小脑神经元中。同时本研究采用 Western blot和RT-PCR检测表明新生鼠HIBD后 72 h PirB蛋白及mRNA的含量均增加。
PirB作为髓鞘抑制因子的功能性受体,抑制 损伤神经元轴突再生的机制是否也同NogoA-NgR 类似,是通过Rho-ROCK信号通路改变细胞骨架 结构而发挥抑制作用的呢?本课题组前期体内动 物实验中观察到HIBD后Rho的含量及活性均增 强,但加入抗PirB抗体后其活性下降 [15, 16] 。说明 HI致髓鞘抑制因子增加,继而其受体含量也增加, 由于Rho-ROCK信号通路已被证实在Nogo受体复 合物抑制神经再生方面起着重要作用,因此本实 验力图表明PirB这一髓鞘抑制因子的功能性受体 也可能是通过这一条信号通路发挥着抑制神经再 生的作用。因此,本研究通过脑室内注入抗PirB 胞外段的特异性抗体,培养阻断PirB表达的HIBD 后72 h的脑组织,结果表明HIBD后72 h ROCK 活性增加,而抑制PirB后ROCK活性下降,表明 PirB在HIBD后增加会抑制损伤神经元再生,其机 理可能与ROCK的激活有一定关系,而抑制PirB 可能是治疗HIBD的一个潜在靶点。
在接下来的实验中,本课题组将进一步进行去 除PirB功能的转基因动物实验,从动物体内研究 无PirB表达时HIBD后不同时间点神经元再生的情 况及Rho-ROCK信号通路的变化,以期进一步证实 PirB在HIBD后起着抑制神经元轴突再生的作用及 其可能机制。
| [1] | Roland EH, Hill A. Clinical aspects of perinatal hypoxic-ischemic brain injury[J]. Semin Pediatr Neurol, 1995, 2(1): 57-71. |
| [2] | Lai MC, Yang SN. Perinatal hypoxic-ischemic encephalopathy[J]. J Biomed Biotechnol, 2011, 2011: 609813. |
| [3] | Schwab ME. Nogo and axon regeneration[J]. Curr Opin Neurobiol, 2004, 14(1): 118-124. |
| [4] | Fournier AE, Grandpre T, Strittmatter SM. Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration[J]. Nature, 2001, 409(6818): 341-346. |
| [5] | Wang KC, Koprivica V, Kim JA, et al. Oligodendrocyte-myelin glycoprotein is a Nogo receptor ligand that inhibits neurite outgrowth[J]. Nature, 2002, 417(6892): 941-944. |
| [6] | Domeniconi M, Cao Z, Spencer T, et al. Myelin-associated glycoprotein interacts with the Nogo66 receptor to inhibit neurite outgrowth[J]. Neuron, 2002, 35(2): 283-290. |
| [7] | Shao Z, Browning JL, Lee X, et al. TAJ/TROY, an orphan TNF receptor family member, binds Nogo-66 receptor 1 and regulates axonal regeneration[J]. Neuron, 2005, 45(3): 353-359. |
| [8] | GrandPre T, Li S, Strittmatter SM. Nogo-66 receptor antagonist peptide promotes axonal regeneration[J]. Nature, 2002, 417(6888): 547-551. |
| [9] | Zheng B, Atwal J, Ho C, et al. Genetic deletion of the Nogo receptor does not reduce neurite inhibition in vitro or promote corticospinal tract regeneration in vivo[J]. Proc Natl Acad Sci USA, 2005, 102(4): 1205-1210. |
| [10] | Syken J, Grandpre T, Kanold PO, et al. PirB restricts ocular-dominance plasticity in visual cortex[J]. Science, 2006, 313(5794): 1795-1800. |
| [11] | Atwal JK, Pinkston-Gosse J, Syken J, et al. PirB is a functional receptor for myelin inhibitors of axonal regeneration[J]. Science, 2008, 322(5903): 867-870. |
| [12] | Vasiljevic B, Maglajlic-Djukic S, Gojnic M, et al. New insights into the pathogenesis of perinatal hypoxic ischemic brain injury[J]. Pediatr Int, 2011, 53(4): 454-462. |
| [13] | Cohen-Cory S, Fraser SE. Effects of brain-derived neurotrophic factor on optic axon branching and remodelling in vivo[J]. Nature, 1995, 378(6553): 192-196. |
| [14] | Cohen-Cory S, Fraser SE. Effects of brain-derived neurotrophic factor on optic axon branching and remodelling in vivo[J]. Nature, 1995, 378(6553): 192-196. |
| [15] | 周晓光, 刘仁红, 熊爱华. 脑室注射Nogo-A抗体对HIBD新生大鼠脑组织神经细胞再生的影响[J]. 中国当代儿科杂志, 2007, 9(4): 301-304. |
| [16] | Wang H, Xiong Y, Mu D. PirB restricts neuronal regeneration in developing rat brain following hypoxia-ischemia[J]. Mol Med Report, 2012, 6(2): 339-344. |
| [17] | 王华, 熊英, 母得志. 配对免疫球蛋白抑制新生大鼠缺氧缺血损伤神经元细胞再生的研究[J]. 中国新生儿科杂志, 2012, 27(4): 269-273. |
 2014, Vol. 16
2014, Vol. 16