缺氧缺血(HI)是新生儿时期引起神经系统 损伤的重要原因,对缺氧缺血性脑损伤(HIBD) 发病机制及防治的研究具有重要意义。星形胶质 细胞是中枢神经系统(CNS)中数量最多的神经细 胞之一。近年来,越来越多的研究表明,星形胶 质细胞除了参与早期的血管发育,还参与了CNS 损伤后修复的调控,有十分重要的调控作用 [1, 2] 。 然而,星形胶质细胞是一种附着生长细胞,必须 在整合素的介导下,与周围基质及细胞相互粘着 才能存活和生长。整合素α v β 8 是星形胶质细胞表 达的主要整合素之一,因此可能对其功能起重要 调控作用。转化生长因子-β1(TGF-β1)具有调节 细胞生长、分化、调控炎症反应等作用 [3] ,以无活 性的潜伏态形式分泌,在CNS中尤其是HI时,对 其活化途径仍不完全清楚。β 8 是位于细胞表面的 主要TGF-β受体,研究表明,上皮细胞表达的β 8 可激活TGF-β1[4]。然而,在CNS中,β 8 是否也是 激活TGF-β1的关键因素,目前尚不十分清楚。
在体外培养环境中,氧糖剥夺(OGD)模拟 HI后星形胶质细胞β 8 表达是否诱导性增高?表达 增高的β 8 能否诱导TGF-β1活化水平增高,从而影 响一系列下游调节蛋白高表达?本课题组认为这一 连锁反应是新生儿HIBD细胞修复的重要机制之一。 这一假设亟待进一步证实,也是本研究的核心内容。
清洁级新生3 d(P3)Sprague-Dawley(SD)大 鼠,雌雄不限,平均体重12 g,由四川大学华西医 学中心实验动物中心提供。兔抗大鼠β 8 及β-actin 多克隆抗体、山羊抗兔IgG多克隆抗体购自Santa Cruz公司,ABC免疫化学试剂盒购自VECTOR Laboratories,DAB显色试剂盒购自KPL公司,荧光 素酶分析试剂盒购自Promega公司,抗TGF-β1抗 体1d11购自R&D公司。Western blot用兔抗大鼠β 8 多克隆抗体参照文献 [5] 以KLH偶联合成多肽(N'- EIKMDISKLNA-C')免疫动物获得。β 8 siRNA及对 照siRNA已由既往实验获得 [6] ,直接用于本实验。
参照文献进行原代培养 [7] 。将新生大鼠脑膜 及血管组织分离后,取脑皮质并将其剪碎,加入含 0.25%胰蛋白酶的PBS液中,37℃消化5~10 min 后,加入10%胎牛血清(FBS)终止消化。通 过75μm不锈钢筛网过滤,收集细胞悬液,加入 DMEM培养基柔和吹打数次后以1200 rpm/min,离 心5 min,去上清液后加入培养液(高糖DMEM培养基+10%FBS),于二氧化碳培氧箱中(37℃, 5%CO2)饱和湿度培养。接种3 d后更换培养液, 以后每两天半量换液1次。培养约15 d即为成熟 星形胶质细胞。
OGD体外模拟HI。将成熟星形胶质细胞培 养基更换为无糖DMEM培养基,将细胞置于通混 合气(5%CO2+95%N2)的缺氧装置中,体外模拟 HI。6 h后更换为原培养液,并以正常条件继续培 养,模拟复氧。以未接受OGD处理的细胞作为对照, 分别采集对照组及复氧后12 h、1 d、2 d细胞标本 进行后续实验。
待荧光素酶报道细胞(TMLC)在96孔板中 贴壁后,将培养中的星形胶质细胞以相同密度接 种于生长有TMLC的96孔板中。以高糖培养液, 于37℃、5%CO2孵箱中培养。共培养2 d后,光 镜下观察星形胶质细胞覆盖于TMLC之上生长, 满足后续实验要求。
收集 正常生长的星形胶质细胞爬片,0.01M PBS清洗后, 4%多聚甲醛固定。3%H2O2封闭内源性过氧化物 酶10 min,10%山羊血清37℃孵育20 min,滴加 兔抗大鼠β 8 抗体(1:500)4℃孵育过夜。滴加山 羊抗兔IgG 37℃孵育30 min,加入ABC 37℃孵育 30 min,DAB显色试剂盒显色,显微镜下观察。
取对照组及复氧后12 h、1 d及2 d的细胞,0.25% 胰酶消化及离心后收集细胞沉淀,蛋白裂解液抽提 细胞蛋白。取上清,BCA法测蛋白浓度,各孔加 入100μg蛋白样品电泳,转膜,5%小牛血清封闭 液封闭1 h,加入兔抗大鼠β 8 多克隆抗体(1:100)。 TBST洗膜3次,二抗室温孵育1 h,TBST洗膜3次, ECL显色,用Gel-pro凝胶成像分析软件测定条带 的积分光密度值(IOD),并计算目的蛋白和内参 β-actin的IOD比值,即为相对光密度。
在星形胶质细胞和 TMLC共培养体系中,TMLC已被转染且能稳定表 达与TGF-β1起反应的启动子(PAI-1),当PAI-1 被TGF-β1激活后,可启动其下游的虫媒荧光素酶 表达 [8] ,TGF-β1活性由荧光素酶强度反映。将共 培养体系中的星形胶质细胞与TMLC共同行OGD处理6 h后复氧,设未接受OGD处理组(对照组) 和复氧后12 h、1 d、2 d组共4组,每组根据不同 的处理方式再分为3个亚组:(1)β 8 +/+ /TMLC共 培养组(β 8 +/+ 组);(2)β 8 -/- /TMLC共培养组(β 8 -/- 组); (3)1d1(110μg/mL)处理的β 8 +/+ /TMLC组(anti-TGF-β 组)。其中,β 8 -/- 表示经RNA干扰的星形胶质细胞, β 8 +/+ 表示正常培养的星形胶质细胞。参照试剂盒说 明书检测,酶标仪读取荧光素酶数值。
采用SPSS 10.0统计软件包对数据进行统计学 分析。计量资料以均数±标准差表示(x±s), 多组间比较采用单因素方差分析,组间两两比较 采用LSD-t检验,P<0.05为差异有统计学意义。
细胞免疫化学染色发现,常氧状态下,星形 胶质细胞即有大量β 8 蛋白表达,β 8 主要分布于星 形胶质细胞的胞浆和树突。见图 1。
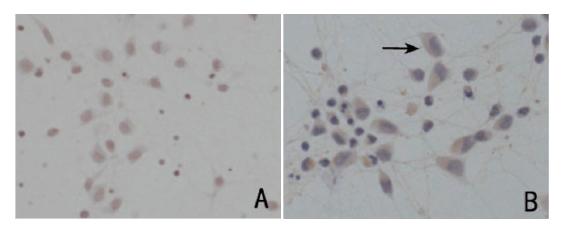 |
图 1 免疫细胞化学检测β8在星形胶质细胞中的分布及 表达 (DAB显色,×400) 图A为常氧状态下星形胶质细胞,以 PBS代替一抗作为阴性对照;图B为常氧状态下星形胶质细胞β8表达, 箭头所示胞浆及树突显示棕黄色颗粒为β8阳性表达。 |
将未接受OGD处理的对照组β 8 蛋白表达判 读结果定为1,复氧后各时间点结果以相对于对照 组的倍数来表示。Western blot结果显示,星形胶 质细胞中β 8 蛋白表达在复氧后12 h即有增加,为 对照组的1.3倍(P<0.01);1 d时表达达高峰, 为对照组的2.3倍(P<0.01);后表达缓慢下降, 至复氧后2 d时仍维持在较高水平,为对照组的1.9 倍(P<0.01)。见图 2。
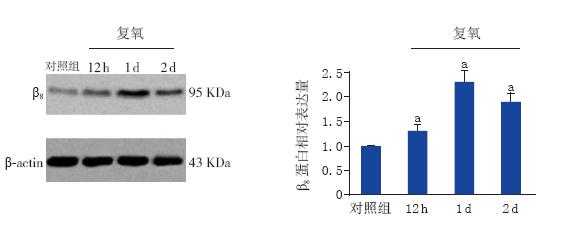 |
图 2 OGD对星形胶质细胞β8蛋白表达的影响(n=5) 左图为条带图;右图为统计结果图,a:与对照组比较,P<0.01。 |
将未接受OGD处理的对照组β β8 蛋白表达判 读结果定为1,复氧后各时间点结果以相对于对照 组的倍数来表示。荧光素酶检测结果显示,复氧 后12 h、1 d和2 d的荧光素酶强度分别为对照组 的1.5倍、1.9倍和1.3倍(均P<0.01),其活性 增高趋势与复氧后各时间点星形胶质细胞β 8 蛋白 表达趋势相似。阻断TGF-β1后,对照组及各时间 点荧光素酶的强度分别下降87%、84%、76%和 75%(均P<0.01)。阻断β 8 后,对照组及各时间 点荧光素酶的强度分别下降63%、57%、65%和 60%(均P<0.01)。以上结果提示星形胶质细胞 表达的β 8 与TGF-β1的活化有关。见图 3。
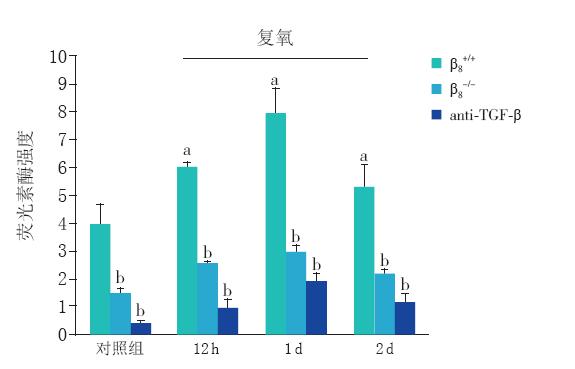 |
图 3 星形胶质细胞/TMLC共培养体系中荧光素酶强度 (n=5) a:与对照组β 8 +/+ 比较,P<0.01;b:与同组β 8 +/+ 比较, P<0.01。 |
整合素α v β 8 是主要的细胞表面受体之一,并 且在CNS中仅与α v 亚基结合形成异二聚体 [9] ,因 此本实验中检测β 8 亚基表达即代表整合素α v β 8 水 平。体内实验发现,β 8 在海马区的免疫活性最强, 主要分布于海马CA3区的透明层、起始层和辐射 层,CA1区的起始层和辐射层,齿状回的分子层 和颗粒细胞层 [5] 。β 8 的这种特异性组织分布,提 示其可能在CNS中有着特殊的调控作用。现有对 β 8 的研究大都是针对其在胚胎期对血管发育的作 用 [10] ,然而对其在CNS损伤后,尤其是HIBD后是否参与损伤后修复过程,目前研究甚少。
β 8 在体外原代培养的鼠胶质细胞和人胶质瘤 细胞中亦被证实是高表达的整合素亚基之一 [10] 。 但是,在CNS HI后,β 8 的表达是否会被诱导性表 达增高,从而参与损伤后的一系列信号通路?本 研究发现,β 8 主要分布于星形胶质细胞的胞浆和 树突。OGD后,β 8 表达在星形胶质细胞中明显增高, 复氧后约1 d其表达达到高峰,其后缓慢降低,至 复氧后2 d仍维持在较高水平。
本课题组既往研究已利用慢病毒载体成功构 建了β 8 RNA干扰系统 [6] 。利用该系统特异性干扰 星形胶质细胞经β 8 表达,干扰后2 d达到最大抑 制率,其β 8 蛋白的抑制率可高达84%,该抑制作 用至少可持续3 d,因此本研究选择实验周期为 3 d以内,从而保证RNA干扰对β 8 表达的抑制作用。
正常情况下,TGF-β1在体内与潜伏相关蛋白 LAP-β1结合,形成潜伏态TGF-β1,必须通过激活 才能发挥其生物学效应。研究表明,TGF-β1活化 通过蛋白水解途径和非蛋白水解途径两条通路进 行 [11] 。星形胶质细胞表达的α v β 8 是潜伏态TGF-β1 的主要细胞表面受体,在体外培养的星形胶质细 胞和新鲜分离的胎脑细胞中,β 8 依赖的TGF-β1活 化亦被证实是CNS中主要的TGF-β1活化通路[12]。 本实验结果表明,在OGD和复氧过程中,将星形 胶质细胞与TMLC细胞株共同培养,可明显增高 TMLC的荧光素酶强度,而荧光素酶强度即代表 TGF-β1激活水平。直接抑制星形胶质细胞中β 8 作 用,TGF-β1活性较未阻断前明显下降,提示CNS 中TGF-β1的激活与整合素β 8直接相关。此外, OGD后,TGF-β1活性的增高趋势与星形胶质细胞 β 8 表达增高的趋势一致,而抑制β 8 后在一定程度 上可抑制TGF-β1活性的增强。以上结果提示,β 8 是CNS缺氧缺血后,诱导TGF-β1持续活化的关键 因素之一。
本研究中,抑制β 8 后,TGF-β1活化的抑制率 不超过65%,而直接阻断TGF-β1,其活化抑制率 则可高达87%。造成这种差异的原因可能是由于 除β 8 外,还有其他因素参与了TGF-β1的活化。 研究发现,体外培养的人星形胶质细胞除了表达 α v β 8 外,还大量表达α v β 5 整合素 [13] 。α v β 5 已被证明 可在肿瘤细胞中激活TGF-β1[14],虽目前尚无证据 表明其在CNS中的类似作用,但仍不可完全除外α v β 5 等因素参与HI后CNS中TGF-β1的活化。
综上,本研究发现发育期大鼠HIBD时,星 形胶质细胞高表达的整合素β 8 在CNS中对TGF-β1 的活化起关键调控作用。α v β 8 /TGF-β1通路可能与 CNS损伤后自身启动的一系列保护性调控直接相关。
| [1] | Chaboub LS, Deneen B. Developmental origins of astrocyte heterogeneity: the final frontier of CNS development[J]. Dev Neurosci, 2012, 34(5): 379-388. |
| [2] | Ben Achour S, Pascual O. Astrocyte-neuron communication: functional consequences[J]. Neurochem Res, 2012, 37(11): 2464-2473. |
| [3] | Katsuno M, Adachi H, Banno H, et al. Transforming growth factor-β signaling in motor neuron diseases[J]. Curr Mol Med, 2011, 11(1): 48-56. |
| [4] | Mu DZ, Cambier S, Fjellbirkeland L, et al. The integrin alpha(v)beta8 mediates epithelial homeostasis through MT1-MMP-dependent activation of TGF-beta1[J]. J Cell Biol, 2002, 157(3):493-507. |
| [5] | Nishimura SL, Boylen KP, Einheber S, et al. Synaptic and glial localization of the integrin alphavbeta8 in mouse and rat brain[J]. Brain Res, 1998, 791(1-2): 271-282. |
| [6] | Li JH, Qu Y, Li XH, et al. The role of integrin alpha(v)beta(8) in neonatal hypoxic-ischemic brain injury[J]. Neurotox Res, 2010, 17(4): 406-417. |
| [7] | Moreno C, Sampieri A, Vivas O, et al. STIM1 and Orai1 mediate thrombin-induced Ca(2+) influx in rat cortical astrocytes[J]. Cell Calcium, 2012, 52(6): 457-467. |
| [8] | Abe M, Harpel JG, Metz CN, et al. An assay for transforming growth factor-beta using cells transfected with a plasminogen activator inhibitor-1 promotor-luciferase construct[J]. Anal Biochem, 1994, 216(2): 276-284. |
| [9] | Mobley AK, McCarty JH. β8 integrin is essential for neuroblast migration in the rostral migratory stream[J]. Glial, 2011, 59(11): 1579-1187. |
| [10] | Tchaicha JH, Reyes SB, Shin J, et al. Glioblastoma angiogenesis and tumor cell invasiveness are differentially regulated by β8 integrin[J]. Cancer Res, 2011, 71(20): 6371-6381. |
| [11] | Kou W, Hu GH, Yao HB, et al. Regulation of transforming growth factor-β1 activation and expression in the tissue remodeling involved in chronic rhinosinusitis[J]. ORL J Otorhinolaryngol Relat, 2012, 74(3):172-178. |
| [12] | Cambier S, Gline S, Mu DZ, et al. Integrin alpha(v)beta8-mediated activation of transforming growth factor-beta by perivascular astrocyte[J]. Amer J Pathol, 2005, 166(6): 1883-1894. |
| [13] | Milner R, Relvas JB, Fawcett J, et al. Development regulation of alphav integrins produces functional changes in astrocyte behavior[J]. Mol Cell Neurosci, 2001, 18: 108-118. |
| [14] | Desgrosellier JS, Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10(1): 9-22. |
 2014, Vol. 16
2014, Vol. 16


