戊二酸血症I型(glutaric aciduria type 1, GA-1)是常染色体隐性遗传病,因戊二酰辅酶A 脱氢酶(glutaryl-CoA dehydrogenase,GCDH)缺陷, 导致赖氨酸、羟基赖氨酸、色氨酸代谢紊乱,从 而引起3-羟基戊二酸(3 hydroxyglutaric,3HG) 和戊二酸堆积而引发疾病。大多数患儿在6~18月 龄之间可因发热、呕吐、腹泻、预防接种等应激 情况而诱发此病,主要表现为脑萎缩,大头畸形 及纹状体变性所致的急性肌张力障碍。新生儿期 筛查戊二酰肉碱(C5DC)的增多可识别此病 [1] ; 尿液有机酸分析也表明存在过剩的3HG及戊二酸。 该病国内目前病例数不多,且临床表现不典型, 很多患儿在临床上未能及时获得诊断而贻误治疗。 现将我院2012年末至2013年初收治的2例GA-1 患儿报道如下,并结合国内外文献报道进行分析, 以提高对该病的认识。
病例1,女,2个月,因发现肝功能异常1 d 来我院就诊。患儿无发热,无抽搐,有腹泻(每 日2~3次,量不多)。患儿系第1胎第1产,足 月顺产,出生体重3.2 kg,人工喂养,患儿父母均 体健,非近亲结婚,家族中无类似患者,也无其 他遗传性疾病史。体查:头围36.5 cm,体重5.5 kg, 身长50 cm,前囟3×3 cm,略塌陷,张力正常, 营养中等,无特殊面容,神志清,反应一般,生 长发育略迟缓,不会抬头,全身皮肤无黄染及出 血点,呼吸平稳,两肺呼吸音粗,无罗音,心音 中,律齐,腹平软,肝肋下3 cm,脾未及,四肢 肌张力IV级,双侧膝反射亢进,双侧跟腱反射减 弱,双侧Babinski征(+)。实验室检查:血常规 示:白细胞3.7×10 9 /L,红细胞3.93×10 12 /L,血红蛋 白119g/L,红细胞压积0.338,血小板394×10 9 /L,中性粒细胞计数1.169×10 9 /L,以上结果提示血常规 正常。肝功能示:谷丙转氨酶201U/L(增高),谷 草转氨酶161 U/L(增高),直接胆红素9.6μmol/L(正 常),总胆汁酸164.5μmol/L(正常)。巨细胞病毒 抗体IgM和IgG均阳性,血人类巨细胞病毒DNA定 量检测结果为1.5×10 4 (+)。急诊血氨38.9μmol/L (增高),血乳酸3.8 mmol/L(增高)。静脉血气 分析示:pH 7.29,二氧化碳分压45.7 mm Hg,氧分 压39.9 mmHg,标准碳酸氢根19.8 mmol/L,实际碱 剩余-5.0 mmol/L,总氧含量5.0 mmol/L,二氧化碳 总量19.6mmol/L,提示轻度代谢性酸中毒。眼底检 查提示:视盘界清色可,颞侧数处白色斑片样渗出。 头颅MRI提示:两侧大脑半球体积缩小,脑回萎缩, 两侧额叶为著,脑白质较少,脑白质髓鞘发育落后, 胼胝体细薄,透明隔间腔存在,脑室系统稍扩大, 脑池、脑沟稍加深,两侧额、颞、顶部蛛网膜下腔 明显增宽,中线居中,两侧额、颞、顶部硬膜下积 液(图 1)。患儿入院后首先考虑“巨细胞病毒肝炎”, 予更昔洛韦治疗2周后,转氨酶恢复正常,但2周 内头围增长迅速至42 cm,有轻度落日眼,肝肋下 仍有3 cm,俯卧位抬头20°,不会翻身,生长发育 落后,检查眼底及头颅MRI均有异常,不符合诊断 及疾病转归过程。予患儿行血串联质谱(MS/MS) 分析,结果提示C5DC为1.25μM(正常参考值为 0~0.2μM),C5DC/C8比值为25.63(正常参考值为 0~2.5),均明显升高,符合GA-1。尿气相色谱/质 谱(GC/MS)分析结果显示,在尿中检出大量戊二 酸(224.58,基准值0.001)和3HG(25.53,基准值 0.001),确诊为GA-1(图 2)。给予患儿限制蛋白 饮食,补充维生素B2 200~300 mg/d,每日补充左旋 肉碱50~100 mg/kg,同时转入康复科进行肢体训练。
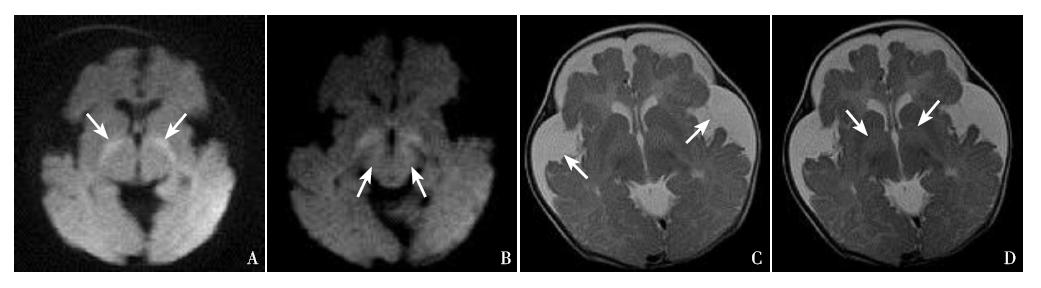 |
图 1 病例1头颅MRI结果 A:横断位DW序列上双侧苍白球呈对称性高信号影(箭头所示);B:横断位DW序 列上双侧大脑脚可见对称性高信号影(箭头所示);C:横断位T2WI上双侧额颞部蛛网膜下腔增宽(箭头所示);D:横断 位T2WI上双侧苍白球对称性高信号影(箭头所示)。 |
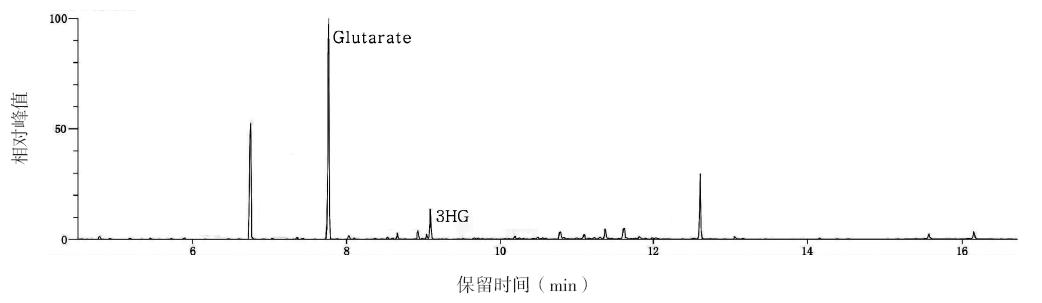 |
图 2 病例1尿GC/MS图谱 图中可见大量戊二酸(Glutarate)及3HG。 |
病例2,男,13个月,因腹泻4 d,反复惊厥 半天入院治疗。患儿每日腹泻10余次,呈黄色蛋 花汤样,量多少不等,无粘液、脓血,无腥臭味, 排便时无面色涨红、双手握拳,入院前惊厥半天, 表现为神志不清、两眼凝视、上肢屈曲抖动、下肢 强直,持续约几十秒不等,可自行缓解,无面色苍 白,无口周发绀,无明显牙关紧闭,无口吐泡沫, 无发热,惊厥停止后神志转清,精神稍差,期间反 复发作数次,间歇期无四肢活动障碍,无饮水呛咳。 患儿系第1胎第1产,剖腹产(过期产,胎心不 正,宫内缺氧),出生体重3.0 kg,母乳喂养,患 儿父母均体健,非近亲结婚,家族中无类似患者, 也无其他遗传性疾病史。体查:头围47.5 cm,体 重11.5 kg,身长75 cm,前囟1×1 cm,张力正常, 营养中等,无特殊面容,神志清,双侧瞳孔等大 等圆,对光反射灵敏,咽无充血,扁桃体无肿大, 心肺阴性,腹平软,肝脾肋下未及,肠鸣音正常, 四肢肌力Ⅴ级,肌张力正常,膝反射(+),颈软, Kernig征(-),Brudzinski征(-),Babinski征 (-),Chaddock征(-)。实验室检查:脑脊液 检查示:无色、清晰,白细胞计数4.0×10 6 /L,红 细胞计数4×10 6 /L,潘台氏试验(-),糖半定量 >2.28 mmol/L,蛋白定量<0.2 g/L,细菌(-), 以上结果提示脑脊液检查正常。腹部B超示肠 管积气。血气分析示:pH 7.33,二氧化碳分 压37.4 mm Hg,氧分压54.3 mm Hg,碳酸氢根 19.1 mmol/L,标准碳酸氢根19.6 mmol/L,实际碱剩余-5.6 mmol/L,提示轻度酸中毒。肝功能 示:谷丙转氨酶32 U/L,谷草转氨酶37 U/L,碱 性磷酸酶126U/L,谷氨酰转肽酶10U/L,白蛋白 41.9 g/L,球蛋白20.8g/L,直接胆红素2.6μmol/L,间 接胆红素10.9μmol/L,以上结果提示肝功能基本正常。 血浆乳酸1.40 mmol/L(正常)。血浆氨14.1μmol/L (正常)。血常规示:白细胞5.9×10 9 /L,红细胞 5.12×10 12 /L,血红蛋白82g/L,血小板234×10 9 /L, 中性粒细胞计数1.021×10 9 /L,中性粒细胞相对值 0.173,以上结果提示血常规正常。头颅MRI提示: 两侧基底节区肿胀并呈信号异常,在T1WI为稍低信 号、T2WI为稍高信号,两侧丘脑也见类似异常信号 影;胼胝体发育偏小,两侧脑白质容积减少,两侧 脑室后角白质可见斑片状稍长T2信号影;两侧脑室 扩大,两侧颞窝及外侧裂池内可见椭圆形异常信号 影,呈长T1长T2信号;两侧大脑蛛网膜下腔普遍 性增宽,脑沟加深;右侧额部颅板下可见弧形异常 信号影,T1WI为稍高信号;两侧基底节区及丘脑异 常信号影(图 3)。患儿入院后考虑“腹泻病、抽搐 待查”,因患儿头颅MRI存在异常,提示遗传代谢 病可能。予患儿行血MS/MS分析,结果显示C5DC 为0.48μM,C5DC/C8比值为10.91,均明显升高,符 合GA-1。尿GC/MS分析结果显示:在尿中检出大量 戊二酸(31.3μM,正常参考值0.6~5.9μM),确诊为 GA-1(图 4)。给予患儿限制蛋白饮食,补充维生 素B2 200~300 mg/d,每日补充左旋肉碱50~100 mg/kg 后,患儿家属要求出院。
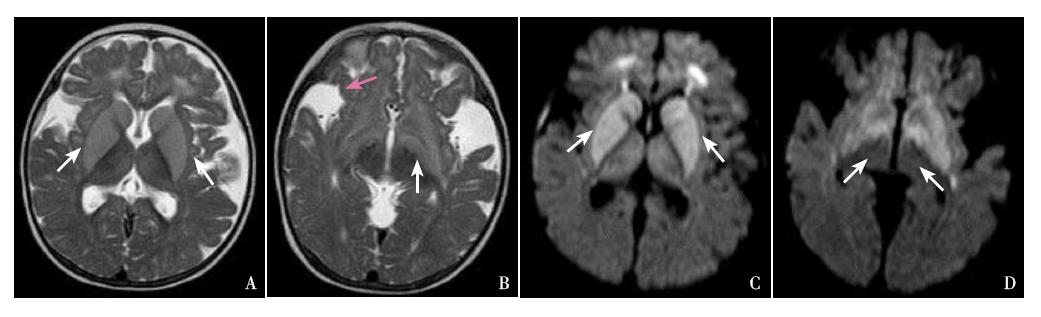 |
图 3 病例2头颅MRI结果 A:横断位T2WI上双侧苍白球、豆状核及尾状核头均呈对称性高信号影(箭头所示); B:横断位T2WI上双侧大脑脚可见对称性高信号影(白色箭头所示),双侧颞部蛛网膜下腔明显增宽(红色箭头所示);C: 横断位DW序列双侧苍白球、豆状核及尾状核头呈对称性高信号影(箭头所示);D:横断位DW序列双侧大脑脚可见对称 性高信号影(箭头所示)。 |
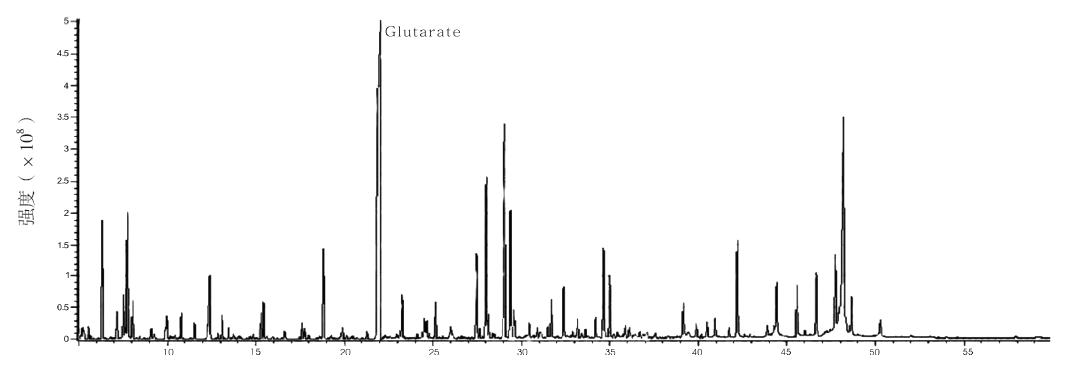 |
图 4 病例2尿GC/MS图谱 图中可见大量戊二酸(Glutarate)。 |
讨论:Goodman于1975年首次报道了GA-1, 致病基因位于染色体19p13.2上,由GCDH缺乏引 起赖氨酸、羟赖氨酸、色氨酸的代谢紊乱,目前 有超过200个已知的GCDH基因突变 [1] 。患者可 出现脑发育不全(加宽的脑裂)和基底神经节病变, 纹状体变性继发急性肌张力障碍。在大多数情况 下,急性感染、发热、脱水、呕吐可诱发纹状体 神经元变性,如果不及时治疗,神经损伤造成不可逆的损害,可导致患者生活质量下降甚至死亡。 回顾国内文献,GA-1临床表现有轻有重,轻 者可无症状,重者则表现为严重的代谢危象、四 肢痉挛性瘫痪和肌张力不全等 [2] 。70%患儿会出 现头围增大 [3] ,这与本文2例病例报道基本一致。 部分患儿还会有视网膜出血、白内障、眼肌瘫痪 等眼部改变,疾病晚期可出现低血糖、中重度代 谢性酸中毒及高氨血症等严重代谢紊乱。本病神经影像学可表现为脑室扩大、前部和颞侧脑萎缩、 基底节改变、硬膜下积液和脑白质低密度灶等改 变,与本文2例病例基本一致。尿有机酸代谢筛 查存在过剩的3HG及戊二酸可确诊本病。
病例1患儿临床症状没有特异性,仅表现为 头围增长过快,头大畸形,没有明显的肌张力下 降、抽搐、兴奋,也无明显高血氨及高乳酸水平。 此次因肝功能异常入院,初步诊断为巨细胞病毒 肝炎,经治疗后肝功能恢复正常;但因2周内头 围增长迅速,伴有落日眼,眼底检查及头颅MRI 均有异常,考虑与该病转归不符,于是在患儿3 月龄时行血尿代谢筛查确诊为GA-1。病例2患儿 生后至今无明显症状及体征,第13个月时因腹泻 后诱发此病,表现出惊厥后行头颅MRI,结果显 示两侧脑室扩大,两侧颞窝及外侧裂池内可见椭 圆形异常信号影,呈长T1长T2信号,两侧基底 节区及丘脑异常信号影,提示遗传代谢病可能后 行血尿代谢筛查确诊为GA-1。可见GA-1早期诊 断困难,2例患儿均出现头围增大,头颅MRI提 示脑室扩大及基底节改变,结合国内外文献提示 该特点为GA-1的常见表现[3]。因此,临床遇到自 幼出现大头畸形、智力运动发育障碍以及代谢紊 乱者应考虑遗传代谢病的可能。通过血常规、血 气分析、血氨、血乳酸等检查,均未发现明显异 常,提示GA-1容易漏诊及误诊。大多数患儿在2~ 37个月(平均14个月)起病,因发热、呕吐、腹泻、 预防接种等应激情况下可诱发此病,行尿GC/MS分 析可确诊本病。国外开展新生儿筛查可在早期确诊 本病,新生儿筛查可以识别所有GA-1的新生儿(除 了那些极少数因低排泄而漏诊的新生儿外) [4] 。在 美国GA-1的发病率约为1:54000活产婴儿[5],有 研究结果证实:新生儿期及时的诊断和治疗GA-1 与已经出现神经系统表现的患儿相比,可以显著 减少神经系统并发症的发生 [6] 。这些结果进一步支 持新生儿筛查的重要性,早期诊断,可以改善预后, 避免严重的神经系统功能障碍,提高患儿的生存 质量。在我国目前尚未在全国范围内开展此项技 术,除了积极对疑似患儿进行尿有机酸分析外, 建议国内开展此项新生儿筛查,使GA-1得到早期 治疗,减少神经系统功能障碍的发生。
在过去的30年里国外报道曾试图建立和优化 GA-1治疗,但由于缺乏专门处理中心,很多情况下GA-1被误诊及出现不恰当的治疗。一般治疗包 括左旋肉碱(每日100 mg/kg体重)以及低蛋白饮食, 特别是减少赖氨酸和色氨酸的摄入,目前核黄素 补充的作用还不是很清楚。这种治疗策略在早期 诊断的患儿中已大大减少急性脑病的发病率和死 亡率。因此,GA-1缺乏现在被认为是一种可治疗 的神经代谢紊乱。如遇感染、外伤和手术等可增 加脑病的发生风险及不可逆的脑损伤。出现脑损 伤时的管理包括 [7, 8] :(1)控制高能量摄入使机体 处于低代谢状态;(2)24~48 h内通过限制蛋白 质饮食减少3HG的生成;(3)增加生理解毒机制 及补充左旋肉碱防止继发性肉碱枯竭;(4)通过 静脉输液维护正常的水、电解质及酸碱平衡。总 之,GA-1是一种常染色体隐性遗传代谢病,若患 儿母亲将来怀孕时复发的机会是25%。因此,在 一个家庭中如果一个孩子被诊断出患有这种疾病, 那么需进行产前诊断来指导怀孕。如果有无症状 的兄弟姐妹,那么他们应该行GA-1筛查,若阳性 则需及时进行适当的治疗,这样会减少脑病的发 生风险并保证更好的生存质量。
| [1] | Funk CB, Prasad AN, Frosk P, et al. Neuropathological, biochemical and molecular findings in a glutaric acidemia type 1 cohort[J]. Brain, 2005, 128(Pt 4): 711-722. |
| [2] | 刘丽英, 邹丽萍, 王旭, 等.戊二酸尿症I型11例诊断及治疗分析[J]. 临床儿科杂志, 2009, 27(12): 1115-1117. |
| [3] | Martinez Granero MA, Garcia Perez A, Martinez-Pardo M, et al. Macrocephaly the first manifestation of glutaric aciduria type I: the importance of early diagnosis[J]. Neurologia, 2005, 20(5): 255-260. |
| [4] | Viau K, Ernst SL, Vanzo RJ, et al. Glutaric acidemia type 1: outcomes before and after expanded newborn screening[J]. Mol Genet Metab, 2012, 106(4): 430-438. |
| [5] | Crombez EA, Cederbaum SD, Spector E, et al. Maternal glutaric acidemia, type I identified by newborn screening[J]. Mol Genet Metab, 2008, 94(1): 132-134. |
| [6] | Mushimoto Y, Fukuda S, Hasegawa Y, et al. Clinical and molecular investigation of 19 Japanese cases of glutaric acidemia type 1[J]. Mol Genet Metab, 2011, 102(3): 343-348. |
| [7] | Strauss KA, Puffenberger EG, Robinson DL, et al. Type I glutaric aciduria, part 1: natural history of 77 patients[J]. Am J Med Genet C Semin Med Genet, 2003, 121C(1): 38-52. |
| [8] | Kolker S, Christensen E, Leonard JV, et al. Diagnosis and management of glutaric aciduria type I—revised recommendations[J]. J Inherit Metab Dis, 2011, 34(3): 677-694. |
 2014, Vol. 16
2014, Vol. 16
