2. 山东省省立医院儿科, 山东 济南 250021;
3. 山东淄博矿业集团中心医院检验科, 山东 淄博 255120
肺炎支原体(MP)感染为儿童社区获得性肺 炎的常见疾病之一,本病全年均可发病,占小儿肺 炎的 10% ~20%,流行年份甚至高达 30%[1]。肺 炎支原体肺炎(Mycoplasmapneumoniaepneumonia, MPP)是儿童肺炎常见的种类之一,除引起呼吸系 统感染外,还可引起消化、神经、心血管等多个 系统损害[2]。由于MP 感染病程长,肺部体征不明显, 尤其以大叶性肺炎为主要表现的 MPP 临床表现症 状重,甚至可引起全身炎症反应综合征及心功能 不全等肺外并发症,且大叶性肺炎有逐年增多趋 势[3]。MPP 是学龄期和青少年时期最常见的肺炎, 也可发生于婴幼儿,以往一般临床表现较轻,且 对大环内酯类药物敏感,部分患儿甚至呈自限性 病程。但是近年来 MPP 病例猛增,尤其是大城市 人口密集区,表现为起病急、病情重,甚至遗留 后遗症,影响儿童的健康[4]。
MPP 的发生与免疫因素有关,急性期存在某 些细胞因子浓度的异常,导致细胞免疫受损。重 症 MPP 的报道近来也有不少,主要表现为起病急, 以剧烈咳嗽、气喘起病,并很快出现发热和呼吸 困难,肺外并发症多见,肺部病变严重,可出现 2 个或 2 个以上肺外器官受损,甚至多器官功能衰 竭而死亡。有研究证实,细胞免疫在肺炎发病机 制中起重要作用[5]。迄今为止,MPP 发病机制还 不十分清楚,多数人认为炎性细胞因子介导的炎 症反应在重症MPP 的转归中起了重要作用[6],其中, 肿瘤坏死因子 α(TNF-α)、白细胞介素 6(IL-6)等细胞因子或炎性介质在 MPP 的发病机制中起 了重要作用[7]。当 MP 感染机体时,人体免疫系统 可产生免疫应答,产生多种细胞因子和其他体液 因子,保护机体抵抗病原体侵袭,但过量的炎性 因子对机体有害,可导致疾病的发生。有报道, TNF-α、IL-6 等细胞因子与 MP 诱发的毒性作用及 预后密切相关[8]。
半乳凝素 3(Gal-3)是半乳凝素家族成员之一, 它可与细胞内糖蛋白、细胞表面分子以及细胞外 基质作用,参与介导许多炎症性疾病的免疫应答 状态。目前国内关于 Gal-3 与 MPP 关系的研究尚 无报道。本研究比较了 TNF-α、IL-6、Gal-3 等细 胞因子在 MPP 治疗前后浓度的变化,以探讨 MPP 发生发展过程中上述细胞因子的变化规律及作用, 现报告如下。 1 资料与方法 1.1 研究对象及分组
研究对象为来自山东淄博矿业集团中心医院 2010 年 1 月至 2013 年 3 月间住院患儿,共 48 例。 其中男 27 例,女 21 例,年龄 2~10 岁。病例的诊 断依据 2013 修订的《儿童社区获得性肺炎管理指 南》 [9]。入选病例不伴有肺结核、支气管哮喘等其 他呼吸系统疾病。同时对患儿行胸部 X 线片、胸 部 CT、心电图、心肌酶、血沉、细菌培养、凝血 五项、肝功能等检查。所有病例根据肺炎的严重 度评估分为两组[10,11,12]:重症 MPP 组(简称重症组) 和普通 MPP 组(简称轻症组)。重症组 21 例中, 男 12 例,女 9 例,年龄 2~8 岁,平均 3.2 岁。重 症组包括重度和极重度患儿[10,13,14,15]:有胸壁吸气性 凹陷或鼻翼扇动或呻吟之一表现者,提示有低氧 血症,为重度肺炎;出现中心性紫绀、严重呼吸 窘迫、拒食或脱水征、意识障碍(嗜睡、昏迷、 惊厥)之一表现者为极重度。
轻症组 27 例,无呼吸困难、缺氧及肺外合并 症,其中男 15 例,女 12 例,年龄 2~10 岁,平均 5.1 岁。30 例健康儿童作为对照组,年龄 2~10 岁,其 中男 16 例,女 14 例,平均年龄 5.6 岁,无器质性 疾病,近期(2 个月内)无急性感染性疾病史。各 组年龄、性别比较差异均无统计学意义(P>0.05)。 1.2 标本的获取
对48例MPP患儿入院后第2天、第10天分 别空腹无菌抽取外周静脉血,室温放置 2h,然后 1000rmp 离心 20min,取上清液 -20℃冻存。对 照组 30 例健康儿童同法抽血、离心、冻存。操作 由专人负责,严格按说明书进行。 1.3 统计学分析
采用 SPSS12.0 统计软件进行统计学分析。计 量资料用均数 ± 标准差(x±s)表示,多组间比 较采用方差分析,自身前后比较采用配对t检验, P<0.05 为差异有统计学意义。 2 结果 2.1 各组血清 TNF-α、IL-6 和 Gal-3 浓度检测结 果
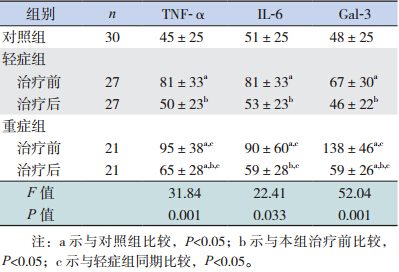
重症组和轻症组治疗前血清TNF-α、IL-6 和Gal-3 含量均明显高于对照组(P<0.05),其 中重症组明显高于轻症组(P<0.05)。两组患儿 治疗后血清 TNF-α、IL-6 和Gal-3 含量明显下降 (P<0.05),其中轻症组治疗后与对照组比较差异 无统计学意义(P>0.05),重症组治疗后血清 IL-6 与对照组比较差异无统计学意义(P>0.05),但血 清 TNF-α 和Gal-3 含量治疗后仍高于对照组及轻 症组(P<0.05),见表 1。
| 表 1 各组血清TNF-α、IL-6 和 Gal-3 浓度的比较(x±s) |
炎性细胞因子在 MP 肺部感染中起重要作用, 存在着广泛的生理和免疫功能,在感染所致急性 肺损伤的过程中起着重要作用[14,15,16]。因此检测患 者血清 TNF-α 含量可反映患者炎症反应强度及损 伤程度。TNF-α 的作用较广,它能直接损伤肺内 皮细胞、激活中性粒细胞、凝血系统和补体系统, 造成肺组织损伤,导致急性肺损伤[15,16] 。TNF-α 可激活内皮细胞活化,导致肺水肿,在急性呼吸 窘迫综合征患者血清和支气管肺泡灌洗液中可检 测到 TNF-α 水平升高[17]。
TNF-α 还参与内皮细胞的损伤,促进微血栓 形成;可降低肌细胞跨膜电位,使 Na+ -K +泵失效, 从而诱发其他炎性介质的释放,引起组织细胞损 伤,与其他细胞因子协同作用加重全身炎症反应, 而且血清中浓度越高,全身炎症反应越严重。有 研究表明 MPP患儿血清中 TNF-α 浓度明显高于 对照组,而治疗后恢复期其浓度明显下降[18,19,20]。还 有研究表明 TNF-α 浓度增高可能在小儿 MPP导 致喘息样发作中起重要作用[19]。
IL-6 是炎症反应中的重要因子,是急性期合 成的重要介质。在肺炎感染时,IL-6 的产生、释 放异常,不仅与单核 - 巨噬细胞、T 细胞、B 细胞 大量激活有关,IL-6 具有调节免疫应答、免疫期 反应作用,并参与机体炎症反应和抗感染作用。 虽然IL-6可激活促炎症反应和抗炎反应两个过程, 但主要是促炎作用[17] 。IL-6可溶性 IL-6受体(sIL-6R)浓度越高,死亡风险越大 [15]。目前认为促炎 介质(如 IL-1、IL-6、IL-8、TNF-α)和抗炎介质(如 IL-10、IL-4)的平衡失调在肺部感染中发挥重要 作用[14,15,16,18] 。肺部 MP感染时肺泡上皮的损伤导致 肺泡巨噬细胞和中性粒细胞以及全身炎症连锁反 应活化,引起肺内炎症反应,中性粒细胞凋亡增加, 毛细血管内皮细胞受损,支气管肺泡灌洗液及血 清中 TNF-α、IL-6、IL-8和 IL-10等水平增高。
有研究表明MPP 患者支气管肺泡灌洗液中的 TNF-α、IL-6 水平可反映重症 MPP 患者肺部感染 程度,TNF-α、IL-6 水平越高,肺部感染程度越 重[21]。国外亦有报道IL-6 水平能反映肺炎严重程 度[22]。
Gal-3 在急性炎症反应及固有性免疫的调节中 作为一种细胞因子发挥着重要的作用。近年来, Gal-3 越来越受到关注。Gal-3 是一种强大的促炎 症因子,它可以激活 NADPH 氧化酶,刺激中性粒 细胞超氧化物的产生;介导脂多糖导致的 IL-1的 产生;促进单核细胞的趋化。巨噬细胞表面也有 Gal-3 的表达,通过旁分泌机制募集和激活巨噬细 胞,对内环境的稳定和巨噬细胞功能的发挥有重 要作用[23] 。这些都显示 Gal-3 作为一种新的控制炎 症的靶点的可能。
本研究显示,重症组和轻症组患儿治疗前血 清中 TNF-α、IL-6、Gal-3 浓度均高于正常对照组, 重症组明显高于轻症组,且两组患儿治疗后上述 指标均明显下降,提示 MPP 患儿急性期 TNF-α、 IL-6、Gal-3 水平升高,随着感染得到控制以及病 情的好转,患儿血清中 TNF-α、IL-6、Gal-3 浓度 逐渐降低,且TNF-α、IL-6、Gal-3 浓度高低与 病情轻重有密切关系。同时提示 TNF-α、IL-6、 Gal-3 参与了 MPP 的炎性病理过程,协同参与整个 炎症部位的炎性损伤。由此可见,TNF-α、IL-6、 Gal-3 与其他因子一起构成复杂的细胞因子网络, 在 MP 感染中作为一种主要的非特异性炎症因子, 参与肺部炎症的病理过程,且血清含量与 MPP 病 情严重程度密切相关,显示 TNF-α、IL-6、Gal-3 作为一种新的控制炎症的靶点的可能。总之, MPP 时 血 清 TNF-α、IL-6、Gal-3浓度升高,且 随着病情的严重程度的变化而增高。因此,血清 TNF-α、IL-6 和 Gal-3 浓度可反映 MPP 病情轻重, 作为病情评估的指标。
| [1] | 朱影, 刘晓琳, 叶玉兰. 肺炎支原体所致大叶性肺炎46 例临床分析[J]. 中华全科医学, 2012, 10(4): 446-447. |
| [2] | 崔娟, 王佳, 姚慧生, 等. 2006-2010 年儿童肺炎支原体感染流行病学分析[J]. 中国实用儿科杂志, 2013, 28(6): 560-561. |
| [3] | 岳保珠, 吴春莲, 刘丽平. 儿童肺炎支原体感染性大叶性肺炎l0 年发病研究[J]. 医学综述, 2010, 16(13): 2071-2073. |
| [4] | 张永明, 刘秀云, 江载芳. 儿童肺炎支原体肺炎合并肺不张发病率及预后研究[J]. 中国实用儿科杂志, 2010, 25(2): 143-146. |
| [5] | 徐晓群, 周波, 吴新萍. 肺炎患儿血清白细胞介素-10、可溶性细胞介素-2 受体水平的临床意义[J]. 实用儿科临床杂志,2004, 19(2): 124. |
| [6] | 余峰, 崔敏娴, 姚冬莉. 儿童重症肺炎血清致炎性细胞因子变化及意义探讨[J]. 医学研究杂志, 2007, 36(2): 74-76. |
| [7] | 李晓芹. 重症支原体肺炎患儿血清TNF-α、IL-6、IL-8 检测及其临床意义[J]. 实用诊断与临床治疗杂志, 2005, 19(9):649-650. |
| [8] | Narita M. Mycoplasma pneumoniae encephalitis andcytokines[J]. Pediatrics, 2008, 121(1): 224-225. |
| [9] | 陆权. 儿童社区获得性肺炎管理指南(2013 修订) [J]. 中华儿科杂志, 2013, 51(10): 745-752. |
| [10] | Harris M, Clerk J, Coote N, et al. British Thoracic Societyguidelines for the managerment of community acquiredpneumonia in children: update 2011[J]. Thorax, 2011, 66 (Suppl2): ii1-23. |
| [11] | Zar HJ, Jeena P, Argent A, et al; Working Groups of thePaediatric Assembly of the South African Thoracic Society.Diagnosis and management of community-acquired pneumoniain childhood-South African Thoracic Society Guidelines[J]. SAfr Med J, 2005, 95(12 Pt 2): 977-981. |
| [12] | Gove S. Integrated management of childhood illness byoutpatient health workers: technical basis and overview. TheWHO Working Group on Guidelines for Integrated Managementof the Sick Child[J]. Bull World Health Organ, 1997,75(Suppl 1): 7-24. |
| [13] | Bradley JS1, Byington CL, Shah SS, et al. The managementof community-acquired pneumonia in infants and childrenolder than 3 months of age: clinical practice guidelines by thePediatric Infectious Diseases Society and the Infectious DiseasesSociety of America[J]. Clin Infect Dis, 2011, 53(7): e25-e76. |
| [14] | Ahn KK, Kwon D, Jung K, et al. Identification of interleukin-1,tumor necrosis factor-alpha, and interleukin-6 expressionin lungs from pigs naturally infected with Mycoplasmahyopneumoniae by in situ hybridization[J]. J Vet Med Sci, 2009,71(4): 441-445. |
| [15] | Mukhopadhyay S, Hoidal JR, Mukherjee TK. Role of TNFalphain pulmonary pathophysiology[J]. Respir Res, 2006,7(125): 1-9. |
| [16] | Baluk P, Yao LC, Feng J, et al. TNF-α drives remodeling ofblood vessels and lymphatics in sustained airway inflammationin mice[J]. Clin Invest, 2009, 119(10): 2954-2964. |
| [17] | 俞敏, 田兆方. 急性肺损伤时损伤标志物的研究进展观[J].中国当代儿科杂志, 2013, 15(10): 94-98. |
| [18] | 曹岩, 刘红, 卢晟晔, 等. 儿童肺炎支原体肺炎血清中TNF-α、IL-6、IL-8 和IL-10 浓度测定及其临床意义的研究[J].中国妇幼保健, 2008, 23(18): 2575-2578. |
| [19] | 郦银芳, 于莹, 陆志芳. IL-13 和TNF-α 在肺炎支原体肺炎儿童血清中的表达及意义[J]. 中国当代儿科杂志, 2010,12(4): 275-277. |
| [20] | 庞焕香, 乔红梅, 成焕吉, 等. 支原体肺炎患儿肺泡灌洗液中TNF-α、IL-6、IL-10 水平检测及意义[J]. 中国当代儿科杂志, 2011, 13(10): 808-810. |
| [21] | 叶新明, 钱克俭. 重症肺炎支原体肺炎肺泡灌洗液中TNF-α、IL-6、IL-8、IL-10 水平观察[J]. 南昌大学报( 医学版),2010, 50(4): 72-74. |
| [22] | Antunes G, Evans SA, Lordan JL. Systemic eytokine levelsin community-acquired pneumonia and their association withdisease severity[J]. Eur Respir, 2002, 20(4): 990-995. |
| [23] | Ben-Rafael Z, Orvieto R. Cytokines involvement in reproduction[J]. Fertile Steril, 1992, 58(6): 1093-1099. |
 2014, Vol. 16
2014, Vol. 16