急 性 淋 巴 细 胞 白 血 病(acutelymphoblastic leukemia,ALL)是儿童时期最常见的恶性肿瘤,是 我国儿童主要的死亡原因之一。随着分子生物学、 细胞遗传学、药物代谢酶等研究的不断深入,儿 童 ALL 的危险度分组逐步完善;且随着 ALL 治疗 方案的优化,其疗效也不断提高。目前国际上先 进治疗组治疗儿童 ALL 的 5 年无事件生存(EFS) 率接近 90%,是当今疗效最好、治愈率最高的恶 性肿瘤之一,但仍有 10% 左右的病例会复发[1]。 我国依据危险度分组的儿童ALL 治疗已普遍应用, 同时由于支持治疗的加强,感染等相关并发症的 发生率大为降低,近远期疗效均明显提高,但远 期疗效的报道有限。现对我院 1999 年 1 月至 2007 年 12 月收治的 318 例初治 ALL 患儿长期疗效进行 回顾性分析。 1 资料与方法 1.1 研究对象
选取1999年1月至2007年12月在中国医学 科学院血液病医院儿童血液病诊疗中心住院治疗 的 318 例 ALL 初诊患儿为研究对象,中位年龄 6 岁(1~16 岁),其中男 204 例,女 114 例,男女 比例 1.8:1;T 细胞 ALL38 例,B 细胞 ALL280 例。 所有病例的诊断和疗效标准按照《血液病诊断和 疗效标准》第 3 版[2]。 1.2 危险度分型
危险度分型方法同既往报道[3],分为标危组 (SR) 和 高 危 组(HR)。(1)SR 组: 年 龄 1~ 10 岁,WBC ≤ 50×10 9/L,无预后不良的染色体 结构或数量异常者;(2)HR 组:年龄 <1 岁或 >10 岁,WBC>50×10 9/L,伴有染色体 t (4;11) 或 t (9;22),亚二倍体核型,联合化疗第 4 周后骨髓未 达完全缓解(CR),符合以上任何一项者。 1.3 治疗方案
按治疗方案不同分为 CAMSBDH-ALL99 治疗 组(简称 99 方案)(病例收治于 1999 年 1 月至 2002 年 12 月,共 83 例,其中 SR 患儿 48 例,HR 患儿 35 例)和 CAMSBDH-ALL03 治疗组(简称 03 方案)(病例收治于 2003 年 1 月至 2007 年 12 月, 共 235 例,其中 SR 患儿 131 例,HR 患儿 104 例)。 具体治疗方案参照既往报道[3,4]:(1)99 方案采 用传统方案:①患儿确诊 ALL 后给予“VDLP”[长 春新碱(VCR)+ 柔红霉素(DNR)+ 左旋门冬酰 胺酶(L-asp)+ 泼尼松(Pred)] 诱导治疗,缓解 后予“CAT”[环磷酰胺(CTX)+ 阿糖胞苷(AraC)+6-巯基嘌呤(6-MP)] 巩固,早期强化采用 “TA”[替尼泊甙(VM26)+Ara-C],维持治疗采 用“MM”[甲氨喋呤(MTX)+6-MP] 和“COAP” (CTX+Ara-C+VCR+Pred)。②再诱导治疗:完全 缓解(CR)后第 12 月和第 24 月时采用“VDLP” 方案再诱导。③庇护所的治疗:采用“大剂量 MTX(HD-MTX)+ 亚叶酸钙(CF)+VCR+Pred” 方案,每 3 个月 1 次,同时进行“三联”鞘注, 共 21~23 次;初诊时伴有中枢神经系统浸润和治 疗中发生中枢神经系统白血病的患儿,采取连续 的“三联”鞘注,隔日 1 次,直到连续 3 次以上 脑脊液检查正常,均未加用颅脑放疗。④总疗程: 女孩 2 年半,男孩 3 年。(2)03 方案在 99 方案 基础上进行调整:将 Pred 改为地塞米松(DXM); 增加“VDLD”方案再诱导次数,每半年 1 次;进 行“CAT”方案定期强化,每年 1 次;维持治疗采 用“MM+VD”(MTX+6-MP+VCR+DXM) 方 案。 同时 HR 组患儿加大 MTX 剂量(每次 5g/m 2), 并在早期CAT 方案中应用中剂量Ara-C(每次 1g/m 2 ,q12h,共 3d)强化。 1.4 随访
随访时间截止至 2013 年 10 月,随访中位时 间为 82 个月(1~177 个月);318 例患儿中,失 访 13 例,占 4.1%。总体生存(OS)期为患儿开 始治疗至死亡或末次随访时间;EFS 期为自诊断到 第 1 次事故或末次随访时间;事故评估包括:未 达缓解(早期死亡或白血病耐药)、复发、在持 续完全缓解(CCR)期间的死亡和发生第二肿瘤。 1.5 统计学分析
采用 SPSS17.0 统计软件对数据进行统计学分 析,符合正态分布的数据采用均数±标准差(x±s) 表示;计数资料以百分率(%)表示,组间比较采 用卡方检验。采用 Kaplan-Meier 方法评估患儿的 OS 率和 EFS 率,组间患儿 OS 率和 EFS 率差异比 较用 log-rank 检验。生存分析应用 Kaplan-Meier 法 绘制生存曲线,P<0.05 为差异有统计学意义。 2 结果 2.1 不同治疗方案诱导治疗疗效的比较
318 例患儿诱导治疗采用 VDLP(D)方案, 其中 313 例患儿达 CR,CR 率为 98.4%。99 方案 治疗组 CR 率为 96.4%(80/83);03 方案治疗组 CR 率为 99.1%(233/235),两组 CR 率差异无统 计学意义(P<0.05)。 2.2 不同治疗方案患儿中长期疗效的比较
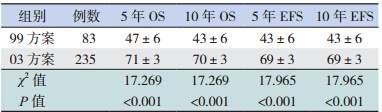
318例患儿的中长期疗效统计分析结果 显 示,5、10 年 OS 率 分 别 为 64.5%±2.7% 和 62.5%±2.8%,EFS 率均为 61.8%±2.8%。03 方案 治疗组 5、10 年 OS 率和 EFS 率均高于 99 方案治 疗组(均P<0.001),见表 1,图 1~2。
| 表 1 不同治疗方案患儿中长期疗效的比较(x±s,%) |
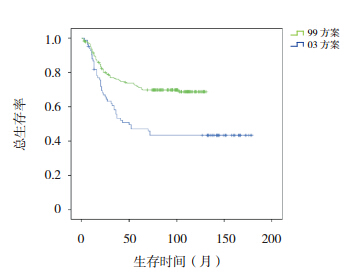 |
图 1 不同方案治疗组总生存曲线 |
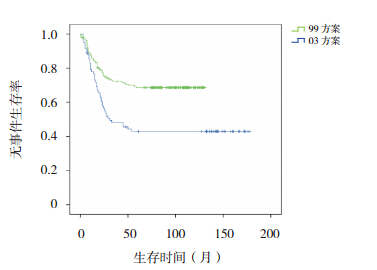 |
图 2 不同方案治疗组无事件生存曲线 |
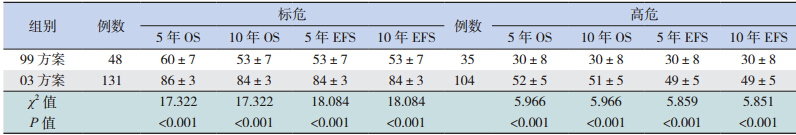
按危险度分型采用不同治疗方案进行治疗, 随访疗效显示,SR 和 HR 患儿采用 03 方案治疗, 其 5、10 年 OS 率和 EFS 率均显著高于 99 方案治 疗组(均P<0.001),见表 2,图 3,4,5,6。
| 表 2 不同危险度分型患儿在不同治疗方案下中长期疗效的比较(x±s,%) |
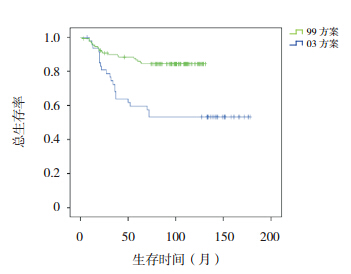 |
图 3 不同方案治疗标危组患儿总生存曲线 |
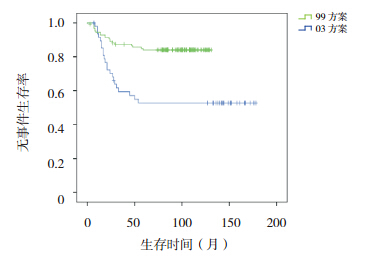 |
图 4 不同方案治疗标危组患儿无事件生存曲线 |
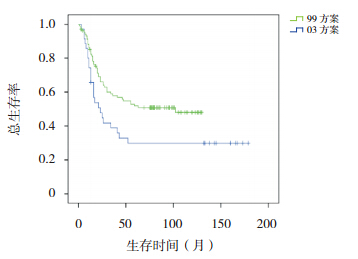 |
图 5 不同方案治疗高危组患儿总生存曲线 |
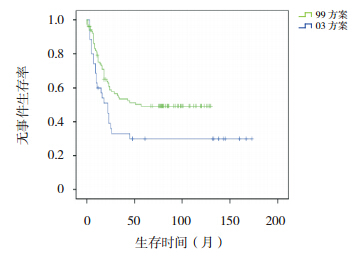 |
图 6 不同方案治疗高危组患儿无事件生存曲线 |
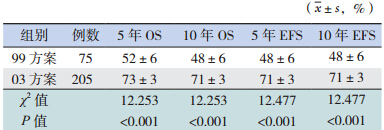
按免疫分型采用不同治疗方案进行治疗,随 访疗效显示,B-ALL 患儿采用 03 方案治疗后,5、 10 年 OS 率和 EFS 率均显著高于 99 方案治疗组(均 P<0.001)(表 3);99 方案治疗组无长期生存 T-ALL 患儿,03 方案组 T-ALL患儿5年OS率和EFS率 分别为 57%±9% 和 54%±9%。
| 表 3 B-ALL 患儿在不同治疗方案下中长期疗效的比较 |
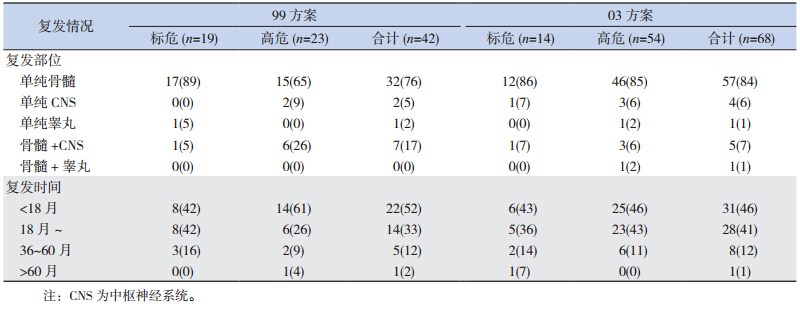
99 方案治疗组共 83 例患儿,复发 42 例,复 发率为 50.6%,复发中位时间为 17.0 个月,其中 85.7% 的患儿在 36 个月内复发,复发部位主要发 生在骨髓(表 4)。8 例 T-ALL 患儿中6 例获得 CR,但均复发,复发中位时间为 11 个月,所有复 发患儿均放弃治疗后死亡。
03 方案治疗组共 235 例患儿,复发 68 例,复 发率为 28.9%,复发中位时间为 18.1 个月,其中 86.8% 的患儿在 36 个月内复发,复发部位主要发 生在骨髓(表 4)。30 例 T-ALL 患儿中 29 例获得 CR,11 例复发,复发中位时间为 12 个月,复发 患儿中 7 例放弃治疗后死亡,4 例接受 VDLD 再诱 导治疗,其中 3 例获得第 2 次完全缓解(CR2), 1 例感染死亡;获得 CR2 的 3 例患儿中 1 例行造 血干细胞移植后获得长期生存,1 例再次复发死亡, 1 例失访。
| 表 4 复发患儿复发部位与时间一览表[例(%)] |
318例患儿中,死亡114例,病死率为 35.8%。99方案治疗组死亡47例,病死率为 56.6%,03方案治疗组死亡67例,病死率为 28.5%,与 99 方案治疗组比较差异有统计学意义 (P<0.05)。死亡情况分析显示复发为导致患儿死 亡的主要原因,见表 5。
| 表 5 患儿死亡情况一览表[例(%)] |
4 例因发生心力衰竭导致死亡的患儿均为 99 方案治疗组患儿,分别发生于治疗后3 个月、 12 个月、27 个月和 31 个月。4 例患儿在治疗中 应用蒽环类抗生素的平均累计剂量为:柔红霉素 337.75mg/m 2 ,米托蒽醌 24.5mg/m 2。03 方案中无 因心力衰竭死亡的患儿。 2.7 患儿远期生存质量分析
长期生存患儿中仅 1 例患儿诊断为丙型肝炎 病毒携带者,转氨酶正常,能正常生活与学习。至 随访时未发现第二肿瘤发生者,无身材矮小、智力 低下者,无内分泌功能障碍者,生存质量均良好。 3 讨论
ALL 是儿童最常见的恶性肿瘤,15 岁以下儿 童急性白血病中约 80% 为 ALL[5,6]。随着治疗方案 的不断优化,儿童 ALL 治愈率不断提高,目前国 际先进治疗组 5 年 OS 率可达 90%[1,7],但治疗失败 仍是导致儿童死亡的一个主要原因。本研究回顾 性分析我院初诊儿童 ALL 的长期疗效,对进一步 改进治疗方案,提高长期生存率极为重要。 本治疗组 318 例初诊儿童 ALL 的发病高峰年 龄、性别比例、免疫学分型等生物学特征与欧美 报道接近[8,9]。99 方案治疗组远期疗效显示 10 年 EFS 仅为 43%。03 方案治疗组 10 年 EFS 为 69%, SR 组和 HR 组 10 年 EFS 分别为 84% 和 49%,均 明显高于 99 方案组。
既往 T-ALL 疗效较差,张艳兰等 [10] 报道 26 例T-ALL患儿,3年EFS率中、高危组分别为 51.7 %和 22.4 %,其中 8 例(30.8 %)复发,CR 至复发时间为 9.78~3.48 个月,明显短于 B-ALL。 近年来,治疗方案的优化,T-ALL 的疗效有了较大 提高。Silverman 等[11] 总结了 DFCIALL 治疗组 20 年T-ALL 的疗效,10 年 EFS 达 79%~85%。国内 有研究报道采用 ALL-XH-99 方案治疗的 T-ALL 患 儿,8 年 EFS 为 40.2%,调整方案后的 ALL-2005 方案,5 年 EFS 提高到 73.5%,分析与降低了因化 疗强度较大而导致的治疗相关并发症,同时治疗 依从性提高有关[12,13]。本研究 99 方案治疗的 8 例 T-ALL 无长期生存者;03 方案治疗 30 例 T-ALL 患 儿,5 年 EFS 率为 54%,疗效明显优于 99 方案, 分析原因与 03 方案采用高危方案治疗,早期应用 中剂量 Ara-C 有关。
研究报道 ALL 患儿约有 15%~20% 复发[14], 其中 T-ALL 早期复发率高,占复发患儿 15% [15,16], 复发后 3~5 年 OS 率仅为 7%~23%[17]。本研究中 T-ALL 复发患儿占总复发患儿的 17.3%,复发中位 时间 12 个月。03 方案 T-ALL 复发率较 99 方案明 显减低,但复发后患儿大多放弃治疗而死亡。本 研究分析发现 03 方案 HR 组患儿髓外复发率低于 99 方案治疗组,提示增加 MTX(5g/m 2)剂量及 采用中剂量 Ara-C 可减低 HR 患儿髓外复发风险, 并能有效减低 T-ALL 患儿的复发。虽然有研究认 为用鞘内注射代替颅脑照射可能增加全身复发的 危险[18,19],本研究未能证实该结论,但本研究认 为三联鞘注预防中枢神经系统白血病的同时,加 强全身化疗,可取得较好疗效。
治疗相关死亡是治疗失败的另一个主要原因, 多发生在诱导治疗阶段,因此减低诱导治疗时期 病死率是进一步提高生存率的关键。
随着治愈率的提高,长期生存患儿的生存质 量备受关注[20]。其中心脏毒性是最主要的,多是 蒽环类化疗药物引起。本研究中 4 例发生心力衰 竭的患儿,均发生在 99 方案治疗组,考虑可能与 蒽环类药物应用累积剂量较多相关。定期检查心 脏功能,及时发现心脏功能异常,并且在不减低 疗效的基础上减少蒽环类药物的累积用量可减少 心力衰竭的发生[21]。
本研究对 318 例儿童 ALL进行的疗效分析结 果显示 03 方案在 HR 组加用中剂量 Ara-C,MTX 量加至 5g/m 2,以及支持治疗的加强,家属对疾病 认识的提高,依从性增强,使治愈率较 99 方案明 显提高,复发率减低,但较国际先进治疗组仍有 差距[22,23,24]。因此需要在目前基础上进一步优化治 疗策略,进行前瞻性随机对照研究,以尽快达到 和超过国际水平。由于长期生存者的逐渐增多, 加强远期并发症的观察是亟待关注和解决的问题。
| [1] | Pui CH, Mullighan CG, Evans WE, et al. Pediatric acutelymphoblastic leukemia: where are we going and how do we getthere? [J]. Blood, 2012, 120(6): 1165-1174. |
| [2] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3 版. 北京:科学出版社, 2007: 19-23. |
| [3] | 陈晓娟, 张丽, 刘天峰, 等. 225 例儿童急性淋巴细胞白血病临床疗效的回顾性分析[J]. 中华血液学杂志, 2008, 29(12):824-827. |
| [4] | 陈晓娟, 张丽, 刘天峰, 等. 中剂量阿糖胞苷治疗儿童急性淋巴细胞白血病[J]. 实用儿科临床杂志, 2009, 24(3): 225-226, 231. |
| [5] | McCredie M, Williams S, Coates M. Cancer mortality inmigrants from the British Isles and continental Europe to NewSouth Wales, Australia, 1975-1995[J]. Int J Cancer, 1999, 83(2):179-185. |
| [6] | Yeoh AE, Tan D, Li CK, et al. Management of adult andpaediatric acute lymphoblastic leukaemia in Asia: resourcestratifiedguidelines from the Asian Oncology Summit 2013[J].Lancet Oncol, 2013, 14(12): e508-e523. |
| [7] | Pui CH, Carroll WL, Meshinchi S, et al. Biology, riskstratification and therapy of pediatric leukemias: an update[J]. JClin Oncol, 2011, 29(5): 551-565. |
| [8] | Crist W, Boyett J, Pullen J, et al. Clinical and biologic featurespredict poor prognosis in acute lymphoid leukemias in childrenand adolescents: a Pediatric Oncology Group review[J]. MedPediatr Oncol, 1986, 14(3): 135-139. |
| [9] | Taskov H, Dimitrova E, Serbinova M, et al. Immunologicalsubtypes of childhood acute lymphoblastic leukemia inBulgaria[J]. Leuk Res, 1995, 19(11): 877-881. |
| [10] | 张艳兰, 赵文理, 聂述山, 等. 儿童T 系急性淋巴细胞白血病的临床特点及预后分析[J]. 中国实验血液学杂志, 2011,6(19): 1496-1500. |
| [11] | Silverman LB, Stevenson KE, O'Brien JE, et al. Long-termresults of Dana-Farber Cancer Institute ALL Consortiumprotocols for children with newly diagnosed acute lymphoblasticleukemia (1985-2000) [J]. Leukemia, 2010, 24(2): 320-334. |
| [12] | 顾龙君, 李娟, 薛惠良, 等. ALL-XH-99 方案治疗儿童急性淋巴细胞白血病158 例疗效分析[J]. 中华血液学杂志, 2004,25(1): 1-4. |
| [13] | 周敏, 顾龙君, 汤静燕, 等. ALL-2005 方案治疗儿童T 系急性淋巴细胞白血病35 例疗效[J]. 中国小儿与血液肿瘤杂志,2012, 17(5): 224-227. |
| [14] | Locatelli F, Schrappe M, Bernardo ME, et al. How I treatrelapsed childhood acute lymphoblastic leukemia[J]. Blood,2012, 120(14): 2807-2816. |
| [15] | Pui CH, Boyett JM, Ruvera GK, et al. Long-term results ofTotal Therapy studies 11, 12 and 13A for childhood acutelymphoblastic leukemia at St Jude Children's ResearchHospital[J]. Leukemia, 2000, 14(12): 2286-2294. |
| [16] | Schrappe M, Reiter A, Zimmermann M, et al. Long-term resultsof four consecutive trials in childhood ALL performed by theALL-BFM study group from 1981 to 1995[J]. Leukemia, 2000,14(12): 2205-2222. |
| [17] | Nguyen K, Devidas M, Cheng SC, et al. Factors infl uencingsurvival after relapse from acute lymphoblastic leukemia: aChildren's Oncology Group study[J]. Leukemia, 2008, 22(12):2142-2150. |
| [18] | Mitchell CD, Richards SM, Kinsey SE, et al. Benefit ofdexamethasone compared with prednisolone for childhood acutelymphoblastic leukaemia: results of the UK Medical ResearchCouncil ALL97 randomized trial[J]. Br J Haematol, 2005,129(6): 734-745. |
| [19] | Pinkel D. Treatment of acute lymphoblastic leukemia in asecond remission[J]. N Engl J Med, 1995, 332(12): 823-824. |
| [20] | Vora A, Goulden N, Wade R, et al. Treatment reduction forchildren and young adults with low-risk acute lymphoblasticleukaemia defined by minimal residual disease: a randomisedcontrolled trial[J]. Lancet Oncol, 2013, 14(3): 199-209. |
| [21] | 陈波, 宪莹, 苏庸春, 等. CCLG-ALL 08 方案治疗儿童急性淋巴细胞白血病毒副作用的临床研究[J]. 中国当代儿科杂志, 2013, 15(9): 737-742. |
| [22] | Pui CH, Campana D, Pei D, et al. Treating childhood acutelymphoblastic leukemia without cranial irradiation[J]. N Engl JMed, 2009, 360(26): 2730-2741. |
| [23] | Hunger SP, Lu X, Devidas M, et al. Improved survival forchildren and adolescents with acute lymphoblastic leukemiabetween 1990 and 2005: a report from the Children's OncologyGroup[J]. J Clin Oncol, 2012, 30(14): 1663-1669. |
| [24] | Vrooman LM, Stevenson KE, Supko JG, et al. Postinductiondexamethasone and individualized dosing of EscherichiaColi L-asparaginase each improve outcome of childrenand adolescents with newly diagnosed acute lymphoblasticleukemia: results from a randomized study--Dana-Farber CancerInstitute ALL Consortium Protocol 00-01[J]. J Clin Oncol, 2013,31(9): 1202-1210. |
 2014, Vol. 16
2014, Vol. 16