新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是指各种围产期窒息引起的 部分或完全缺氧、脑血流减少或暂停所致的新生 儿脑损伤,是引起新生儿死亡及神经系统发育障 碍的主要原因[1]。临床研究发现 HIE 可使儿童在 学龄期或青春期出现一系列的行为认知障碍[2],其 中行为障碍分为记忆缺失及多动行为改变,后者 包括焦虑冲动行为 / 焦虑样行为改变[3],动物研究 已证实初生时缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)可导致大鼠在青春期的焦虑 样多动行为能力低于正常大鼠[4]。
多巴胺(dopamine, DA)是中枢神经系统的 一种重要神经递质,主要存在于黑质(substantia nigra, SN)和纹状体中,酪氨酸羟化酶(tyroxine hydroxylase, TH)是 DA 合成中关键性的限速酶, TH 的表达可以反映多巴胺能神经元的功能 [5]。有 研究显示大鼠的多动样行为改变与 SN 中的 DA 水 平的异常相关联[6]。本课题前期研究表明 HIBD 可 导致新生 Sprague-Dawley(SD)大鼠在 14~28 d 期 间 TH 在 SN 的表达减少[7],但对于 HIBD 后大鼠 青春期焦虑样行为改变是否与 DA 水平的改变存在 关联尚无证据。本研究应用新生大鼠 HIBD 模型, 观察 HIBD 大鼠远期焦虑行为的变化,并通过 DA 受体拮抗剂的干预来探讨 DA 水平的改变对 HIBD 大鼠远期焦虑行为的影响和相关可能机制。 1 材料与方法 1.1 建立新生大鼠 HIBD 模型
健康新生 7 日龄(P7)清洁级 SD 大鼠 120 只, 体重 10~16 g,由中南大学湘雅三医院动物实验部 提供。随机分为正常对照组、假手术组、HIBD 组、 HIBD+DA 受体拮抗剂组 4 组。每组按出生后第 14 天(P14)、第 21 天(P21)和第 28 天(P28)分 为 3 个亚组(n=10)。按照 Rice 法制作 HIBD 模 型,即右侧颈总动脉分离结扎后,置于 8% 氧气和 92% 氮气的混合气体中 2 h;假手术组仅给于右侧 颈总动脉分离,不予结扎和低氧处理;HIBD+DA 受体拮抗剂组在模型制作前 20 min 给予腹腔注 射 D1 受 体 拮 抗 剂 SCH23390(0.5 mg/kg,美 国 Sigama)及 D2 受体拮抗剂 sulpiride(30 mg/kg ,美 国 Sigama),并在制作 HIBD 模型后的 3 h 内,每 小时给予 1 次 SCH23390(0.2 mg/kg)及 sulpiride (3.3 mg/kg)腹腔注射;正常对照组、假手术组及 HIBD 组腹腔注射等量的无菌生理盐水。 1.2 高架十字迷宫实验测定大鼠焦虑行为
分别于 P14、P21 及 P28 对各组采用高架十字 迷宫(elevated plus-maze, EPM)实验进行焦虑行 为测定,EPM 包括两条 50 cm×10 cm×10 cm 相对 开放臂和两条 50 cm×10 cm×40 cm 相对闭合臂, 中央由 10 cm×10 cm 的区域连接,十字迷宫距离 地面 50 cm。测试时室内暗光(以 1.5 m 距离处能 区分大鼠细微活动的最低亮度为准)并保持恒亮, 室温 20℃左右,保持安静。将大鼠从中央区面向 开放臂放入迷宫,观察记录 5 min 内大鼠的活动情 况,指标包括:(1)开放臂进入次数(open arm entry, OE):进入到任一开放臂的次数,以大鼠 4 个爪子均进入到臂内为准,中途一个爪子从该臂 中完全退出则为该次进入活动完成;(2)闭合臂 进入次数(close arm entry, CE):进入到任一闭合 臂的次数,以大鼠 4 个爪子均进入到臂内为准, 中途一个爪子从该臂中完全退出则为该次进入活 动完成;(3)总次数:开放臂和闭合臂的次数之 和(OE+CE),表示大鼠的运动活力;(4)开放 臂停留时间(open arm time, OT):进入开放臂的 时间;(5)开放臂次数比率(OE%)= OE/ 总次 数 ×100%。每只大鼠测试完毕后用湿布将粪便及 尿液清除,然后再分别用酒精及干布擦拭干净。 1.3 免疫组织化学测定大鼠黑质
TH 的表达 实验动物分别于 P14、P21、P28 经麻醉、心 脏灌注、断头取脑,脑组织固定、脱水、包埋后, 从脑冠状切面自额叶进行连续切片,切至黑质部 位,切片厚度为 5 µm,每只大鼠取 5 张切片。石 蜡切片经脱蜡、水化及抗原修复后,经 3% 过氧化 氢室温去除内源性过氧化物酶,封闭缓冲液(10% 马血清 +0.2% Triton)封闭,一抗(1 : 500 小鼠抗 大鼠 TH 单克隆抗体,美国 Chemicon)、二抗(1 : 400 马 抗 小 鼠 IgG 抗 体,美 国 Vector) 及 ABC 试 剂 (1 : 200,美国 Vector)孵育后,予 DAB 显色剂显 色,镜下控制反应时间后予常规脱水、透明及封 片。用 Image Pro Plus 图像分析软件(美国 Media Cybernetics)分析得出积分光密度(integral optical density, IOD)及测量面积区域(area),再算出平 均光密度(平均光密度 = IOD/area)进行定量分析, 每张切片随机取 3 个视野后取平均值。 1.4 统计学分析
采用 SPSS 18.0 统计软件对数据进行统计学分 析。正态分布的数据以均数 ± 标准差(x±s)表示, 多组间比较采用单因素方差分析,组间两两比较 采用 LSD-t检验。偏态分布数据采用 Kruskal walls test 多重比较秩和检验,组间两两比较采用 Mann Whitney U检验。P<0.05 为差异有统计学意义。 2 结果 2.1 EPM 测定结果
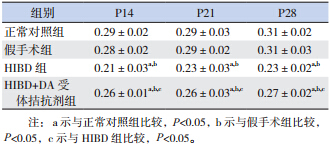
P14时各组间OT 比较差异无统计学意义 (χ 2=4.84,P=0.19);P21 时各组间 OT 比较差异 有统计学意义(χ 2=8.25,P=0.04),其中 HIBD 组 OT 较正常对照组(Z=-2.12,P=0.03)、假手术 组(Z=-2.42,P=0.02)及 HIBD+DA 受体拮抗剂 组(Z=-2.04,P=0.04)增高,余组间差异无统计 学意义;P28 时各组间 OT 比较差异有统计学意义 (χ 2=18.83,P<0.01),其 中 HIBD 组 OT 较 正 常 对照组(Z=-3.70,P<0.01)、假手术组(Z=-3.33, P<0.01)及 HIBD+DA 受体拮抗剂组(Z=-2.04, P=0.04)增高,HIBD+DA 受体拮抗剂组较正常对 照组增高(Z=-2.08,P=0.04),余组间差异无统 计学意义。见图 1。
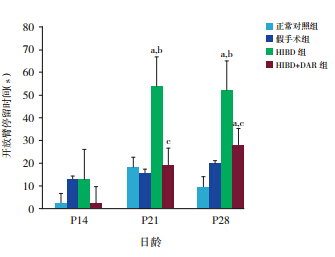 |
图 1 不同日龄各组开放臂停留时间比较(n=10) a 示与对照组比较,P<0.05;b 示与假手术组比较,P<0.05;c 示 与 HIBD 组比较;P<0.05。 |
P14 时各组间 OE% 比较差异无统计学意义 (χ 2=4.14,P=0.25);P21 时各组间 OE% 比较差 异有统计学意义(χ 2=11.65,P=0.01),其中 HIBD 组 OE% 较正常对照组(Z=-2.03,P=0.04)、假手 术组(Z=-2.71,P<0.01)及 HIBD+DA 受体拮抗 剂组(Z=-2.79,P<0.01)增高,余组间差异无统 计学意义;P28 时各组间 OE% 比较差异有统计学 意义(χ 2=16.31,P<0.01),其中 HIBD 组 OE% 较 正常对照组(Z=-3.36,P<0.01)、假手术组(Z=-6.61, P<0.01)及 HIBD+DA 受体拮抗剂组(Z=-2.55, P=0.01)增高,余组间差异无统计学意义。见图 2。
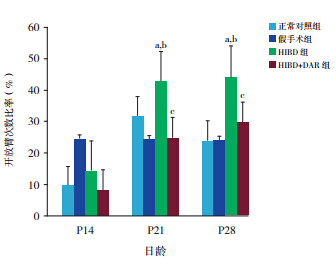 |
图 2 不同日龄各组开放臂次数比率比较(n=10) a 示与正常对照组比较,P<0.05;b 示与假手术组比较,P<0.05; c 示与 HIBD 组比较,P<0.05。 |
P14(χ 2=5.73,P=0.12)、P21(χ 2=1.17, P=0.75)及 P28(χ 2=4.72,P=0.19)时各组间总次 数比较差异均无统计学意义,见图 3。
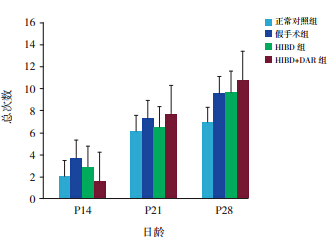 |
图 3 不同日龄各组总次数比较(n=10) |
各组 P14、P21、P28 黑质 TH 平均光密度比 较差异均有统计学意义(F=18.84、11.39、15.20, 均P<0.01),其中 HIBD 组及 HIBD+DA 受体拮抗 剂组在各时间点 TH 水平均低于正常对照组及假 手术组,且 HIBD 组低于 HIBD+DA 受体拮抗剂组 (P<0.05),见表 1,图 4。
| 表 1 各组黑质 TH 水平比较 (x±s,n=10) |
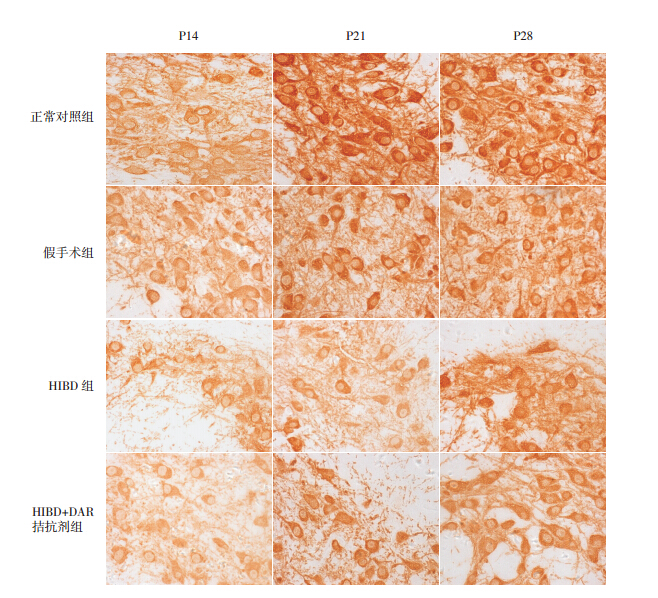 |
图 4 各组各时间点黑质 TH 免疫组化染色(DAB 显色,×400) TH 阳性反应物分布在细胞质,染色呈棕黄色。 HIBD 组在 P14、P21、P28 时的黑质 TH 染色细胞数量较正常对照组及假手术组减少,HIBD+DA 受体拮抗剂组在 P14、P21、 P28 时的黑质 TH 染色细胞数量较 HIBD 组有所增加,但仍低于正常对照组及假手术组。 |
EPM 是众多焦虑动物模型评价中较为成熟的 经典方法,其原理是利用大鼠对未知新环境喜好 探究的特性,当其处于高悬开臂后又会形成恐惧 的心理,造成矛盾的心理应激,模拟焦虑样症状。 大鼠对高悬而空旷的开放臂的选择偏好与其焦虑 程度呈负相关,即在开放臂的时间延长、次数增 多提示大鼠焦虑程度降低。抗焦虑药物能抑制开 放臂的回避,增加开放臂的次数和时间,而总次 数可以反映动物的运动活性。7 日龄 SD 大鼠脑组 织结构与 32~34 孕周龄的人脑类似[8] ,21~28 d SD 大鼠则接近成年期,因此 14~28 d 常被用于研究 SD 大鼠动物的青春期行为问题 [9]。本研究通过对 7 日龄新生 SD 大鼠进行 HIBD 造模,在 P14、P21 及 P28 观察其焦虑行为,结果显示 P14 时各组比 较各指标均无统计学差异,而 P21 及 P28 时 HIBD 组的 OT 及 OE%较正常对照组和假手术组增加, 提示新生期的 HIBD 能使大鼠的青春期焦虑行为降 低。P14 时各组指标比较差异无统计学意义,主要 原因是大鼠的活力较弱,不能进行有效的来回活 动所致。在 P21 及 P28 时各组的总活力无统计学 差异,可排除了 HIBD 组的焦虑行为降低是由于 其活动力减弱所造成的。在 HIBD 造模前及造模中 腹腔注射 D1 及 D2 受体拮抗剂后,结果示使用了 DA 受体拮抗剂后的 SD 大鼠在 P21 及 P28 的 OT 及 OE% 较 HIBD 组减少,提示了 DA 受体拮抗剂 能改善 HIBD 损伤后 SD 大鼠青春期的焦虑样行为。
DA 是儿茶酚胺类神经递质,TH 是合成多巴 胺的限速酶,抑制或提高该酶的活性可大幅度影 响 DA 的合成,TH 的免疫组织化学常被用于显示 DA 能神经元的胞体和突触 [10]。中脑黑质是 DA 能 神经元较为集中的区域[11] 。本研究结果显示 HIBD 组的黑质 TH 表达较正常对照组及假手术组减少, 提示 HIBD 能导致多巴胺神经元的减少,使用了 DA 受体拮抗剂后的 SD 大鼠在 P14、P21 及 P28 均 比 HIBD 组表达的高,但低于正常对照组和假手术 组,显示了 DA 受体拮抗剂能减轻 HIBD 对脑神经 元的损伤。
有研究表明黑质纹状体处的 DA 能神经元对 脑缺氧缺血表现出易感性[9],在脑缺血模型中摧毁 单侧的 DA 能神经元黑质通路后纹状体坏死体积明 显减少。细胞外 DA 主要通过其受体发挥作用,根 据其生化和药理性质,可分为 D1 类受体和 D2 类 受体,D1 类受体包括 D1 和 D5 受体,D2 类受体 包括 D2、D3 和 D4 受体[12]。大量实验数据证明了 D1 受体拮抗剂 SCH23390 具有抗脑缺血的损伤作 用,其机制主要为脑缺氧缺血时细胞外液大量的 DA 通过突触后膜 D1 受体激活了 cAMP 瀑布反应, 最终导致细胞内钙超载,使神经元损伤。赵菁等[13] 研究表明了 D2 受体介导了脑缺血时多巴胺的神经 毒性作用,而使用 D2 受体拮抗剂具有神经保护作 用。本研究在 HIBD 前使用 D1 和 D2 受体拮抗剂, 阻断 DA 与其受体发生作用,结果表明了 DA 受体 拮抗剂具有神经保护作用,其机制可能为 DA 受体 拮抗剂阻断了受体介导的钙超载,减轻缺氧缺血 性损伤,降低神经功能的受损程度。
目前 D1 及 D2 受体对焦虑行为的影响还未明 确[14,15]。本研究发现 HIBD+DA 受体拮抗剂组比 HIBD 组在其青春期的焦虑行为有所增加,提示多 巴胺水平的变化与 HIBD 对青春期焦虑行为的改变 有关,其可能机制为在新生期时应用 DAR 拮抗剂 能减轻 HIBD 对 DA 能神经元的损伤作用,DA 能 神经元损伤较 HIBD 组轻,使其在青春期释放的 DA 较 HIBD 组多,因 DA 的释放的增加与焦虑行 为有关,导致该组在 HIBD 对青春期焦虑行为恢复 到正常水平。
综合以上所得,HIBD 后大鼠青春期焦虑样行 为的变化与多巴胺能神经元损伤有关,初生时给 予 DA 受体拮抗剂能改善 HIDB 对青春期焦虑样行 为的异常作用,提示多巴胺水平的变化与 HIBD 对 青春期焦虑行为的改变有关,但具体相关机制尚 不清楚,需进一步研究为 HIE 的治疗提供一定的 实验室依据。
| [1] | Volpe JJ. Neonatal encephalopathy: an inadequate term forhypoxic–ischemic encephalopathy[J]. Ann Neurol, 2012, 72(2):156-166. |
| [2] | Odd DE, Whitelaw A, Gunnell D, et al. The association betweenbirth condition and neuropsychological functioning andeducational attainment at school age: a cohort study[J]. Arch DisChild, 2011, 96(1): 30-37. |
| [3] | Nyakas C, Buwalda B, Luiten PG. Hypoxia and braindevelopment[J]. Prog Neurobiol, 1996, 49(1): 1-51. |
| [4] | Hei MY, Luo YL, Zhang XC. Hypoxic-ischemic injurydecreases anxiety-like behaviour in rats associated with loss oftyrosin hydroxyalse immunoreactive neurons of the substantianigra[J]. Braz J Med Biol Res, 2012, 41(1): 13-19. |
| [5] | Busceti CL, Bucci D, Molinaro G, et al. Lack or inhibition ofdopaminergic stimulation induces a development increase ofstriatal tyrosine hydroxylase-positive interneurons[J]. PLoSOne, 2012, 7(9): e44025. |
| [6] | Golden JP, DeMaro JA, Knoten A, et al. Dopamine-dependentcompensation maintains motor behavior in mice withdevelopmental ablation of dopaminergic neurons[J]. J Neurosci,2013, 33(43): 17095-17107. |
| [7] | 汤琴, 刘芙蓉, 罗娅丽, 等. 胰岛素样生长因子-1 对缺氧缺血性脑损伤大鼠远期焦虑行为的影响[J]. 中国当代儿科杂志, 2014, 16(3): 295-300. |
| [8] | Vannucci RC, Connor JR, Mauger DT, et al. Rat model ofperinatal hypoxic-ischemic brain damage[J]. J Neurosci Res,1999, 55(2): 158-163. |
| [9] | Fan LW, Lin S, Pang Y, et al. Hypoxia-ischemia inducedneurological dysfunction and brain injury in the neonatal rat[J].Behav Brain Res, 2005, 165(1): 80-90. |
| [10] | Pagida MA, Konstantinidou AE, Tsekoura E, et al.Vulnerability of the mesencephalic dopaminergic neuronsof the human neonate to prolonged perinatal hypoxia: animmunohistochemical study of tyrosine hydroxylase expressionin autopsy material[J]. J Neuropathol Exp Neurol, 2013, 72(4):337-350. |
| [11] | Aumann TD, Egan K, Lim J, et al. Neuronal activity regulatesexpression of tyrosine hydroxylase in adult mouse substantianigra pars compacta neurons[J]. J Neurochem, 2011, 116(4):646-658. |
| [12] | Chun LS, Free RB, Doyle TB, et al. D1-D2 dopamine receptorsynergy promotes calcium signaling via multiple mechanisms[J].Mol Parmacol, 2013, 84(2): 190-200. |
| [13] | 赵菁, 徐超, 王忠诚. 多巴胺D2、D3 受体在大鼠暂时性局灶性脑缺血中的作用[J]. 中华神经外科杂志, 2002, 18(3):160-163. |
| [14] | Hou I, Suzuki C, Kanegawa N, et al. β-Lactotensin derivedfrom bovine β-lactoglobulin exhibits anxiolytic-like activityas an agonist for neurotensin NTS2 receptor via activation ofdopamine D1 receptor in mice[J]. J Nurochem, 2011, 119(4):785-790. |
| [15] | de la Perez Mora M, Jacobsen KX, Crespo-Ramirez M, et al.Wiring and volume transmission in rat amygdala. Implicationsfor fear and anxiety[J]. Neurochem Res, 2008, 33(8): 1618-1633. |
 2014, Vol. 16
2014, Vol. 16