2. 河北省邯郸市妇幼保健院新生儿科, 河北 邯郸 056001;
3. 河北省人民医院内分泌科, 河北 石家庄 050051
宫内生长受限(intrauterine growth retardation, IUGR)易发生营养程序化,影响生后能量代谢及 体格生长[1]。部分由下丘脑神经元所分泌的神经肽 如神经肽 Y(neuropeptidey, NYP),阿片促黑色素 原(proopiomelnacortin, POMC)等在摄食和能量平 衡的调节中发挥着十分重要的作用。Nesfatin-1是 由核组蛋白 2(nucleobindin2, NUCB2)编码的脑肠 肽,与 ghrelin 均是近年来在大鼠中枢及外周发现 的脑肠肽,具有调节摄食及能量代谢等神经内分 泌作用[2,3]。本课题组既往研究发现,在 IUGR 新 生儿生后早期血浆 nesfatin-1 与 ghrelin 水平均较高, 且与能量代谢及追赶生长有关[4,5]。国外学者研究 发现 SD 大鼠生后第 1 天血清 nesfatin-1/NUCB2 水 平低于成年大鼠,随日龄增长于生后 13 d、20 d、 27 d 逐渐增高 [6]。但它们在 IUGR 患儿中枢及外周 组织的作用以及两者之间的关系目前在国内外未 见报道。
本 研 究 应 用 实 时 荧 光 定 量 PCR(real timePCR) 技 术 及 Western-blot 法 测 定 IUGR 的 SD 大鼠在生后不同日龄及追赶生长情况下胃黏膜 的 nesfatin-1/NUCB2、ghrelin mRNA 及 蛋 白 的 表 达,探讨不同生长情况下IUGR 大鼠外周组织 nesfatin-1/NUCB2、ghrelin 的表达变化及其与生长 的关系。 1 材料与方法 1.1 动物模型的建立
根据文献报道[7],采用母鼠妊娠期低蛋白饮 食法,使其自然分娩建立 IUGR 新生大鼠模型。 选取 2 月龄清洁级的未曾交配的成年雌性 SD 大鼠 24 只与雄性 SD 大鼠 12 只(购于河北医科大学实 验动物中心),体重 200~250 g。适应性喂养 1 周 后,随机选择雌雄大鼠按 2 : 1 比例合笼,次日母 鼠阴道涂片找到精子为受孕第 1 天。限食母鼠(怀 孕期间限制蛋白进食,饲料中蛋白含量占 8%)所 生新生鼠出生体重和(或)身长小于正常对照组 新生鼠 2 个标准差者纳入实验组(IUGR 组,R 组); 同时设自由进食的母鼠(任意摄取标准鼠食,蛋 白含量为 20%)自然分娩后的新生鼠为对照组(C 组)。为防止胎数不均对仔鼠出生体重及生后摄 食等的影响,凡妊娠成活胎仔鼠数不足 5 只或超 过 10 只者,均弃去。
所有仔鼠出生后均由原母鼠母乳喂养,C 组 仔鼠的母鼠分娩后仍自由进食,仔鼠作为对照组 (CC 组,40 只);R 组仔鼠分为 2 组:1 组为母 鼠分娩后改为自由进食(RC 组,追赶生长组, 40 只),1 组母鼠分娩后继续限食(RR 组,无追 赶生长组,40 只),每周测体重、身长(鼻肛长)。 所有仔鼠 21 d 断乳,给予常规饲料自由进食至生 后 28 d。 1.2 标本留取
RR 组、RC 组及 CC 组仔鼠分别于生后 0 d、 12 d、21 d、28 d(各 10 只)禁食 12 h,10% 水合 氯醛(3 mL/kg)麻醉成功后开腹,腹主动脉取血 并处死,于无菌冰块上迅速分离出胃,沿胃大弯 剪开,剪取胃体部组织 30~50 mg,立即剪碎,无 菌密封,置于液氮罐中速冻,后移至 -70℃深冻冰 箱保存。 1.3 提取RNA及实时荧光定量RT-PCR 法测 nesfatin-1/NUCB2、ghrelin mRNA 的表达
在无RNA酶的环境下制备组织匀浆, 并加入变性液经酸酚- 氯仿将RNA抽提至水 相,与DNA和蛋白质分离,经异丙醇沉淀回 收总RNA,经RNA的纯度及完整性检测,表 明提取的 RNA 蛋白污染很少,进行反转录(试 剂 盒 : Promega,USA)。PCR 扩 增,GAPDH 为内参基因,扩增片段长度120 bp,上游引物:5'-TGAACGGGAAGCTCACTGG-3',下游 引 物:5'-GCTTCACCACCTTCTTGATGTC-3';Ghrelin 扩 增 片 段 长 度 136 bp,上 游 引 物:5'-GCCCAGCAGAGAAAGGAAT-3',下游引 物:5'-AGGGAGCATTGAACCTGATT-3';Nesfatin-1扩增片段长度116 bp,上游引物:5'-CCAGACACGGGACTTTATTATG-3',下游引物:5'-CCGCTCCTTATCTCCTCTATG-3'。扩增完毕后, 进入 ABI 7300 型荧光定量 PCR 仪自带的 SDS v1.3 软件的结果分析界面,设置 GAPDH 为内参照基 因,设置基线为 3~15 个循环,得到各样本、各基 因扩增的 Ct 值。设置 B4 样品为标准 1,按照 RQ= 2 -△△Ct公式得到各目的基因在各样本中表达水平 的相对定量值(RQ 值),将 RQ 值用于统计分析。 1.4 Western blot 法 测 定 nesfatin-1/NUCB2、 ghrelin 蛋白表达
将胃组织剪碎后置于匀浆套管中,按照 每 100 mg 组 织 1 mL 的 量 加 入 RIPA 裂 解 液 (150 mmol/L NaCl,50 mmol/L Tris-HCl,pH 7.8, 0.1% NP-40,0.5% 脱氧胆酸钠,0.1% SDS,0.1% EDTA) 进行匀浆。然后冰浴反应 30 min;离心 取上清 (即蛋白提取液 ),加入 PMSF 调至终 浓度为 1 %,-20℃ 保存。取 1 cm 光径比色杯, 根据考马斯亮蓝试剂盒说明书,用分光光度计于 595 nm 处测定样品 OD 值,按照以下公式计算出 样品的浓度(g/L):样品浓度 =(样品 OD 值 -空白OD值)/(标准OD值-空白OD值)×标 准品浓度 × 样品稀释倍数。在制作的电泳胶板加 样孔中加样,每孔中加入含 50 µg 蛋白的蛋白样品 电泳加样液进行 SDS-PAGE 电泳。转膜、封闭后 加小鼠抗大鼠一抗,4℃过夜。TTBS 振荡冲洗 3 遍, 加入用 TTBS 1 : 3 000 稀释的兔抗小鼠二抗,4℃孵 育 1 h。用 TTBS 室温洗膜 3 次,TBS(10 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl) 洗 膜 1 次。 抗体结合区带用化学发光法检测。将 DAB 显色的 PVDF 膜在凝胶成像仪上照像,Quantity One 软件 分析。结果用样品与 GAPDH 的 IOD 比值表示。 1.5 统计学分析
采用 SAS 8.0 统计分析软件包对数据进行分 析。所有计量资料用均数±标准差(x±s)表 示,多组间比较采用方差分析,组间两两比较采 用 SNK-q检验,P<0.05 为差异有统计学意义。 2 结果 2.1 各组仔鼠生后体重、身长增长比较
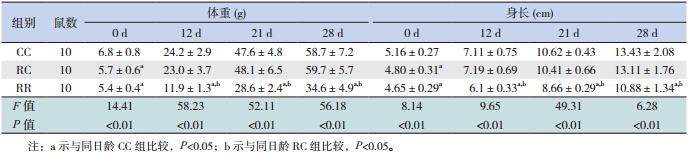
出生当天,R 组仔鼠体重及身长明显低于 C 组,RC 组于生后 12 d 内显示出明显的追赶生长, 体重与身长在生后 12 d、21 d 及 28 d 与 CC 组比 较差异均无统计学意义。RR 组于生后 12 d、21 d 及 28 d 体重与身长始终低于 RC 组及 CC 组 (均 P<0.05)。见表 1。
| 表 1 各组不同日龄仔鼠体重与身长比较(x±s) |
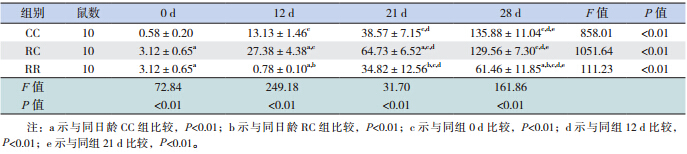
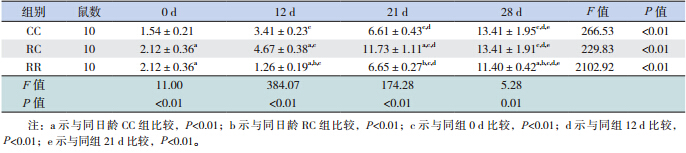
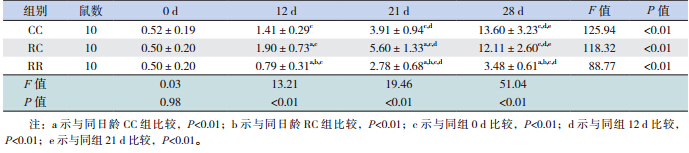
大鼠出生后胃黏膜即有nesfatin-1/NUCB2 mRNA 及蛋白的表达。随日龄增长,3 组仔鼠胃 nesfatin-1/NUCB2 mRNA 及 蛋 白 的 表 达 均 明 显 升 高,至生后 28 d,是出生时的数十倍甚至上百倍 (均P<0.01)。断奶前,RC 组均高于 CC 组(均 P<0.01),而断奶后 RC 组与 CC 组无差异。RR 组 在生后各时间点始终低于 RC 组(均P<0.01)。见 表 2,3 和图 1,2。
| 表 2 各组不同日龄仔鼠胃黏膜 nesfantin-1/NUCB2 mRNA 表达(x±s) |
| 表 3 各组不同日龄仔鼠胃黏膜 nesfantin-1/NUCB2 蛋白表达(x±s) |
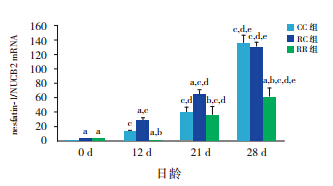 |
图 1 各组不同日龄仔鼠胃黏膜 nesfantin-1/NUCB2 mRNA 表达(n=10) a 示与同日龄 CC 组比较,P<0.01; b示与同日龄RC组比较,P<0.01;c 示 与 同 组 0 d 比 较, P<0.01;d 示与同组 12 d 比较,P<0.01;e 示与同组 21 d 比较, P<0.01。 |
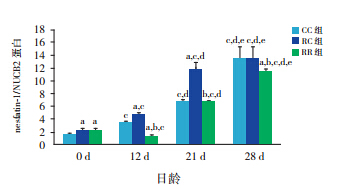 |
图 2 各组不同日龄仔鼠胃黏膜 nesfantin-1/NUCB2 蛋白表达(n=10) a 示与同日龄 CC 组比较,P<0.01; b示与同日龄RC组比较,P<0.01;c 示 与 同 组 0 d 比 较, P<0.01;d 示与同组 12 d 比较,P<0.01;e 示与同组 21 d 比较, P<0.01。 |
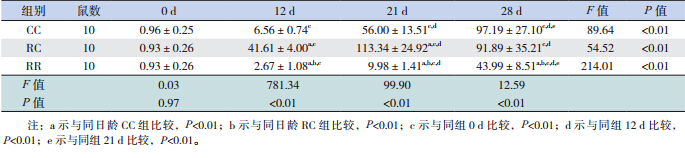
生后当天 ghrelin mRNA 及蛋白在 3 组仔鼠 胃黏膜表达无差异,但生后12 d 开始RC 组高 于 CC 组(均P<0.01),断奶后两组无差异。RR 组于生后 12 d 开始始终低于 RC 组及 CC 组(均 P<0.01)。见表 4,5和图 3,4。
| 表 4 各组不同日龄仔鼠胃黏膜 ghrelin mRNA 表达(x±s) |
| 表 5 各组不同日龄仔鼠胃黏膜 ghrelin 蛋白表达(x±s) |
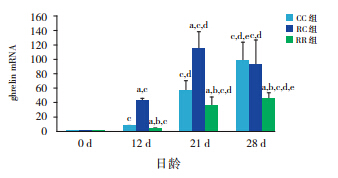 |
图 3 各组仔鼠不同日龄胃黏膜 ghrelin mRNA 表达 (n=10) a 示与同日龄 CC 组比较,P<0.01;b 示与同日龄 RC 组比较,P<0.01;c 示与同组0 d 比较,P<0.01;d 示与同组12 d 比较, P<0.01;e 示与同组 21 d 比较,P<0.01。 |
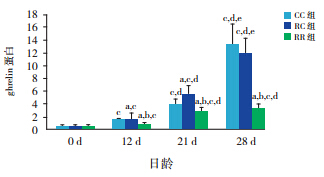 |
图 4 各组仔鼠不同日龄胃黏膜ghrelin 蛋白表达 (n=10) a 示与同日龄 CC 组比较,P<0.01;b 示与同日龄 RC 组比较,P<0.01;c 示与同组0 d 比较,P<0.01;d 示与同组12 d 比较, P<0.01;e 示与同组 21 d 比较,P<0.01。 |
研究表明,无论中枢还是外周注射 nesfatin-1 均有很明显的抑制摄食的作用[8,9]。而脑室内注射 nesfatin-1 抗体可刺激摄食 [2] 。禁食后胃内 NUCB2 mRNA 表达下降,同时血浆 nesfatin-1/ NUCB2 水 平下降,再投喂后可恢复[10] 。因此证实 nesfatin-1 作为抑制摄食的调节肽在下丘脑和外周均发挥重 要作用。
Nesfatin-1 免疫阳性细胞主要分布在胃的下 1/2 到 1/3 处,此处的内分泌细胞最多,包括分泌 ghrelin 的 X/A 样细胞 [11,12]。本研究检测胃黏膜内 nesfatin-1 与 ghrelin 的 mRNA 及蛋白的表达,发现 大鼠出生后胃黏膜即有 nesfatin-1 mRNA 及蛋白的 表达,且随日龄增长而增加,与国外学者研究一 致[6,13] 。断奶前,RC 组胃黏膜 nesfatin-1 的表达高 于 CC 组,而断奶后 RC 组与 CC 组表达无差异。 RR 组始终低于 RC 组,提示 nesfatin-1在3组之间 的差异与追赶生长关系密切。nesfatin-1在RC组 胃内的高表达可能是对 RC 组食欲良好、体重增加 的一种适应性反应。RC 组体重增长较快,升高的 nesfatin-1 可能有利于防止其食欲过盛及体重过度 增长而导致肥胖。相反,RR 组胃内 nesfatin-1的 低表达可能有利于其提高食欲及体重增加。
既往研究显示,高脂喂养的肥胖小鼠 ghrelin 在胃肠道表达下调,血浆 ghrelin 水平降低,而进 食后血浆中水平升高[14,15]。杨慧明等[16] 研究认为 ghrelin 可能参与了宫内 IUGR 胎鼠的生理调节或病 理过程。本研究结果显示,ghrelin 与 nesfatin-1共 同表达于胃黏膜。生后当天 ghrelin mRNA 及蛋白 在 3 组仔鼠胃黏膜表达无差异,但生后 12 d 开始 RC 组高于 CC 组,断奶后两组无差异。RR 组于 12 d 后始终低于 RC 组及 CC 组。与既往研究结果 一致[13,17]。提示 ghrelin 参与了 IUGR 仔鼠生后早 期的营养调控。Ghrelin 与 nesfatin-1 在胃内的表达 变化趋势一致,提示 nesfatin-1 和 ghrelin 作为脑肠 肽相互作用,相互协调,在摄食及能量代谢中发 挥重要作用。两者之间的相互作用尚需进一步深 入研究。
| [1] | Vieau D. Perinatal nutritional programming of health andmetabolic adult disease[J]. World J Diabetes, 2011, 2(9): 133-136. |
| [2] | Oh IS, Shimizu H, Satoh T, et al. Identification of nesfatin-1as a satiety molecule in the hypothalamus[J]. Nature, 2006,443(7112): 709-712. |
| [3] | Kojima M, Hosoda H, Date Y, et al. Ghrelin is a growthhormone-releasing acylated peptide from stomach[J]. Nature,1999, 402(6762): 656-660. |
| [4] | Cheng YY, Zhao XM, Cai BP, et al. Nesfatin-1 in newborns:relationship with endocrine and metabolic and anthropometricmeasures[J]. J Pediatr Endocr Met, 2012, 25(7-8): 727-732. |
| [5] | 程亚颖, 宫丽芬, 宋光耀, 等. 不同胎龄及体重新生儿血Ghrelin、胰岛素样生长因子-1、 胰岛素样生长因子结合蛋白-3、胰岛素水平检测分析[J]. 中国妇幼保健杂志, 2011,26(26): 4050-4052. |
| [6] | Mohan H, Unniappan S. Ontogenic pattern of nucleobindin-2/nesfatin-1 expression in the gastroenteropancreatic tissues andserum of Sprague Dawley rats[J]. Regul Pept, 2012, 175(1-3):61-69. |
| [7] | Coupé B1, Amarger V, Grit I, et al. Nutritional programmingaffects hypothalamic organization and early response toleptin[J]. Endocrinology, 2010, 151(2): 702-713. |
| [8] | Atsuchi K, Asakawa A, Ushikai M, et al. Centrally administerednesfatin-1 inhibits feeding behaviour and gastroduodenal motility in mice[J]. Neuroreport, 2010, 21(15): 1008-1011. |
| [9] | Shimizu H, Oh-I S, Hashimoto K, et al. Peripheraladministration of nesfatin-1 reduces food intake in mice: theleptin-independent mechanism [J]. Endocrinology, 2009, 150(2):662-671. |
| [10] | Stengel A, Goebel M, Wang L, et al. Central nesfatin-1reduces darkphase food intake and gastric emptying in rats:differential role of corticotropin-releasing factor 2 receptor[J].Endocrinology, 2009, 150(11): 4911-4919. |
| [11] | Stengel A, Goebel M, Yakubov I, et al. Identification andcharacterization of nesfatin-1 immunoreactivity in endocrinecell types of the rat gastric oxyntic mucosa[J]. Endocrinology,2009, 150(1): 232-238. |
| [12] | Zhang AQ, Li XL, Jiang CY, et al. Expression of nesfatin-1/NUCB2 in rodent digestive system[J]. World J Gastroenterol,2010, 16(14): 1735-1741. |
| [13] | Kerbel B1, Unniappan S. Nesfatin-1 suppresses energy intake,co-localises ghrelin in the brain and gut, and alters ghrelin,cholecystokinin and orexin mRNA expression in goldfish[J]. JNeuroendocrinol, 2012, 24(2): 366-377. |
| [14] | Moesgaard SG, Ahrén B, Carr RD, et al. Effects of highfatfeeding and fasting on ghrelin expression in the mousestomach[J]. Regul Pept, 2004, 120(1-3): 261-267. |
| [15] | Aydin S, Sahin I, Ozkan Y, et al. Examination of the tissueghrelin expression of rats with diet-induced obesity usingradioimmunoassay and immunohistochemical methods[J]. MolCell Biochem, 2012, 365(1-2): 165-173. |
| [16] | 杨慧明, 毛萌, 杨凡, 等. Grelin 及受体GHSR 表达变化与宫内发育受限仔鼠追赶生长的关系[J]. 中国当代儿科杂志,2010, 12(7): 563-568. |
| [17] | Stengel A, Goebel M, Wang LX, et al. Ghrelin, des-acyl ghrelinand nesfatin-1 in gastric X/A-like cells: Role as regulators offood intake and body weight[J]. Peptides, 2010, 31(2): 357-369. |
 2014, Vol. 16
2014, Vol. 16