2. 中心实验室, 湖北 武汉 430016
患儿女,5 岁 10 个月,因间断腹痛 7 d,全身 浮肿 4 d 入院。患儿入院前 1 周于进食腊鸭后出现 腹痛,为脐周阵发性隐痛,可自行缓解。后发展 为呕吐胃内容物,食后即吐,无胆汁及咖啡渣样物。 4 d 前家长发现患儿眼睑浮肿,且进行性加重,双 下肢逐渐出现凹陷性水肿。患儿发病以来无发热, 无咳嗽、无腹泻等症状。既往体健,无肝炎、结 核等传染病史,无外伤手术史,无药物食物过敏史, 无输血史,预防接种规律。
入院体查:体温 36.4℃,脉搏 100 次 / 分,呼 吸 26 次 / 分,体重 24 kg,身长 122 cm。神志清, 精神可。眼睑水肿,双下肢凹陷性水肿,颈部可 触及多枚蚕豆大小淋巴结,质软,可活动,皮肤 巩膜无黄染。咽充血,双侧扁桃体Ⅱ°肿大,可 见脓栓,双肺呼吸音清。心律齐,心音有力,心 脏各听诊区均未闻及杂音。腹部饱满,全腹柔软, 无压痛,肝脏右肋下 2.5 cm,质软,脾脏左肋下 未触及,移动性浊音阳性。入院后完善相关辅助 检查。血液分析:WBC 17.15×10 9 /L,N 0.213,L 0.605,EOS 0.015,RBC 4.53×10 12 /L,Hb 136 g/L, PLT 228×10 9/L,外周血细胞形态未见明显异常。 尿液分析未见异常。肝功能检查:总蛋白(TP) 36.3 g/L(参考值 60.0~80.0 g/L),白蛋白(ALB) 20.0 g/L(参考值 39.0~53.0 g/L),球蛋白(GLB) 16.3 g/L(参考值20.0~40.0 g/L),谷丙转氨酶(ALT) 23 U/L(参考值 0~40 U/L),谷草转氨酶(AST) 50 U/L(参考值 10~50 U/L)。电解质(4 项): Ca 2+ 1.98 mmol/L(参考值 2.0~3.0 mmol/L),Na +、 K + 及 Cl-正常。肾功能、心肌酶谱、凝血象无异 常,降钙素原检测(金标法,定量)0.073 ng/mL (参考值 0~0.046 ng/mL)。巨细胞病毒(CMV)-IgM 阳性,CMV-IgG 阴性。EB 病毒抗体(4 项) EBVCA-IgG 阳性,余阴性。艾滋病抗体、梅毒抗体、 乙肝全套、丙肝抗体及细小病毒 B19 -IgM 均阴性。 IgE 60.40 IU/mL(参考值 0~60 IU/mL)。胸片检查 正常。腹部彩超示腹腔积液(膀胱后方可见前后 径约 3.3 cm 的无回声区)。小肠结肠双期增强 + 体层成像检查未发现小肠及结肠有明显扩张积气 及狭窄征象,腹膜后、肠系膜淋巴结稍多、增大。 入院后给予抗感染(更昔洛韦、头孢美唑)、输 注白蛋白(总量 1 g/kg,入院 1 周内分 3 次输注) 及利尿等治疗,患儿水肿消退,腹痛及呕吐缓解 , 颈部淋巴结缩小,扁桃体分泌物消失。进一步行 全身麻醉下电子胃镜及结肠镜检查,发现胃底及 胃体黏膜明显充血水肿,呈结节样肥厚、隆起, 其表面可见糜烂,质脆易出血,较多白色黏液覆 盖黏膜表面;食管、贲门、胃窦、胃角、幽门、 十二指肠球部未见异常(图 1)。结肠镜检查未见 异常。取胃窦及胃体黏膜活检,提示胃窦黏膜组 织呈慢性炎症改变,嗜酸粒细胞约 1 个 /HPF;胃 体黏膜上皮呈管状腺瘤样增生,固有膜及黏膜下 层水肿明显,并见散在的炎性细胞浸润(图 2), 嗜酸粒细胞最多约 15 个 /HPF,免疫组化检查示 幽门螺杆菌(Hp)阴性,CMV 阴性。之后给予 洛赛克抑酸、吉法酯保护胃黏膜等治疗。入院后 第 16 天复查肝功能全套(9 项)TP 64.4 g/L,ALB 35.8 g/L,GLB 28.6 g/L,均较入院时升高,白蛋白 仍低于正常值,电解质及血液分析未见异常。入 院第 26 天在全麻下行超声胃镜检查,提示胃体可 见多处的第二层无回声性增厚,最厚处达 5.8 mm, 胃部周围未见明显增大的淋巴结(图 3)。考虑诊 断“蛋白丢失性胃病”(protein-losing gastropathy, PLG)。入院后第 30 天及出院后随访 6 个月血浆 蛋白水平、血液分析均无异常,患儿未再出现腹痛、 呕吐、水肿等症状,出院半年复查胃镜,显示胃黏膜已恢复正常。
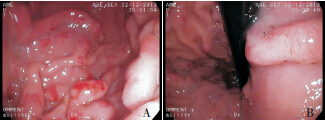 |
图 1 胃镜检查结果 A: 胃体黏膜广泛充血、水肿,呈 结节样肥厚、隆起,表面可见糜烂;B: 胃底黏膜肥厚、隆起,表 面可见糜烂及白色黏液覆盖。 |
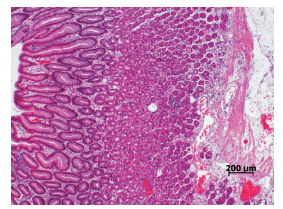 |
图 2 组织病理学检查(苏木精 - 伊红染色,×100) 胃体黏膜上皮呈管状腺瘤样增生,固有膜及黏膜下层水肿明显, 见散在的炎性细胞浸润。 |
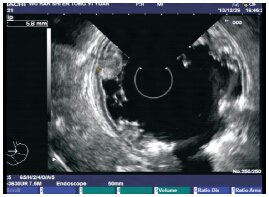 |
图 3 超声胃镜检查 胃体可见多处第二层无回声性增 厚,提示黏膜增厚。 |
讨论: PLG 是一种罕见的疾病,迄今为止文 献报道的病例不超过 100 例。与成人患者不同, 儿童患者常表现为良性和自限性的过程,大多数 患儿经过对症治疗,可在数周至数月内痊愈。PLG 的临床表现包括水肿、低蛋白血症、腹痛、呕吐、 厌食等[1,2,3,4]。本例患儿急性起病,无偏食、挑食等 不良饮食习惯,既往无营养不良及肝病史,ALT、 AST 及凝血象均无异常,可排除蛋白质摄入不足、 肝脏合成功能障碍所致的低蛋白血症。尿液分析 未见异常,排除肾病所致的蛋白丢失,且患儿有 腹痛、呕吐等胃肠道症状,胃镜检查提示胃黏膜 有明显病变,而结肠镜及小肠结肠双期增强 + 体 层成像检查未发现肠道明显病变,需考虑诊断 PLG。为了进一步明确病变的起源层次并对下一步 的治疗提供帮助,该患儿接受了超声胃镜检查, 提示部分区域可见清晰的胃壁五层结构:黏膜界 面回声及浅表黏膜层、较深的黏膜层、黏膜下层、 黏膜肌层、浆膜层,整体厚度约为 3.0 mm,胃体 可见多处的第二层无回声增厚,最厚处达 5.8 mm, 胃部周围未见明显增大的淋巴结。因此,依据腹 痛、呕吐、低蛋白血症、水肿等临床表现,胃镜 可见胃黏膜有明显病变,且排除蛋白质摄入不足、 肝脏合成功能障碍及肾脏、肠道丢失等所致的低 蛋白血症,本例患儿诊断为 PLG。
本病例胃镜检查提示胃体及胃底黏膜肥厚、 隆起,充分充气后肥厚的胃黏膜不能变平,超声 胃镜显示胃黏膜层增厚,病原学检查有 CMV 活动 性感染的依据,经抗感染、输注白蛋白、利尿等 治疗后,患儿临床症状消失,出院前及出院后随 访 6 个月血浆蛋白水平均无异常,出院后 6 个月 复查胃镜胃黏膜恢复正常,提示预后好,良性病 变的可能性大。
引起蛋白从胃内丢失的疾病较少,典型的疾 病是Ménétrier病[5],又称胃黏膜巨大肥厚症,是 以巨大肥厚的胃黏膜皱襞及低蛋白血症为特征的 一组综合征,该病为良性增生性胃病的一种,多 伴上腹部不适、恶心、呕吐等临床表现,于 1888 年由法国病理学家Pierre Ménétrier首先报道[6]。目 前该病病因尚不明确,可能的原因包括化学刺激、 毒素、食物因素、过敏反应、免疫异常、感染等, 其中感染因素包括 CMV、Hp、单纯疱疹病毒、肺 炎支原体[7] 等。文献报道成人Ménétrier 病与 Hp 感染密切相关[8],而儿童Ménétrier病约 70% 与 CMV 感染相关 [3]。该病诊断主要依赖内镜检查及 组织病理学诊断,其内镜特征是胃体、胃底黏膜 增厚,通常不累及胃窦,组织学特征是胃小凹增 生、囊性扩张,壁细胞和主细胞减少。本例患儿 有腹痛、呕吐、低蛋白血症的临床症状及 CMV 活 动性感染的依据,胃镜提示胃底、胃体黏膜肥厚、 隆起,伴糜烂,超声内镜见胃体多处第二层 ( 黏膜 层 ) 无回声增厚,均提示Ménétrier病的可能,但 病理检查未发现黏膜层增厚、胃小凹增生等表现, 可能与增厚的胃黏膜超过常规内镜下活检的取材 深度有关,提示需行内镜下黏膜切除(endoscopic mucosal resection, EMR)以取得包含全黏膜层的足 够量的标本[9],从而获得准确的病理诊断。
本病需要与胃淋巴瘤、嗜酸粒细胞胃肠炎、 淀粉样变性、浸润性癌、佐艾氏综合征等疾病鉴别, 主要从病理上进行鉴别,超声胃镜也可辅助鉴别 诊断,如胃淋巴瘤早期可出现第二层和第三层增 厚,晚期五层均可增厚[9]。
| [1] | Occena RO, Taylor SF, Robinson CC, et al. Association ofcytomegalovirus with Ménétrier's disease in childhood: reportof two new cases with a review of literature[J]. J PediatrGastroenterol Nutr, 1993, 17(2): 217-224. |
| [2] | Megged O, Schlesinger Y. Cytomegalovirus-associated proteinlosinggastropathy in childhood[J]. Eur J Pediatr, 2008, 167(11):1217-1220 . |
| [3] | Sferra TJ, Pawel BR, Qualman SJ, et al. Ménétrier disease ofchildhood: role of cytomegalovirus and transforming growthfactor alpha[J]. J Pediatr, 1996, 128(2): 213-219. |
| [4] | Marks MP, Lanza MV, Kahlstrom EJ, et al. Pediatrichypertrophic gastropathy[J]. AJR Am J Roentgenol, 1986,147(5): 1031-1034 . |
| [5] | 陈雪, 王立. 蛋白丢失性肠病的研究进展[J]. 检验医学与临床, 2010, 7(13): 1395-1396. |
| [6] | Toubia N, Schubert ML. Ménétrier's disease[J]. Curr TreatOptions Gastroenterol, 2008, 11(2): 103-108. |
| [7] | Russo T, Costa C, Crujo C, et al. Protein-losing gastropathy withcytomegalovirus infection in a child[J]. BMJ Case Rep, 2012,2012: bcr0120125679. |
| [8] | Ishikawa T, Ando T, Obayashi H, et al. Helicobacter pyloriisolated from a patient with Ménétrier's disease increaseshepatocyte growth factor mRNA expression in gastricfibroblasts: comparison with Helicobacter pylori isolated fromother gastric diseases[J]. Dig Dis Sci, 2008, 53(7): 1785-1791. |
| [9] | Tsurumaru D, Masunari S, Utsunomiya T, et al. Protein-losinggastropathy with hypertrophic gastric folds: endosonographicfindings[J]. J Clin Ultrasound, 2008, 36(1): 35-38. |
 2014, Vol. 16
2014, Vol. 16
