B 族链球菌(group B Streptococcus, GBS)是 一种 β 溶血性革兰染色阳性链球菌,亦称无乳 链球菌。它经常定植于妊娠妇女的下消化道和泌 尿生殖道,可导致围产期孕妇的严重感染,也是 引起新生儿感染性疾病的主要细菌性病原。新生 儿感染常表现为肺炎、败血症和脑膜炎,根据发 病时间可分为早发型GBS 疾病(early-onset GBS disease, GBS-EOD)和晚发型 GBS 疾病(late-onset GBS disease, GBS-LOD)。另外 GBS 也可以造成老 年人和免疫力低下青少年的感染[1]。
欧美等发达国家采取产时抗生素预防性治疗 (intrapartum antibiotic prophylaxis, IAP)策略已大 幅度降低了 GBS-EOD 的发病率 [2] 。美国 GBS-EOD 发病率从 1993 年的 1.7/1 000 例活产儿降低到 2008 年的 0.4/1 000 例活产儿 [3] 。研究表明 GBS-EOD 的 发病率虽下降,但在美国和欧洲国家,GBS 仍是 新生儿高致病性和高致死性疾病的主要病原[4]。总 的来说,我国儿科临床对新生儿 GBS 感染关注和 重视不够。本文对新生儿 GBS 感染流行状况及欧 美等发达国家预防策略的研究进展情况进行综述, 希望引起同行重视相应疾病的研究和防治。 1 新生儿 GBS 感染性疾病类型及危险因素
美国等将 GBS-EOD 定义为生后 1 周内(0~6 d) 发 病,GBS-LOD 为 生 后 7~89 d 发 病 [4]。侵袭性 GBS 感染是指在正常无菌部位(如血液、脑脊液、 关节腔、胸膜腔、心包等部位)出现 GBS 的感染[5]。 在实施 IAP 前,GBS-EOD 比 GBS-LOD 常见,约占 新生儿 GBS 感染性疾病的 75%~80%,实施 IAP 后 两者发病率大致相同[6]。 1.1 GBS-EOD
90% GBS-EOD 患儿在出生 24 h 内出现临床症 状,这与早发感染主要通过母婴垂直传播方式获 得有关[7]。孕妇若存在生殖道 GBS 定植,分娩发 动或者胎膜破裂时细菌可由阴道逆行至羊水引起 新生儿感染,或产儿通过产道时细菌定植到皮肤 或黏膜[8]。即使羊膜完整,GBS 也可引起感染,导 致流产﹑死产或者早产[9]。侵袭性 GBS 感染一般 是新生儿在产程中吞咽或吸入 GBS 感染的羊水, 发生新生儿败血症[10]。
GBS-EOD 的首要危险因素是母体GBS 的定植, 尤其是重度定植(heavy colonization)。重度定植 是指进行细菌培养时无需使用选择性肉汤培养基, 在普通培养皿上即可出现阳性结果;GBS 菌尿症 是重度定植的一个重要标志[8]。在发达国家孕妇 GBS 定植率为 20%~30% [1] ,台湾地区为 20%[11], 最近Lu等[12] 报道北京地区孕妇GBS 携带率为 7.1%。若没有任何预防措施,定植孕妇分娩过程中, GBS 可趁机定植于一半产儿的呼吸道或消化道, 但一般不发病[13],只有 1%~2% 存在定植的新生儿 会发展为侵袭性感染[14]。另外美国的研究显示, 与 GBS 定植阴性的孕妇相比,定植阳性的孕妇分 娩出的新生儿发生 GBS-EOD 败血症的概率明显增 高,是前者的 25 倍[15]。其他危险因素包括分娩时 胎龄 <37 周、胎膜破裂≥ 18 h 、绒毛膜炎(产期 发热≥ 38℃)、前一胎有过 GBS 感染以及黑人种 族等。早产虽是 GBS-EOD 的危险因素,但 75% 的 GBS-EOD 患儿为足月儿 [3]。
GBS-EOD 临床表现主要为败血症和暴发性肺 炎,少部分患儿表现为脑膜炎。若不及时治疗, 病情可能迅速恶化,出现呼吸困难、体温不稳、 循环障碍和皮肤苍白等症状[3]。随着对产妇进行合 理的抗生素治疗和新生儿管理水平的提高,GBSEOD 的病死率明显下降,由20 世纪70 年代的 50% 降到 2010 年的 4%~6%,但在早产儿中病死 率仍很高,约为 20%。有研究表明妊娠 33 周前出 生的早产儿 GBS-EOD 的病死率高达 30%,足月新 生儿的病死率仅为 2%~3%[8]。 1.2 GBS-LOD
约 50% 的 GBS-LOD 患儿母亲孕期存在 GBS 定植,且患儿分离菌株血清型与母亲定植菌血清 型一致,说明定植是 GBS-LOD 的危险因素之一 [16]。 其他50% 原因不明确,可能与医院环境、母乳喂养、 母亲感染 HIV 病毒以及孕妇年龄 <20 岁等因素有 关。总之 GBS-LOD 与母婴垂直传播和生后水平 传播均存在一定的相关性。另外有研究提示 GBSLOD 的主要危险因素是早产,且出生越早感染的 危险系数越高[17]。 GBS-LOD 临床表现多为败血症,约 1/4 的患 儿出现脑膜炎,少数表现为蜂窝织炎和骨关节炎[3]。
GBS-LOD 发病率和病死率比 GBS-EOD 低,其病死 率为 2%~6%,但预后较差,并发症较多。50% 脑 膜炎存活儿存在不同程度的后遗症,包括皮质盲、 听力丧失、脑积水和语言发育迟缓等[18]。 2 新生儿 GBS-EOD 的预防
已在临床使用的预防新生儿 GBS 感染的措施 主要包括 :(1)孕妇产时使用抗生素,即 IAP,预 防策略应开始于分娩开始发动或者胎膜破裂,以 阻断 GBS 的垂直传播和减少产后感染的发生率; (2)对新生儿进行预防性治疗,能保证药物在新 生儿体内的杀菌浓度,但对分娩时已发生的菌血 症失去了预防意义[19]。分娩时已出现的新生儿菌 血症多由宫内感染引起,宫内感染发生的主要因 素是孕期存在危险因素。因此,预防新生儿 GBSEOD 最主要的预防措施是筛查存在危险因素的孕 妇,分娩时给予 IAP,减少宫内感染,降低新生儿 GBS-EOD 发病率和减少产后感染的发生 [20]。根据 筛查方法的不同,分为普遍筛查方案和高危因素 评估方案。 2.1 给予 IAP 孕妇的筛查方案
1996 年美国疾病控制与预防中心(CDC)针 对 IAP 使用对象提出两种筛选方案:高危因素评 估方案和普遍筛查方案[21]。高危因素评估方案是 以分娩时孕妇存在的危险因素为唯一判断依据, 具有以下一项或一项以上危险因素的孕妇应于产 时给予抗生素预防:(1)分娩时胎龄 <37 周; (2)胎膜破裂≥ 18 h;(3)产妇体温≥ 38℃; (4)前一胎有 GBS 感染史;(5)孕期有 GBS 菌尿症[20] 。但研究表明 40% 的 GBS-EOD 患儿母 亲不存在任何危险因素[22]。普遍筛查方案则要求 采集妊娠 35~37 周孕妇的阴道和(或)直肠拭子 进行细菌培养,培养阳性者或具有以下任一情况 者应给予抗生素治疗:(1)胎龄 <37 周分娩; (2)孕产妇 GBS 菌尿症或前一胎有 GBS 感染史; (3)虽不具有以上情况但孕妇未做细菌培养或分 娩时培养结果未知者;(4)产期体温≥ 38℃或胎 膜破裂≥ 18 h [23]。普遍筛查方案也存在弊端,培养 结果假阴性、过多的孕妇暴露于抗生素等[22]。
1996~2002 年,两种方案在美国都有采用, 且使用率相似[24] 。随后调查显示两种方案使 GBSEOD 的发病率下降了 50%~85%,同时产后 GBS 感染率也有下降[25] 。但对 600 000 多名活产儿进 行的回顾性分析表明,普遍筛查方案的预防有效 性较高危因素评估方案高 50%(每 1 000 例活产 儿患病数分别是 0.33 和 0.59)[24]。因此,2002 年 美国 CDC 修订了预防指南,推荐采用普遍筛查方 案[26]。指南于 2010 年再次修订,最新指南建议: (1)对所有妊娠 35~37 周的孕妇分别采集阴道下 1/3 和直肠(通过直肠括约肌)拭子进行细菌培养, 任何一个部位阳性即可认为存在 GBS 的定植。阳 性者在分娩发动或胎膜破裂时给予 IAP;在临产或 破膜前选择剖宫产者不需要使用抗生素;(2)孕 期有 GBS 菌尿症以及前一胎感染 GBS 的孕妇,不 必做细菌培养,直接在产程开始或胎膜破裂时给 予 IAP;(3)分娩时无培养结果或培养结果未知者, 对存在任一危险因素(分娩胎龄 <37 周、胎膜破 裂≥ 18 h、产前体温≥ 38℃)的孕妇给予 IAP; 对没有任何危险因素的孕妇,可在阴道和直肠取 样进行核酸扩增,作为快速检测方法[8]。
有研究报告超过 60% 的 GBS-EOD 患儿的母 亲细菌培养阴性,可能与拭子采集时间过早、培 养技术欠佳和 GBS 间断定植等因素有关[27]。采集 拭子和细菌培养时需注意以下几点:(1)应采集 直肠和阴道拭子各 1 份。研究显示两份拭子细菌 培养阳性率较单一拭子阳性率高 40%[28];(2)采 集拭子时间最好选择在妊娠 35~37 周。有些学者 认为在分娩前 5 周内采集拭子的培养结果可作为 IAP 决策参考 [29];(3)细菌培养时应使用选择性 肉汤培养基,若使用普通培养基约有 50% 定植者 出现假阴性结果[10]。实时荧光聚合酶链反应敏感 性和特异性均高达 95%,且能在较短时间内得出 结果,但需特殊设备,临床上还未得到推广[28]。
法国、德国、西班牙、日本、比利时国家 建议采用普遍筛查方案,荷兰、英国和丹麦等欧 洲国家推荐采用高危因素评估方案[30]。调查发现 44% 澳大利亚的产科和儿科医生倾向于采用高危 因素评估方案,未采用普遍筛查方案主要顾虑包 括:担心出现表现严重的青霉素过敏反应、抗生 素的耐药性增加、拭子采集不及时和实验室培养 技术要求较高等[31]。澳大利亚统计,若采用普遍 筛查方案将有 30%~35% 的孕妇接受 IAP,若采用 高危因素评估方案仅有 15%~20% 的孕妇需要使 用抗生素[32]。普遍筛查方案可以鉴定出 20% 存在 GBS 定植却没有任何危险因素的孕妇 [27]。 2.2 抗生素的选择和使用
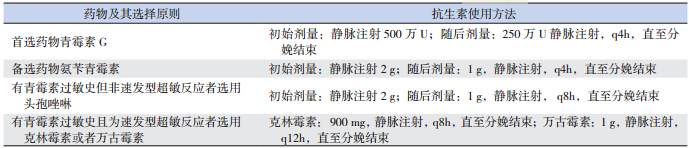
几乎所有 GBS 菌株对青霉素和大部分 β 内 酰胺类抗生素敏感,同时青霉素抗菌谱较窄,有 利于减少抗生素耐药情况的产生。据日本和美国 报道,有少数菌株对青霉素的敏感性下降但临床 意义不大,依然将青霉素 G 作为 IAP 和治疗 GBS 感染的首选药物[3]。氨苄青霉素为广谱抗生素,为 备选药物。
约 10% 存在危险因素的孕妇对青霉素过敏, 产时需选择其他抗生素[33]。预防指南建议:有青 霉素过敏史但非速发型超敏反应者(使用青霉素 或者头孢菌素类药物后出现荨麻疹、神经源性水 肿、呼吸困难等症状)可使用头孢唑啉,因其穿 过胎盘的转运方式与青霉素相似;对青霉素过敏 且为速发型超敏反应者选择抗生素应慎重,需根 据药物敏感性实验结果来选择。菌株若对克林霉 素和红霉素均敏感,选用克林霉素;对克林霉素 敏感而对红霉素耐药者,需进一步做药物诱导性 耐药实验(即 D 实验),阴性者选择克林霉素; D 实验阳性,或菌株对克林霉素耐药,或药物敏 感性结果未知者,选用万古霉素[8]。澳大利亚监测 结果提示其 GBS 菌株对克林霉素和红霉素的耐药 率较低,因此 2010 年澳大利亚预防指南建议对 β 内酰胺类药物过敏的孕妇可选用克林霉素[34];但 最近监测结果显示澳大利亚和新西兰与其他国家 一样,GBS 分离株对红霉素和克林霉素的耐药率 呈上升趋势[35]。美国曾报道 1 例孕妇,在没有药 物敏感性检测情况下直接选用克林霉素进行预防 治疗,结果分娩的新生儿发生 GBS-EOD [36]。因此, 若孕妇对 β 内酰胺类药物过敏,需进一步对菌株 进行药物敏感性试验以确保分娩时使用的抗生素 有效。
口服抗生素对预防新生儿 GBS 感染无效, 故推荐在分娩开始发动或者胎膜破裂时给予静脉 注射抗生素[23]。静注青霉素 G 或氨苄青霉素或 头孢唑啉时间长于 4 h 定义为充分 IAP(adequate IAP);静注短于 4 h 或者使用其他抗生素(包括 克林霉素和万古霉素),因缺乏相关统计数据, 定义为不充分 IAP(inadequate IAP) [26]。具体用药 原则和抗生素使用方法见表 1。
| 表 1 IAP 的用药原则和抗生素使用方法 |
广泛使用 IAP 的主要危险:(1)孕妇使用抗 生素的机会增多,增加药物过敏反应的危险[28]; (2)新生儿病原菌的耐药性增加;(3)其他细 菌将代替 GBS 成为新生儿败血症的主要病原[37]。
目前 GBS 虽对青霉素保持敏感,但对克林霉 素和红霉素耐药性不断增加[9]。我们课题组对国 内 2008~2013 年新生儿侵袭性 GBS 分离株(共 40 株)的研究结果显示菌株对克林霉素和红霉素的 不敏感率分别为 90% 和 95%(数据尚未发表)。 美国实施 IAP 策略后其他病原菌引起的早发型败 血症在足月儿中发病率没有提高,1998~2000 年与 1991~1993 年比较,由大肠杆菌引起的侵袭性败血 症发病率在低出生体重儿有所升高,1998~2000 年 与 2002~2003 年比较水平相当[38]。美国新生儿中 心在 1997~2010 年期间调查研究显示 IAP 降低了 早发型疾病发病率,而此期间由大肠杆菌和 GBS 引起的晚发型疾病发病率有所升高[39]。 2.4 管理存在危险因素的新生儿
IAP 只是降低了 GBS-EOD 的发病率,并没有 完全消灭 GBS 感染[8]。医生应该意识到细菌培养 阴性的孕妇分娩出的新生儿,仍存在感染 GBS 的 可能,对任何有早发型感染症状的新生儿均应提 高警惕[10]。
CDC 最新预防指南指出,任何有败血症症状 的新生儿需进行全面评估(包括全血细胞检查、 血培养,能耐受腰椎穿刺者行脑脊液培养,有呼 吸道症状时行胸片检查),等待结果期间需使用 抗生素以预防新生儿败血症。特别强调无论母亲 携带情况如何,都要重视临床症状,因临床症状 是败血症的敏感指标[8]。若新生儿表现良好,但母 亲患有绒毛膜炎,此时需进行有限的诊断检测(包 括全血细胞检查、血培养,有呼吸症状时行胸片 检查),并进行经验性药物治疗;表现良好的足 月婴儿,若母亲分娩前胎膜破裂 <18 h 仅需住院观 察 48 h;母亲存在胎膜破裂≥ 18 h 的足月儿,以 及所有的早产儿均需进行血培养和全血细胞检查, 住院观察至少 48 h [26]。 3 预防新生儿 GBS 疾病的未来策略
孕产期筛查方案以及新生儿的高级护理措施 在一些发达国家得到了实施且取得了一定的成果, 由于经济等原因预防措施在发展中国家难以推 广[40] ;另外 IAP 对 GBS-LOD 发病率影响不大,侵 袭性 GBS 疾病负担还在增加[41];因此,还需要积 极研究其他预防策略。疫苗不仅可以减少 IAP 的 副作用,还可以减少 GBS-LOD ﹑宫内感染和产后 感染的发生[30]。
目前临床上还没有可用的疫苗。研发阶段的 GBS 疫苗主要有以下几种:(1)荚膜多糖疫苗: 为第一代 GBS 疫苗,因其免疫原性在成人体内不 稳定,加之其非 T 细胞依赖性,不能产生免疫记 忆,限制了这类疫苗作为人类疫苗的使用和发展; (2)荚膜多糖 - 蛋白结合疫苗:结合蛋白质载体 而成的结合疫苗;(3)蛋白疫苗:以 GBS 菌体 表面的蛋白质成分为抗原的蛋白质疫苗,这类疫 苗可同时抗多种血清型 GBS 的感染。前两种疫苗 的有效抗原成分是细菌的荚膜多糖抗原。基于荚 膜多糖抗原性的差异,目前 GBS 可分为 Ia、Ib、 II~ IX 等 10 个血清型 [42]。流行病学调查显示 Ia、 Ib、II、III、IV 和 V 比较常见,占所有分离株的 85% [30]。血清型分布存在地域性差异,美国和欧 洲最常见的血清型是 Ia、II、III 和 V 型,日本为 VI 和 VIII 型,而拉丁美洲以 III 型多见 [28]。导致 GBS-EOD 主要有 Ia、II、III 和 V 型细菌,尤其以 Ia 多见,合并脑膜炎者 80% 为 III 型,GBS-LOD 主要与 III 型有关[1];侵袭性感染分离菌株中的 70%~80% 属于 Ia、Ib 和 III 型 [43]。由于 GBS 血清 型的多样性以及地区分布的差异性,使得生产普 遍有效的疫苗难度增加。从道德和伦理方面考虑, 把疫苗应用于孕妇也是一大难关。
综上所述,过去20 年,IAP 有效地降低了 GBS-EOD 的发病率。普遍筛查方案加 IAP 是目前 最为有效的预防新生儿 GBS 感染的策略。GBS 仍 是新生儿败血症的主要病原菌之一,具有发病率 高和病死率高的特点,尤其是早产儿。现在还没 有策略能够完全消除 GBS 感染,临床医生需对任 何有败血症迹象的新生儿提高警惕。采用普遍筛 查加 IAP 预防策略仍存在问题:筛查结果假阴性; 不能减少 GBS-LOD 发病率;对 GBS 宫内感染及其 引起的死产 / 流产没有影响和抗生素耐药性增加 等。另一方面,不论采用何种筛查方案,存在危 险因素的孕妇仍有可能得不到及时有效的抗生素 治疗。研发 GBS 疫苗进行孕妇免疫接种可以解决 上述问题,但还需克服伦理、血清型覆盖率等诸 多问题。
| [1] | Le Doare K, Heath PT. An overview of global GBSepidemiology [J]. Vaccine, 2013, 31 (Suppl 4): D7-D12. |
| [2] | Perinatal group B streptococcal disease after universal screeningrecommendations-United States, 2003-2005[J]. MMWR MorbMortal Wkly Rep, 2007, 56(28): 701-705. |
| [3] | Melin P. Neonatal group B streptococcal disease: frompathogenesis to preventive strategies[J]. Clin Microbiol Infect,2011, 17(9): 1294-1303. |
| [4] | Edmond KM, Kortsalioudaki C, Scott S, et al. Group Bstreptococcal disease in infants aged younger than 3 months:systematic review and meta-analysis[J]. Lancet, 2012,379(9815): 547-556. |
| [5] | Yu HW, Lin HC, Yang PH, et al. Group B streptococcal infectionin Taiwan: maternal colonization and neonatal infection[J].Pediatr Neonatol, 2011, 52(4): 190-195. |
| [6] | Jordan HT, Farley MM, Craig A, et al. Revisiting the need forvaccine prevention of late-onset neonatal group B streptococcaldisease: a multistate, population-based analysis[J]. Pediatr InfectDis J, 2008, 27(12): 1057-1064. |
| [7] | Barbadoro P, Marigliano A, Savini S, et al. Group BStreptococcal sepsis: an old or ongoing threat?[J]. Am J InfectControl, 2011, 39(8): e45-e48. |
| [8] | Verani JR, Mcgee L, Schrag SJ. Prevention of perinatal group Bstreptococcal revised disease—guidelines from CDC, 2010[J].MMWR Recomm Rep, 2010, 59(RR-10): 1-36. |
| [9] | Koenig JM, Keenan WJ. Group B streptococcus and early-onsetsepsis in the era of maternal prophylaxis[J]. Pediatr Clin NorthAm, 2009, 56(3): 689-708. |
| [10] | Randis TM, Polin RA. Early-onset group B Streptococcal sepsis:new recommendations from the Centres for Disease Control andPrevention[J]. Arch Dis Child Fetal Neonatal Ed, 2012, 97(4):F291-F294. |
| [11] | Chang LY. Maternal colonization and neonatal group Bstreptococcal infection: time to universal screening andintrapartum chemoprophylaxis in Taiwan?[J]. Pediatr Neonatol,2011, 52(4): 181-182. |
| [12] | Lu B, Li D, Cui Y, et al. Epidemiology of Group B streptococcusisolated from pregnant women in Beijing, China[J]. ClinMicrobiol Infect, 2014, 20(6): 370-373. |
| [13] | Lo JY. Early-onset group B streptococcus neonatal disease: atarget for prevention?[J]. Hong Kong Med J, 2009, 15(6): 412-413. |
| [14] | Madzivhandila M, Adrian PV, Cutland CL, et al. Serotypedistribution and invasive potential of group B streptococcusisolates causing disease in infants and colonizing maternalnewborndyads[J]. PLoS One, 2011, 6(3): e17861. |
| [15] | Boyer KM, Gotoff SP. Strategies for chemoprophylaxis of GBSearly-onset infections[J]. Antibiot Chemother (1971), 1985, 35:267-280. |
| [16] | Berardi A, Rossi C, Lugli L, et al. Group B streptococcus late-onset disease: 2003-2010[J]. Pediatrics, 2013, 131(2):e361-e368. |
| [17] | Lin FY, Weisman LE, Troendle J, et al. Prematurity is the majorrisk factor for late-onset group B streptococcus disease[J]. JInfect Dis, 2003, 188(2): 267-271. |
| [18] | Johri AK, Paoletti LC, Glaser P, et al. Group B Streptococcus:global incidence and vaccine development[J]. Nat RevMicrobiol, 2006, 4(12): 932-942. |
| [19] | 安晓霞. 新生儿无乳链球菌感染的研究进展[J]. 临床和实验医学杂志, 2012, 11(20): 1670-1671. |
| [20] | Taminato M, Fram D, Torloni MR, et al. Screening for groupB Streptococcus in pregnant women: a systematic review andmeta-analysis[J]. Rev Lat Am Enfermagem, 2011, 19(6): 1470-1478. |
| [21] | Prevention of perinatal group B streptococcal disease: apublic health perspective. Centers for Disease Control andPrevention[J]. MMWR Recomm Rep, 1996, 45(RR-7): 1-24. |
| [22] | Kolkman DG, Rijnders ME, Wouters MG, et al. Implementationof a cost-effective strategy to prevent neonatal early-onset groupB haemolytic streptococcus disease in the Netherlands[J]. BMCPregnancy Childbirth, 2013, 13: 155. |
| [23] | 斯悦, 申阿东, 杨永弘. 预防B 组链球菌感染的新策略[J].中华围产医学杂志, 2001, 4(1): 60-62. |
| [24] | Schrag SJ, Zell ER, Lynfield R, et al. A population-basedcomparison of strategies to prevent early-onset group Bstreptococcal disease in neonates[J]. N Engl J Med, 2002,347(4): 233-239. |
| [25] | Schrag SJ, Zywicki S, Farley MM, et al. Group B streptococcaldisease in the era of intrapartum antibiotic prophylaxis[J]. NEngl J Med, 2000, 342(1): 15-20. |
| [26] | Baker CJ, Byington CL, Polin RA. Policy statementrecommendationsfor the prevention of perinatal group Bstreptococcal (GBS) disease[J]. Pediatrics, 2011, 128(3): 611-616. |
| [27] | Van Dyke MK, Phares CR, Lynfield R, et al. Evaluation ofuniversal antenatal screening for group B streptococcus[J]. NEngl J Med, 2009, 360(25): 2626-2636. |
| [28] | Mario MJ, Valenzuela I, Vasquez AE, et al. Prevention of earlyonsetneonatal group B streptococcal disease[J]. Rev ObstetGynecol, 2013, 6(2): 63-68. |
| [29] | Creti R, Berardi A, Baldassarri L, et al. Characteristics ofneonatal GBS disease during a multicentre study (2007-2010)and in the year 2012[J]. Ann Ist Super Sanita, 2013, 49(4): 370-375. |
| [30] | Melin P, Efstratiou A. Group B streptococcal epidemiologyand vaccine needs in developed countries[J]. Vaccine, 2013, 31(Suppl 4): D31-D42. |
| [31] | Mclaughlin K, Crowther C. Universal antenatal group Bstreptococcus screening? The opinions of obstetricians andneonatologists within Australia[J]. Aust N Z J Obstet Gynaecol,2010, 50(5): 410-412. |
| [32] | Gilbert GL, Hewitt MC, Turner CM, et al. Epidemiologyand predictive values of risk factors for neonatal group Bstreptococcal sepsis[J]. Aust N Z J Obstet Gynaecol, 2002,42(5): 497-503. |
| [33] | Paccione KA, Wiesenfeld HC. Guideline adherence forintrapartum group B streptococci prophylaxis in penicillinallergicpatients[J]. Infect Dis Obstet Gynecol, 2013, 2013:917304. |
| [34] | Garland SM, Cottrill E, Markowski L, et al. Antimicrobialresistance in group B streptococcus: the Australianexperience[J]. J Med Microbiol, 2011, 60(Pt 2): 230-235. |
| [35] | Clifford V, Heffernan HM, Grimwood K, et al. Variation inerythromycin and clindamycin resistance patterns between NewZealand and Australian group B streptococcus isolates[J]. AustN Z J Obstet Gynaecol, 2011, 51(4): 328-332. |
| [36] | Blaschke AJ, Pulver LS, Korgenski EK, et al. Clindamycinresistantgroup B Streptococcus and failure of intrapartumprophylaxis to prevent early-onset disease[J]. J Pediatr, 2010,156(3): 501-503. |
| [37] | Neu J. Perinatal and neonatal manipulation of the intestinalmicrobiome: a note of caution[J]. Nutr Rev, 2007, 65(6 Pt 1):282-285. |
| [38] | Schrag SJ, Verani JR. Intrapartum antibiotic prophylaxis forthe prevention of perinatal group B streptococcal disease:experience in the United States and implications for a potentialgroup B streptococcal vaccine[J]. Vaccine, 2013, 31 (Suppl 4):D20-D26. |
| [39] | Bauserman MS, Laughon MM, Hornik CP, et al. Group BStreptococcus and Escherichia coli infections in the intensivecare nursery in the era of intrapartum antibiotic prophylaxis[J].Pediatr Infect Dis J, 2013, 32(3): 208-212. |
| [40] | Rappuoli R, Black S. Introduction: addressing the challenge ofgroup B streptococcal disease[J]. Vaccine, 2013, 31 (Suppl 4):D1-D2. |
| [41] | Rodriguez-Granger J, Alvargonzalez JC, Berardi A, et al.Prevention of group B streptococcal neonatal disease revisited.The DEVANI European project[J]. Eur J Clin Microbiol InfectDis, 2012, 31(9): 2097-2104. |
| [42] | Annati E, Roshani M, Arzanlou M, et al. Capsular serotypeand antibiotic resistance of group B streptococci isolated frompregnant women in Ardabil, Iran[J]. Iran J Microbiol, 2012,4(3): 130-135. |
| [43] | Madhi SA, Dangor Z, Heath PT, et al. Considerationsfor a phase-III trial to evaluate a group B Streptococcuspolysaccharide-protein conjugate vaccine in pregnant womenfor the prevention of early- and late-onset invasive disease inyoung-infants[J]. Vaccine, 2013, 31 (Suppl 4): D52-D57. |
 2014, Vol. 16
2014, Vol. 16