肺炎克雷伯菌(Klebsiella pneumoniae, Kp) 是新生儿重症监护室(NICU)新生儿定植和感染 的最常见的病原菌之一[ 1, 2 ]。近年来出现了泛耐药 的产肺炎克雷伯碳青霉烯酶(Klebsiella pneumoniae carbapenemase, KPC)的肺炎克雷伯菌(KPC-Kp) [ 3 ]。 2012 年 8 月我院 NICU 出现第 1 株 KPC-Kp 定植, 引起了我们的高度重视。由于 KPC-Kp 的定植是引 起其感染的先决条件[ 4 ],其广泛耐药也为临床治疗 带来极大困难,因此我们设计了该病例对照研究, 对 NICU 定植 KPC-Kp 的新生儿的特点进行分析, 了解定植 KPC-Kp 的危险因素,以减少该病原体相 关感染的发生。 1 资料与方法 1.1 研究对象
2012年8月至2013年4月北京协和医院 NICU 住院新生儿中有KPC-Kp 定植的新生儿9 例, 组成病例组。对同期 NICU 无 KPC-Kp 定植的新生 儿编号,以单纯随机抽样方式选取 18 例作为对照 组。 1.2 临床资料收集
收集研究对象的临床资料,包括性别、胎龄、 出生体重、住院天数、呼吸机使用天数、新生儿 期疾病、有创操作情况、抗生素使用情况、喂养 情况等。 1.3 标本采集
于新生儿入院即刻及住院期间每周 2 次,严 格无菌操作下采集咽、直肠拭子。 1.4 细菌培养、药敏测定
对咽、直肠拭子细菌培养阳性标本进行常 规鉴定及抗菌药物敏感性试验。抗菌药物纸片为 OXOID 公司产品,药敏试验培养基用MH 琼脂 为 OXOID 公司产品。菌株鉴定和药敏试验采用 法国生物梅里埃公司的 VITEK 系统或 API 系统鉴 定,采用美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)推荐的纸片扩 散法做药敏试验[ 5 ]。产 KPC 的鉴定方法为改良霍 奇试验(Modified Hodge Test) [ 5, 6 ],阳性质控菌株 为肺炎克雷伯菌 ATCC BAA 1705,阴性质控菌株 为肺炎克雷伯菌 ATCC BAA 1706,同时检测金属 酶以及超广谱 β-内酰胺酶。 1.5 KPC-Kp 定植和感染的判断标准
KPC-Kp定植:咽拭子或肛门拭子培养出 KPC-Kp,但无相应的临床症状。KPC-Kp 感染: 在无菌部位(如血液、尿液、脑脊液等)培养出 KPC-Kp 或有感染的临床表现同时咽拭子或肛门拭 子培养出 KPC-Kp,并且按照拭子培养细菌的药敏 结果治疗有效。 1.6 统计学分析
正态分布的连续变量以均数 ± 标准差(x±s) 表示,非正态分布的连续变量以中位数(四分位 间距)[P50(P25,P75)] 表示。应用成组t检验比 较正态分布的连续变量,应用 Spearsman 秩相关检 验比较非正态分布的连续变量,应用卡方检验及 Fisher 精确检验比较分类变量。通过 logistic 回归 行多因素分析,并计算优势比(OR)以及 95% 置 信区间(CI)。所用统计学软件为 SPSS(version 19; SPSS Inc., Chicago, IL),P<0.05 为差异有统计 学意义。 2 结果 2.1 基本情况
2012 年 8 月至 2013 年 4 月我院 NICU 住院新 生儿共 474 例,其中有 KPC-Kp 定植的新生儿(即 病例组)共 9 例,其中男 6 例,女 3 例,平均出 生胎龄为 29.0±3.8 周,最小出生胎龄为 25 周, 平均出生体重为 1 337±548 g,最小出生体重为 700 g。对照组 18 例,其中男 11 例,女 7 例,平 均出生胎龄为 32.4±2.7 周,最小出生胎龄为 26 周, 平均出生体重为 1 822±425 g,最小出生体重为 910 g。病例组中 2 例新生儿定植 KPC-Kp 部位为 咽部,7 例定植 KPC-Kp 的部位为直肠。9 例定植 菌按月份分布为 2012 年 8 月 1 例,2012 年 10 月 1 例,2013 年 1 月 2 例,2013 年 2 月 2 例,2013 年3月2例,2013年4月1例。病例组9例定植 的 Kp 改良霍奇试验阳性,同时检测金属酶以及超 广谱 β-内酰胺酶均阴性。KPC-Kp 抗菌药物敏感 性试验提示对头孢菌素类、碳青霉烯类、β 内酰 胺类 /β 内酰胺抑制剂均耐药,仅对氨基糖苷类抗 生素、替加环素敏感。 2.2 危险因素分析
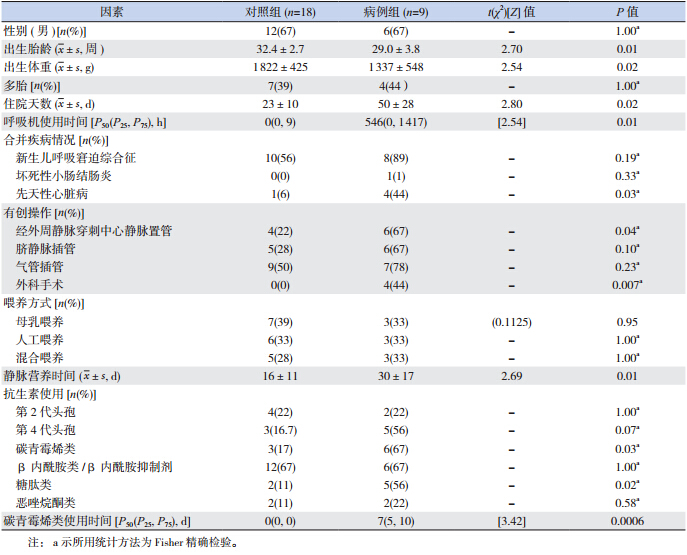
对病例组和对照组比较单因素分析有统计学 意义的因素有:出生胎龄(P=0.01)、出生体重 (P=0.02)、住院天数(P=0.02)、呼吸机使用时 间(P=0.01)、合并先天性心脏病(P=0.03)、经 外周静脉穿刺中心静脉插管(P=0.04)、外科手术 (P=0.007)、静脉营养时间(P=0.01)、使用碳 青霉烯类抗生素(P=0.03)、碳青霉烯类抗生素使 用时间(P=0.0006)、使用糖肽类抗生素(P=0.02) (表 1)。将单因素分析中有统计学意义的变量进 行 logistic 多因素回归分析,结果显示碳青霉烯类 抗生素使用时间(>4 d)是 NICU 新生儿定植 KPCKp 的独立危险因素(OR=18.7,95%CI 1.98~175.5, P=0.01)。
| 表 1 NICU 新生儿定植 KPC-Kp 的单因素分析 |
对出现 KPC-Kp 定植的新生儿立即单独房间 隔离,专人护理,接触时穿隔离衣、戴手套,听 诊器、软尺、温度计等物品专用,其使用过的暖箱、 呼吸机严格消毒。每天对 NICU 物品表面清洁消毒, 特别是医务人员经常接触的生命监护仪、输液泵、 呼吸机、计算机键盘和鼠标、电话等。强化医务 人员对耐药菌的感染控制的认识,严格执行手卫 生,且定期对 NICU 物品表面及医护人员的手部进 行细菌培养。加强抗生素使用的管理,减少碳青 霉烯类抗生素使用。持续对定植 KPC-Kp 的新生儿 每周 2 次监测,直到耐药菌消失,从发现 KPC-Kp 定植到该菌消失的时间最短 10 d,最长 42 d。定 植KPC-Kp 的新生儿中1 例发生了该定植菌的感染, 按照药敏选用阿米卡星治疗后痊愈。病例组和对 照组均无死亡病例。2013 年 5 月至 2014 年 6 月间 对 NICU 的住院患儿连续进行定植菌监测未再出现 KPC-Kp。 3 讨论
碳青霉烯类抗生素是治疗对头孢菌素类、β 内酰胺类抗生素耐药的肠杆菌的重要抗生素。近 年来随着该类药物在临床应用的增多,在全球范 围内耐碳青霉烯类抗生素的 Kp 的报道激增,尤其 是在重症监护室的病人更易定植或感染该菌[ 7 ]。此 病原菌引起的相关感染有很高的病死率,而可供 选择的抗生素非常有限,仅部分对甘氨酰四环素 类抗生素(替加环素)、氨基糖苷类抗生素(如 阿米卡星)、多粘菌素敏感[ 8 ],但这些抗生素在新 生儿特别是早产儿的应用受限,因此对 NICU 医师 是巨大的挑战。尽管由定植到感染的触发因素以 及机制尚不明确,但 KPC-Kp 的定植是引起其感染 的先决条件[ 4 ] 。因此对 KPC-Kp 的定植的新生儿的 特点进行分析,了解其定植的危险因素,对 NICU 感染控制非常重要。
Kp 对耐碳青霉烯类抗生素耐药的机制包括: 碳青霉烯酶的产生(主要包括 KPC、金属酶)、 超广谱 β 内酰胺酶合并外膜蛋白的丢失、细菌主 动泵出系统的活跃,其中 KPC 是 Kp 对耐碳青霉 烯类抗生素耐药最主要的机制 ,该酶具有水解碳 青霉烯类、头孢菌素类、β 内酰胺类抗生素的能 力[ 7 ]。病例组 9 株 Kp 均为改良霍奇试验阳性,金 属酶阴性,超广谱 β 内酰胺酶阴性,即病例组定 植的 Kp 耐药的机制为产生了 KPC,药敏试验提示 对头孢菌素类、碳青霉烯类、β 内酰胺类 /β 内 酰胺抑制剂均耐药。
目前有关 NICU 定植 KPC-Kp 的危险因素的报 道甚少,既往有关成人定植或感染 KPC-Kp 危险因 素分析的报道认为:抗生素的使用特别是碳青霉 烯类抗生素、广谱头孢类抗生素、喹诺酮类抗生 素是引起该病原体定植或感染的主要危险因素, 其他因素包括手术、肿瘤、器官移植、机械通气、 静脉导管、脏器功能不全或严重疾病[ 4, 9, 10, 11, 12, 13 ]。目前 未见有关 NIUC 新生儿定植 KPC-Kp 的危险因素的 报道,本研究显示碳青霉烯类抗生素使用 >4 d 是 新生儿定植 KPC-Kp 的独立危险因素,而使用碳青 霉烯类抗生素并非独立危险因素。病例组中新生 儿胎龄小、住院时间长、有创操作多可能会增加 了使用碳青霉烯类抗生素的时间。尽管病例对照 研究只能确定关联强度,不能进行因果推断,但 我们推测随着碳青霉烯类抗生素使用时间的延长 会促进细菌内在生成耐药机制激活或导致非敏感 菌株过度生长。
产 KPC 的质粒介导的 blaKPC 基因可以在 Kp 繁殖时水平传播,甚至通过其他传播给其他菌属, 如大肠埃希菌、铜绿假单胞菌等[ 14 ],有引起严重 医院感染的潜在危险。因此预防 KPC-Kp 的传播至 关重要,须加强对早产儿的主动监测。KPC-Kp 定 植或感染在新生儿中是一个少见但严重的问题, 目前国内相关报道较少见,也缺乏有效防治相关 资料。结合相关文献以及我们的经验,一旦发现 定植或感染 KPC-Kp 的新生儿应立即隔离,使用过 的暖箱、呼吸机等需严格消毒,对 NICU 物品表面 清洁消毒,强化医务人员对耐药菌的感染控制的 认识,严格执行手卫生,加强抗生素使用的管理, 减少碳青霉烯类抗生素使用[ 15, 16 ]。
本研究尚有不足之处,病例组病例数相对偏 少,这可能对分析危险因素的信度受限。另外, 与其他关于抗生素耐药的危险因素分析研究一样, 对照组和病例组是频数匹配,这样的好处是尽可 能发现危险因素,但病例组的病人可能会比对照 组的病情更重[ 17 ]。
较长时间使用碳青霉烯类抗生素是 KPC-Kp 定植的危险因素,因此应严格执行抗菌药物合理 使用的管理规定,将碳青霉烯类按照特殊使用类 抗菌药物进行管理,尽量减少其在 NICU 不必要的 使用。
| [1] | 徐焱, 王丹华, 徐英春. 新生儿重症监护病房中部分定植细菌定植特点及变化规律[J]. 临床儿科杂志, 2008, 26(3): 209-212. |
| [2] | 麦菁芸, 朱敏丽, 陈春, 等. 新生儿肺炎克雷伯菌败血症临床特点和药敏分析[J]. 中国当代儿科杂志, 2010, 12(9): 700-703. |
| [3] | Yigit H, Queenan AM, Anderson GJ, et al. Novel carbapenemhydrolyzing beta-lactamase, KPC-1, from a carbapenemresistant strain of Klebsiella pneumoniae [J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161. |
| [4] | Borer A, Saidel-Odes L, Eskira S, et al. Risk factors for developing clinical infection with carbapenem-resistant Klebsiella pneumoniae in hospital patients initially only colonized with carbapenem-resistant K. pneumonia[J]. Am J Infect Control, 2012, 40(5): 421-425. |
| [5] | Clinical and Laboratory Standards Institute (CLSI).M100-S20—Performance standards for antimicrobialsusceptibility testing[S]. 2010. |
| [6] | Carvalhaes CG, Picâo RC, Nicoletti AG, et al. Cloverleaf test(modified Hodge test) for detecting carbapenemase productionin Klebsiella pneumoniae: be aware of false positive results[J]. JAntimicrob Chemother, 2010, 65(2): 249-251. |
| [7] | Hidron AI, Edwards JR, Patel J, et al. NHSN annual update:antimicrobial-resistant pathogens associated with healthcareassociatedinfections: annual summary of data reported to theNational Healthcare Safety Network at the Centers for DiseaseControl and Prevention, 2006–2007[J]. Infect Control HospEpidemiol, 2008, 29(11): 996-1011. |
| [8] | Nordmann P, Cuzon G, Naas T. The real threat of Klebsiellapneumonia carbapenemase-producing bacteria [J]. Lancet InfectDis, 2009, 9(4): 228-236. |
| [9] | Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, et al.Predictors of carbapenem-resistant Klebsiella pneumoniaeacquisition among hospitalized adults and effect of acquisitionon mortality[J]. Antimicrob Agents Chemother, 2008, 52(3):1028-1033. |
| [10] | Orsi GB, García-Fernández A, Giordano A, et al. Risk factorsand clinical significance of ertapenem-resistant Klebsiellapneumoniae in hospitalised patients[J]. J Hosp Infect, 2011,78(1): 54-58. |
| [11] | Shilo S, Assous MV, Lachish T, et al. Risk factors for bacteriuriawith carbapenem-resistant Klebsiella pneumoniae and its impacton mortality: a case-control study[J]. Infection, 2013, 41(2):503-509. |
| [12] | Papadimitriou-Olivgeris M, Marangos M, Fligou F, et al. KPCproducingKlebsiella pneumoniae enteric colonization acquiredduring intensive care unit stay: the significance of risk factorsfor its development and its impact on mortality[J]. DiagnMicrobiol Infect Dis, 2013, 77(2): 169-173. |
| [13] | Kofteridis DP, Valachis A, Dimopoulou D, et al. Risk factorsfor carbapenem-resistant Klebsiella pneumoniae infection/colonization: a case-case-control study[J]. J Infect Chemother,2014, 20(5): 293-297. |
| [14] | Munoz-Price LS, Quinn JP. The spread of Klebsiella pneumoniacarbapenemases: a tale of strains, plasmids, and transposons[J].Clin Infect Dis, 2009, 49(11): 1739-1741. |
| [15] | Guh AY, Limbago BM, Kallen AJ. Epidemiology and preventionof carbapenem-resistant Enterobacteriaceae in the United States[J]. Expert Rev Anti Infect Ther, 2014, 12(5): 565-580. |
| [16] | 徐英春, 肖永红, 卓超, 等. 中国碳青霉烯类耐药肠杆菌科细菌的流行病学和防控策略[J]. 中国执业药师, 2013, 10(4):3-8. |
| [17] | Harris AD, Karchmer TB, Carmeli Y, et al. Methodologicalprinciples of caseecontrol studies that analyzed risk factors forantibiotic resistance: a systematic review [J]. Clin Infect Dis,2001, 32(7): 1055-1061. |
 2014, Vol. 16
2014, Vol. 16