万古霉素常用于治疗革兰阳性菌引起的严 重感染,尤其适用于耐甲氧西林金黄色葡萄球菌 (methicillin-resistant Staphylococcus aureus, MRSA) 引起的各种感染[ 1 ]。美国感染性疾病学会(IDSA) 在 2011 年指南中指出,儿童 MRSA 肺炎推荐静脉 使用万古霉素[ 2 ],对严重或侵袭性感染推荐使用 剂量为 15 mg/(kg · 次)×q6h(即总剂量为 60 mg/ (kg · d) [ 2 ]。同年,《万古霉素临床应用中国专家 共识》也提出治疗儿童革兰阳性菌严重感染(如 MRSA 肺炎、MRSA 中枢神经系统感染、MRSA 菌 血症和 / 或感染性心内膜炎、MRSA 骨关节感染 等)时万古霉素推荐剂量为15 mg/(kg · 次)× q6h,静脉滴注 [ 3 ]。IDSA 和中国指南均指出为保证 达到治疗严重感染的目标和提高临床治疗效果, 万古霉素血药谷浓度应达到 15~20 mg/L [ 2, 3 ]。但目 前国内研究报道中儿童万古霉素静脉使用剂量常 为 10 mg/(kg · 次)×q6h[ 4, 5, 6, 7 ],其中 80% 以上患儿 万古霉素血药谷浓度 <10 mg/L [ 4, 5, 6 ]。为提高临床认 识,本研究回顾性分析我院 35 例金黄色葡萄球菌 肺炎(Staphylococcus aureus pneumonia, SAP)患儿 万古霉素治疗及其血药浓度监测资料。 1 资料与方法 1.1 研究对象
研究对象为 2008 年 1 月至 2013 年 12 月于 重庆医科大学附属儿童医院使用万古霉素治疗的 SAP 患儿 35 例,金黄色葡萄球菌(Staphylococcus aureus, SA)分离自血液或胸腔积液,并且均进行 了药敏试验,其中 13 例鉴定为 MRSA。其中男 21 例,女 14 例。年龄 2~190 个月,中位数为 111 个月, 其中1~6 月龄4 例,7~36 月龄6 例,≥37 月龄25 例。 3 例患先天性心脏病,14 例用药前肝功能异常。 1.2 用药方案
注射用盐酸万古霉素(稳可信,500 mg/ 支, 生产企业:Eli Lilly Japan K.K, Seishin Laboratories, 药品注册证号:H20080356)。按稳可信药品说明 书和指南推荐[ 2, 3 ] 儿童常规用药10~15 mg/(kg · 次 ), 输注时间至少 1 h,每 6 h 给药 1 次;重症感染可 推荐负荷剂量为 20~25 mg/kg,并根据情况调整 [ 3 ]。 1.3 血药浓度监测
万古霉素第 5 次给药后 0.5~1 h 留取静脉血标 本 2 mL 监测其峰浓度,在第 4 次或第 5 次给药前 0.5 h 留取静脉血标本 2 mL 监测其谷浓度,标本 统一送至药剂科进行检测。采用美国雅培公司的 Abbott AxSYM 自动免疫分析仪及相应试剂进行血 药浓度检测。将指南[ 3 ] 推荐谷浓度为 10~20 mg/L 定义为预计谷浓度。 1.4 分组
按万古霉素治疗剂量分为 4 组:10、12.5、15 和 20 mg/(kg · 次)组,比较不同治疗剂量下患儿 血药浓度是否存在差异。按年龄分为 3 组:1~6 月 龄组、7~36 月龄组和≥ 37 月龄组,比较不同年龄 段患儿在相同治疗方案下血药浓度是否存在差异。 按用药前肝功能正常与否分为肝功能正常组与肝 功能异常组,比较两组患儿在相同治疗方案下血 药浓度是否存在差异。按照是否存在先天性心脏 病将患儿分为先天性心脏病组及无先天性心脏病 组,比较两组患儿在相同治疗方案下血药浓度是 否存在差异。 1.5 统计学分析
所有数据应用 SPSS 19.0 统计软件处理。经分 析计量数据不符合正态分布,故采用中位数(四 分位数间距)[P50(P25,P75)] 进行描述,计数资 料用百分率(%)表示。计量资料中多组间及多组 后的两两比较采用秩和检验;计数资料采用χ 2检 验或Fisher 精确检验。P<0.05 为差异有统计学意义。 2 结果 2.1 治疗用药监测情况
35 例使用万古霉素治疗的SAP 患儿22 例 (63%)进行了谷浓度监测,7 例达到预计谷浓度, 15 例(43%)未达到预计谷浓度(其中 13 例调整 了治疗剂量)。15 例(68%)患儿于第 5 次给药 前进行万古霉素血药谷浓度测定,3 例(14%)于 第 4 次给药前监测了血药浓度,4 例(18%)在用 药 2 d 后才测定万古霉素血药谷浓度。 2.2 不同治疗剂量组的万古霉素谷浓度
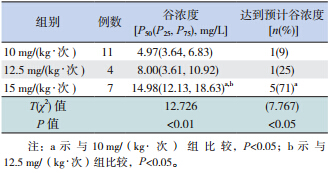
22 例监测了谷浓度的患儿中,治疗剂量为 10、12.5 和 15 mg/(kg · 次)×q6h 分 别 有 11、4 和 7 例,无患儿治疗剂量达到 20 mg/(kg · 次)。 不同剂量组间平均万古霉素谷浓度差异有统计学 意义,其中 15 mg/(kg · 次)组平均谷浓度显著高 于 10 mg/(kg · 次)组和 12.5 mg/(kg · 次)组(分 别T=76.000,P<0.01;T=26.000,P<0.05),而 12.5 mg/(kg · 次)组和 10 mg/(kg · 次)组平均谷 浓度差异无统计学意义(T=29.000,P>0.05),见 表 1。
| 表 1 不同初始剂量组患儿血药谷浓度的比较 |
不同剂量组达到万古霉素预计谷浓度的百分 比差异有统计学意义,其中 15 mg/(kg · 次)组达 到预计谷浓度的百分比显著高于 10 mg/(kg · 次) 组(P<0.05),与 12.5 mg/(kg · 次)组比较差异 无统计学意义(P>0.05),见表 1。 2.3 年龄、肝功能、先天性心脏病对患儿万古霉 素血药浓度的影响
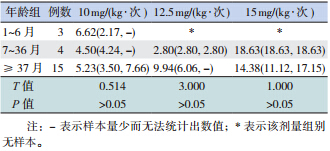
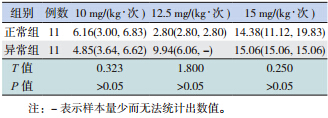
不同年龄组 SAP 患儿使用相同剂量万古霉素 时血药浓度分布差异无统计学意义(表 2)。用药 前肝功能异常与正常组使用相同剂量万古霉素时, 万古霉素血药浓度差异亦无统计学意义(表 3)。
| 表 2 年龄、肝功能、先天性心脏病对患儿万古霉 素血药浓度的影响 |
| 表 3 肝功能对患儿万古霉素谷浓度的影响 |
本研究中有 3 例伴先天性心脏病的患儿,万 古霉素使用剂量均为 10 mg/(kg · 次),其万古霉 素谷浓度与不伴先天性心脏病患儿组比较差异无 统计学意义(T=10.000,P>0.05)。 2.4 不良反应
35 例使用万古霉素治疗的患儿中,1 例出现 全身猩红热样皮疹,停止输注药物后自行消退(此 例未测谷浓度);1 例 6 月龄女性患儿使用万古霉 素 15 mg/(kg · 次)治疗 7 d 后出现肝功能损害, 其谷浓度为 9.14 mg/L,减量至 10 mg/(kg · 次), 12 d 后肝功能恢复正常。
比较 35 例患儿使用万古霉素治疗前后生化指 标的差异,包括总胆红素、直接胆红素、谷丙转 氨酶、谷草转氨酶、尿素氮、肌酐以及胱氨酸蛋 白抑制剂 C,未发现有统计学意义的改变。 3 讨论
国内指南[ 3 ] 推荐万古霉素血药谷浓治疗窗 为 10~20 mg/L;对于复杂性感染,谷浓度应达到 15~20 mg/L,以保证达到治疗目标和提高临床疗效。 本研究中,治疗剂量为每次 15 mg/kg 组的平均谷 浓度显著高于 10 mg/kg 组和 12.5 mg/kg 组,达到治 疗窗的比例为 71%,显著高于 10 mg/kg 组,也高 于 12.5 mg/kg 组。上述结果提示临床治疗 SAP 患 儿使用万古霉素的初始剂量以 15 mg/(kg · 次)× q6h [即 60 mg/(kg · d)] 较为合理,稳可信药品说 明书推荐的儿童剂量,以及既往研究报告[ 4, 5, 6, 7 ]中的 剂量 [40 mg/(kg · d)] 可能偏小。此外,本结果还 显示在相同剂量下,患儿年龄、是否合并先天性 心脏病或肝功能异常等因素对万古霉素血药浓度 无显著影响,提示确定 SAP 患儿万古霉素治疗剂 量时可能无需担心上述因素的影响。
目前国内临床上监测万古霉素血药浓度还是 以谷浓度监测为主。万古霉素监测方法中,谷浓 度监测和群体药代动力学法相对简单实用;而单 室模型法和贝叶斯反馈法对人员要求较高,给药 的准确性也更高[ 8 ],欧美和日本已开展采用群体药 代动力学法模型给药,并结合贝叶斯反馈法进行 给药精准性的研究[ 9, 10, 11, 12 ],现已开发成软件用于临床。 我国也应积极将药代动力学法或贝叶斯反馈法运 用于临床,更加准确地帮助临床医生调整给药剂 量。同时,IDSA 指南[ 2 ] 中还指出对于需长疗程使 用大剂量万古霉素维持血药谷浓度在 15~20 mg/L 的患者,以及肾功能不全、新生儿等特殊群体, 应同时进行血药峰、谷浓度监测。
本研究中仅有 63% 的 SAP 患儿行万古霉素谷 浓度监测,提示还需要加强对 SAP 患儿万古霉素 谷浓度的监测。万古霉素经过 4 个半衰期后可达 到稳态浓度,指南[ 3 ] 推荐给药后 3~4 个维持剂量 时监测血药浓度,而本研究中 SAP 患儿仅有 14% 于第 4 次给药前测定万古霉素血药谷浓度,18% 在用药 2 d 后才测定万古霉素血药谷浓度。叶志康 等[ 13 ] 分析国内万古霉素治疗药物监测现状,发现 57.1% 的医院给药后 2 d 才首次测定万古霉素谷浓 度,提示临床医生还应进一步提高对万古霉素血 药浓度监测的认识。万古霉素达到治疗浓度的时 间快慢与疗效相关[ 14 ],及时监测血药浓度,有利 于及时调整剂量,尽早达到有效浓度,提高疗效。
药物不良反应也是临床医师用药尤为关注的 一个问题。本组 SAP 患儿使用万古霉素治疗不 良反应较少,未发现明显肾功能损害或听力损害 者。据报道,儿童万古霉素相关肾损害发生率为 14%~27.2% [ 15, 16 ],肾毒性发生率随着万古霉素血药 谷浓度≥ 15 mg/L 时显著增高 [ 16 ]。目前没有足够 证据显示使用万古霉素是药物性肝损伤的危险因 素[ 17 ]。但临床使用万古霉素治疗时仍需注意监测 患儿一般情况及实验室相关指标以保证其应用的 合理性与安全性。
综上所述,以万古霉素 15 mg/(kg · 次)× q6h 治疗儿童 SAP,能获得较高平均谷浓度,大多 数患儿能达到谷浓度治疗窗。由于万古霉素属于 限制级抗生素,且本资料来自于一家医院,同时, 囿于药瓶说明书和文献报告,本研究积累的病例, 尤其剂量为 12.5 mg/(kg · 次)和 15 mg/(kg · 次) 组的病例还很少,统计学处理有效性受限。因此, 本研究内容还需进一步完善和论证,期待国内多 中心合作研究提供更可靠的证据。
| [1] | 李家泰. 临床药理学 [M]. 第3 版. 北京:人民卫生出版社,2007: 1024-1027. |
| [2] | Liu C, Bayer A, Cosgrove SE, et a1. Clinical practice guidelinesby the infectious diseases society of America for the treatmentof methicillin-resistant Staphylococcus aureus infections inadultsand children[J]. Clin Infect Dis, 2011, 52(3): 285-292. |
| [3] | 万古霉素临床应用中国专家共识(2011 版)[J]. 中国新药与临床杂志, 2011, 30(8): 561-573. |
| [4] | 张海霞, 杨智, 何莉梅, 等. 235 例儿童万古霉素血药浓度与不良反应分 [J]. 实用药物与临床, 2013, 16(12): 1200-1203. |
| [5] | 彭敏, 邓楠, 韦鸿雁, 等. 某院儿童住院患者万古霉素血药浓度监测及临床应用分析 [J]. 中国抗生素杂志, 2013, 38(10):795-798. |
| [6] | 李秀娟. 万古霉素血药浓度对儿科临床疗效的研究 [J]. 临床合理用药杂志, 2013, 6(33): 39-43. |
| [7] | 王丹, 刘春峰. 重症感染患儿万古霉素血药浓度分布特点分析 [J]. 中国实用儿科杂志, 2013, 28(11): 851-853. |
| [8] | Avent ML, Vaska VL, Rogers BA, et al. Vancomycintherapeutics and monitoring: a contemporary approach[J]. InternMed J, 2013, 43(2): 110-119. |
| [9] | Sanchez JZ, Dominguez AR, Lane JR, et al. Populationpharmacokinetics of vancomycin in adult and geriatric patients:comparison of eleven approaches[J]. Int J Clin Pharmacol Ther,2010, 48(8): 525-533. |
| [10] | Pea F, Bertolissi M, Di Silvestre A, et al. TDM coupled withBayesian forecasting should be considered an invaluable tool foroptimizing vancomycin daily exposure in unstable critically illpatients [J]. Int J Antimicrob Agents, 2002, 20(5): 326-332. |
| [11] | Nunn MO, Corallo CE, Aubron C, et al. Vancomycin dosing:assessment of time to therapeutic concentration and predictiveaccuracy of phmrmacokinetic modeling software[J]. AnnPharmacother, 2011, 45(6): 757-763. |
| [12] | Hiraki Y, Onga T, Mizoguchi A, et al. Investigation of theprediction accuracy of vancomycin concentrations determinedby patient-specific parameters as estimated by Bayesiananalysis[J]. J Clin Pharm Ther, 2010, 35(5): 527-532. |
| [13] | 叶志康, 李晓光, 翟所迪. 中国万古霉素治疗药物监测现况研究 [J]. 中国临床药理杂志, 2013, 29(7): 545-548. |
| [14] | Jeffres MN, Isakow W, Doherty JA, et al. Predictors of mortalityfor methicillin-resistant Staphylococcus aureus health-careassociatedpneumonia: specific evaluation of vancomycinpharmacokinetic indices[J]. Chest, 2006, 130(4): 947-955. |
| [15] | Ragab AR, Al-Mazroua MK, Al-Harony MA, et al. Incidenceand predisposing factors of vancomycin-induced nephrotoxicityin children[J]. Infect Dis Ther, 2013, 2(1): 37-46. |
| [16] | McKamy S, Hernandez E, Jahng M, et al. Incidence andrisk factors influencing the development of vancomycinnephrotoxicity in children[J]. J Pediatr, 2011, 158(3): 422-426. |
| [17] | Chen Y, Yang XY, Zeckel M, et al. Risk of hepatic events inpatients with vancomycin in clinical studies: a systematic reviewand meta-analysis[J]. Drug Saf, 2011, 34(1): 73-82. |
 2014, Vol. 16
2014, Vol. 16