肺炎链球菌是人类重要的致病菌,可引起呼 吸道感染、菌血症、脑膜炎等,尤其肺炎仍然是 5 岁以下儿童因感染死亡的重要原因 [ 1 ]。抗生素 在细菌感染治疗中起到关键作用。但是近年来由 于耐药菌株的出现及迅速传播,给儿童呼吸道感 染的治疗造成了极大困扰。肺炎链球菌结合疫苗 (pneumococcal conjugated vaccine, PCV)上市后, 监测数据表明普遍接种 PCV 可降低肺炎链球菌感 染的疾病负担[ 2 ]。本研究调查北京儿童医院门诊呼 吸道感染儿童鼻咽拭子肺炎链球菌分离状况,并 监测分离株血清型和抗生素耐药性,供临床用药 和疫苗免疫决策时参考。 1 资料与方法 1.1 研究对象及标本采集
研究对象为2013年3月至2014年2月在北 京儿童医院门诊就诊的上呼吸道感染儿童,患儿 均有发热等症状。每天采集标本数为 10~20 例, 共采集了 2 941 份鼻咽拭子标本。患儿年龄为 1 月 龄至 16 岁,其中男 1 741 例,女 1 200 例。标本采 集均经监护人同意。标本采集后立即放入脱脂奶 粉 - 胰蛋白胨 - 葡萄糖 - 甘油(skim milk-tryptoneglucose-glycerol, STGG)转运培养基,2 h 内送至实 验室培养。 1.2 细菌分离、培养和鉴定
将鼻咽拭子标本放入CO2 孵育箱孵育, 35℃,4 h,然后震荡 10~20 s,取 40 μL 液体转种 于 5% 脱纤维羊血 TSA 琼脂(Oxoid,英国)平板上, 35℃ 5%CO2过夜孵育。挑草绿色溶血可疑菌落, optochin 纸片试验和全价血清凝集试验阳性鉴定为 肺炎链球菌[ 3 ]。 1.3 血清分型
随机数字法选择 100 株进行血清分型和抗生 素耐药性检测。使用相差显微镜观察荚膜肿胀反 应进行血清分型。分型血清为肺炎链球菌棋盘式 分型系统(Pneumotest kits)和因子分型血清(Statens Serum Institut,丹麦) [ 4 ]。本研究能检测出的血清 型为 23 价多糖疫苗包括的型别(1、2、3、4、 5、6B、7F、8、9N、9V、10A、11A、12F、14、 15B、17F、18C、19A、19F、20、22F、23F 和 33F 型) 和 6A、6C 和 6D 型,其他不能确定的型别暂归为 不能分型。 1.4 抗生素敏感性试验
采用 Etest(AB Biodisk,瑞典)方法检测菌 株对 12 种抗生素的敏感性,包括:青霉素、阿莫 西林 / 棒酸、头孢克洛、头孢呋辛、头孢曲松、亚 胺培南、红霉素、阿奇霉素、四环素、甲氧苄啶 -磺胺甲噁唑、左氧氟沙星和氯霉素。判断标准采 用 CLSI 2012 版 [ 5 ]。为了与既往研究资料比较,对 口服和胃肠外(非脑膜炎)青霉素两种界值的判 定结果都做了描述。对 3 种或 3 种以上抗生素耐 药定义为多重耐药。 1.5 统计学分析
采用 SPSS 16.0 统计软件进行统计学分析。采 用软件 WHONET 5.3 进行抗菌药物敏感性分析。 计数资料用百分率(%)表示,组间比较采用χ 2 检验或 Fisher 精确概率法。P<0.05 表示差异有统 计学意义。 2 结果 2.1 携带率
2 941 份鼻咽拭子标本中,分离出肺炎链球菌 699 株,携带率为 23.8%(699/2 941)。肺炎链球 菌携带率高峰出现在 4 月,达 36.6%;此后渐降 低至 8、9 月,最低值 15.7%;以后再逐渐升高, 11、12 月出现第二次分离率高峰,均在 28% 以上。 各个月份的肺炎链球菌分离率见图 1。 不同年龄段上呼吸道感染儿童鼻咽部携带肺 炎链球菌状况见图 2。5 岁及 5 岁以下儿童携带率 均超过 20%,4 岁组儿童携带率最高,为 38.6%, 以后随着年龄增长携带率降低。
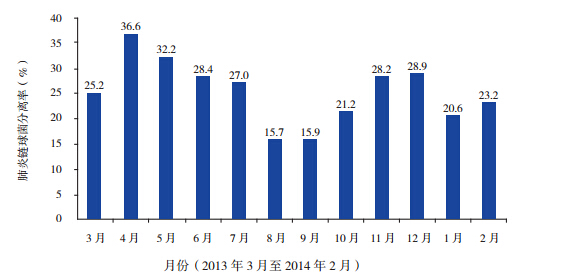 |
图 1 各月上呼吸道感染儿童鼻咽部肺炎链球菌分离率 |
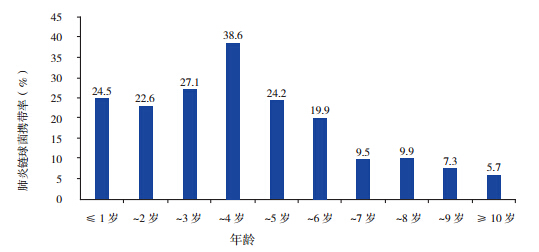 |
图 2 不同年龄段上呼吸道感染儿童鼻咽部携带肺炎链球菌状况 |
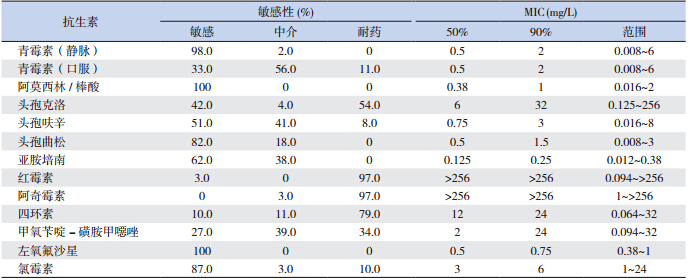
100 株肺炎链球菌对青霉素等抗生素的敏感 性试验结果见表 1。所有菌株对阿莫西林 / 棒酸、 左氧氟沙星敏感。菌株对静脉用青霉素敏感率为 98.0%,对口服青霉素敏感率仅 33.0%;青霉素 对菌株的最小抑菌浓度(MIC)50和 MIC90分别 为 0.5 mg/L、2 mg/L。菌株对头孢克洛耐药率达 54.0%,没有菌株耐头孢曲松和亚胺培南,但中介 率分别达到 18.0% 和 38.0%。菌株耐红霉素和阿 奇霉素比率很高,不敏感率均达 97.0%;MIC50和 MIC90均在 256 mg/L 以上。多重耐药率为 86.0%, 71.0% 的菌株同时对大环内酯类、四环素和磺胺类 耐药。
| 表 1 100 株肺炎链球菌对青霉素等抗生素的敏感性 |
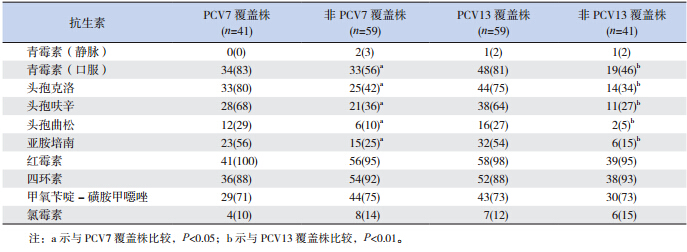
对 100 株肺炎链球菌进行血清型检测显示, 常见血清型为 6A(12 株,12.0%)、19F(12 株, 12.0%)、6B(10 株,10.0%)、23F(9 株,9.0%) 和 14 型(8 株,8.0%)。PCV7(19F、6B、23F、 14、18C、9V 和 4 型)、PCV10(PCV7+1、5 和 7F 型) 和 PCV13(PCV10+6A、19A 和 3 型)覆盖率分别 为 41.0%(41 株)、42.0%(42 株)和 59.0%(59 株)。非 PCV13 覆盖血清型包括 15B(5 株,5.0%)、 6C(4 株,4.0%)、23A(4 株,4.0%)和不能分 型(9 株,9.0%)。23 价荚膜多糖疫苗(PPV23) 覆盖率为 71.0%(71 株)。 2.4 PCV 覆盖菌株与非 PCV 覆盖菌株抗生素不敏感率比较
PCV13 覆盖菌株对口服青霉素、头孢菌素类 和亚胺培南的不敏感率明显高于非 PCV13 覆盖菌 株;PCV7 覆盖株与非 PCV7 覆盖株比较也具有相 似差异(表 2)。
| 表 2 100 PCV 覆盖菌株与非 PCV 覆盖菌株抗生素不敏感率(中介 + 耐药)比较[n(%)] |
肺炎链球菌常定植于儿童鼻咽部。本研究结 果显示我院门诊上呼吸道感染就诊儿童鼻咽部肺 炎链球菌携带率为 23.8%,明显低于前期本课题组 报告的数据(30%~40%)[ 6 ],可能主要与以下因素 有关:(1)本研究为 1 整年度的携带率调查研究, 既往研究多是在 11 月至次年 4 月开展。本研究结 果也显示了在不同月份儿童鼻咽部肺炎链球菌分 离率不同。(2)本研究纳入了门诊就诊的 18 岁 以下所有年龄段的儿童,既往研究仅采集 5 岁以 下儿童的标本。此次数据也显示了不同年龄段儿 童肺炎链球菌携带率的差异。4 岁组儿童携带率最 高,可能与该年龄段儿童处在进入托幼机构的初 期有关。
100 株肺炎链球菌中只有 2 株对静脉青霉素 不敏感(MIC 值分别为 3 mg/L 和 6 mg/L),但口 服青霉素不敏感率达 67.0%,明显高于 2000~2002 年的 18.0%~28.7%[ 7 ],与 2010 年的 55.0% 比较也 升高[ 8 ] 。另外,青霉素对肺炎链球菌的 MIC50和 MIC90分别达 0.5 mg/L 和 2 mg/L,而 2010 年的研 究结果显示两者分别为 0.25 mg/L 和 0.75 mg/L [ 8 ], 说明肺炎链球菌对青霉素的耐药性一直处于增强 的过程中。另外,值得注意的是多重耐药率高达 86.0%,与既往研究 [ 7, 8 ]相符。有的国家肺炎链球 菌多重耐药则较为少见,如俄罗斯只有 22%[ 9 ]。
本研究显示肺炎链球菌常见血清型为6A (12%)、19F(12%)、6B(10%)、23F(9%) 和14 型(8%),常见血清型基本符合本地区 2000 年以后的研究报告 [ 10 ],但具体比例有所不同。 本研究中 PCV7、PCV10 和 PCV13 3 种结合疫苗覆 盖率分别为 41.0%、42.0% 和 59.0%,与 2010 年 北京儿童医院 140 株鼻咽携带肺炎链球菌 3 种疫 苗的覆盖率(分别为 43.6%、43.6% 和 60.0%)[ 9 ] 吻合。既往研究显示,我国北方地区(如北京、 天津和沈阳)PCV7 覆盖率明显低于东南部城市(如 上海、广州和深圳)[ 10, 11 ]。因此,全国多中心研 究报告的疫苗覆盖率较本研究结果高。2006~2008 年北京儿童医院与全国 11 家儿童医院合作,收集 到 171 株侵袭性肺炎链球菌感染(IPD)的菌株, 第 16 卷 第 10 期 2014 年 10 月 中国当代儿科杂志 Chin J Contemp Pediatr Vol.16 No.10 Oct. 2014 ·992· 其 PCV7、PCV10 和 PCV13 覆盖率分别为 60.3%、 66.7% 和 87.8% [ 11 ]。结合疫苗上市以后,美国在本 土和非洲等地研究计划免疫 PCV 前后住院肺炎链 球菌肺炎的发病率变化,发现疫苗接种后 2 岁以 下儿童中发病减低了 65%,2~4 岁儿童中减低了 73% [ 12, 13 ]。我国目前 PCV7 接种率非常低,缺乏基 础发病资料,也缺少疫苗接种后相关疾病发病情 况的研究,无法评估疫苗使用效果。但从疫苗覆 盖率来看,PCV13 显然能获得更好的预防效果。
研究表明,接种 PCV 可使免疫人群鼻咽部疫 苗血清型肺炎链球菌携带下降、耐青霉素肺炎链 球菌携带下降和非疫苗型替换。疫苗接种可保护 接种人群,并可阻止病原播散,同时可减少抗生 素使用,减少细菌耐药的发生和扩散[ 14 ]。西班牙 是抗生素消费和肺炎链球菌对抗生素耐药率很高 的国家,1999 年肺炎链球菌对青霉素不敏感率为 33.9%,但其从 2004 年引进 PCV7,2008 年肺炎链 球菌分离株对青霉素的不敏感率下降到22.3% [ 15 ]。 本研究显示 PCV13 覆盖菌株对口服青霉素、头孢 菌素和亚胺培南不敏感率明显高于非 PCV13 覆盖 菌株,也提示推广计划免疫 PCV 对控制肺炎链球 菌抗生素耐药有积极意义。
| [1] | Scott JR, Millar EV, Lipsitch M, et al. Impact of more than adecade of pneumococcal conjugate vaccine use on carriage andinvasive potential in Native American communities[J]. J InfectDis, 2012, 205(2): 280-288. |
| [2] | Sharma D, Baughman W, Holst A, et al. Pneumococcal carriageand invasive disease in children before introduction of the13-valent conjugate vaccine: comparison with the era before7-valent conjugate vaccine[J]. Pediatr Infect Dis J, 2013, 32(2):e45-53. |
| [3] | 俞桑洁, 王辉, 沈叙庄, 等. 肺炎链球菌临床检验规程的共识[J]. 中华检验医学杂志, 2012, 35(12): 1-7. |
| [4] | Sørensen UB. Typing of pneumococci by using 12 pooledantisera[J]. J Clin Microbiol, 1993, 31(8): 2097-2100. |
| [5] | Clinical and Laboratory Standards Institute. M100-S22.Performance standards for antimicrobial susceptibility testing;Twenty-second informational supplement[S]. CLSI, 2012. |
| [6] | 俞桑洁, 佟月娟, 袁林, 等. 肺炎链球菌耐药性的监测[J]. 中华儿科杂志, 2001, 39(8): 492-493. |
| [7] | 姚开虎, 陆权, 邓力, 等. 2000-2002 年北京、上海和广州儿童肺炎链球菌携带及抗生素耐药性监测[J]. 中华医学杂志,2005, 85(28): 1957-1961. |
| [8] | Zhou L, Yu SJ, Gao W, et al. Serotype distribution and antibioticresistance of 140 pneumococcal isolates from pediatric patientswith upper respiratory infections in Beijing, 2010[J]. Vaccine,2011, 29(44): 7704-7710. |
| [9] | Mayanskiy N, Alyabieva N, Ponomarenko O, et al. Serotypesand antibiotic resistance of non-invasive Streptococcuspneumoniae circulating in pediatric hospitals in Moscow,Russia[J]. Int J Infect Dis, 2014, 20: 58-62. |
| [10] | Yao KH, Yang YH. Streptococcus pneumoniae diseases inChinese children: past, present and future[J]. Vaccine, 2008, 26(35): 4425-4433. |
| [11] | Xue L, Yao KH, Xie GL, et al. Serotype distribution andantimicrobial resistance of Streptococcus pneumoniae isolatesthat cause invasive disease among Chinese children[J]. ClinInfect Dis, 2010, 50(1) : 741-744. |
| [12] | Grijalva CG, Nuorti JP, Arbogast PG, et al. Decline inpneumonia admissions after routine childhood immunisationwith pneumococcal conjugate vaccine in the USA: a time-seriesanalysis[J]. Lancet, 2007, 369(9568): 1179-1186. |
| [13] | Cutts FT, Zaman SM, Enwere G, et al. Gambian PneumococcalVaccine Trial Group. Efficacy of nine-valent pneumococcalconjugate vaccine against pneumonia and invasivepneumococcal disease in the Gambia: randomised, double-blind,placebo-controlled trial[J]. Lancet, 2005, 365(9465): 1139-1146. |
| [14] | Dagan R. Impact of pneumococcal conjugate vaccine oninfections caused by antibiotic-resistant Streptococcuspneumoniae[J]. Clin Microbiol Infect, 2009, 3(15): 16-20. |
| [15] | Liñares J, Ardanuy C, Pallares R, et al. Changes in antimicrobialresistance, serotypes and genotypes in Streptococcuspneumoniaeover a 30-year period[J]. Clin Microbiol Infect,2010, 16(5): 402-410. |
 2014, Vol. 16
2014, Vol. 16