EB 病毒(Epstein-Barr virus,EBV)是一种嗜 人类淋巴细胞的疱疹病毒,1964 年由 Epstain、 Barr 等首次在非洲儿童的恶性淋巴瘤组织培养中 发现。EBV 在人群中感染非常广泛,人群感染率 超过90%,而且多发生在儿童时期。大多数EBV 的原发感染为急性感染(acute Epstein-Barr virus infection,AEBV),可无症状或表现为传染性单核 细胞增多症(infectious mononucleosis,IM)。少数 无明显免疫缺陷的个体,原发EBV 感染后病毒持 续活动性复制、不进入潜伏感染状态,或处于潜 伏感染状态下的EBV 可再次激活并且大量复制、 机体再次进入病理状态,表现为IM 症状持续存在 或退而复现,并发噬血细胞综合症、间质性肺炎、 视网膜眼炎、恶性肿瘤或多脏器损害、弥散性血 管内凝血等严重并发症,同时伴随EBV 抗体的异 常改变和病毒载量的增加,称为慢性活动性EB 病 毒感染(chronic active Epstein-Barr virus infection, CAEBV)[1]。目前该病的发病机制、诊断及治疗仍 是困扰儿科医生的一大难题,国内也有学者展开 了对该病的研究[2, 3]。本研究将我院收治的13 例 CAEBV 患儿的临床及实验室检查特征报告如下, 并与15 例AEBV 病例做对比研究,为国内儿科医 生提高对CAEBV 的认识作借鉴。 1 资料与方法 1.1 研究对象
我院2009 年8 月至2013 年5 月收治13 例 CAEBV 患儿,其中男性8 例,女性5 例,中位年 龄4 岁(1~14 岁),均符合2005 年Okano 等[4] 修 订的CAEBV 诊断标准:(1)持续或反复IM 样临 床表现:一般具有长期或反复发热、淋巴结肿大、 肝脾肿大,其他多种涉及血液系统、消化系统、 神经系统、肺部、心血管系统、眼睛、耳朵和皮 肤的临床表现和并发症,往往也可发生于IM 患 者;(2) 特定EBV 抗体谱:衣壳抗原(VCA)- IgG 抗体和早期抗原(EA)-IgG 抗体滴度显著升 高;和(或)受累组织(包括外周血)EBV 基因 拷贝数升高;(3)临床表现不能用其他慢性疾病 解释。必须同时满足上述3 条标准。此修订标准 不再强调病程大于6 个月。15 例AEBV 患儿作为 对照,其中男性4 例,女性11 例,中位年龄2 岁(3 个月至10 岁),全部病例符合诊断标准[5]: (1) 发热伴咽峡炎或淋巴结大或肝脾大的IM 样 症状,1 周左右的急性病程伴VCA-IgM 或外周血 中EBV-DNA 载量增高;(2)淋巴细胞大于50% 或异型淋巴细胞大于10%;(3) 排除其他感染。 必须同时满足上述3 条标准。
1.2 研究方法收集患儿临床表现、血常规、肝功能、病毒 抗体、外周血或骨髓中EBV-DNA、组织中EBV 包 被RNA(EBER)、外周血淋巴细胞亚群及影像学 等资料,分析CAEBV 患儿临床及实验室特征,并 进行随访,并比较其与AEBV 患儿的差异。 1.3 统计学分析
采用SPSS 20.0 统计软件对数据进行统计学分 析。计量资料以均数± 标准差(x±s)表示,两 样本间的均值的比较采用独立样本t 检验,当两样 本方差不齐时采用Mann-Whitney U 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 临床表现
CAEBV 组病例确诊前的病程为3~36 个月, 中位时间为10 个月。13 例患儿均有发热,11 例 肝脏肿大,8 例脾脏肿大,5 例淋巴结肿大,2 例 皮疹,其中1 例为蚊虫叮咬后牛痘样水疱疹,咳 嗽1 例,腹泻1 例。
AEBV 组病例为急性起病,确诊前的病程为 2~10 d,中位时间为5 d。13 例患儿有发热,12 例 肝脏肿大,8 例脾脏肿大,10 例淋巴结肿大,9 例 咽峡炎,6 例咳嗽,3 例皮疹,均为红色小丘疹。 2.2 一般实验室检查及其他辅助检查
CAEBV 组11 例患儿出现血液系统异常:6 例 全血细胞减少,4 例血二系减少,1 例贫血。11 例 出现不同程度的谷丙转氨酶(GPT)升高,8 例乳 酸脱氢酶(LDH)升高,6 例高胆红素血症。10 例 检测免疫球蛋白:IgG 升高4 例,降低1 例;IgA 升高3 例,降低2 例;IgM 降低3 例;IgE 升高4 例。 5 例出现心电图异常:2 例房室传导阻滞,1 例频 发室早伴房室传导阻滞,1 例房性早搏。4 例B 超 显示多浆膜腔积液。1 例胸部CT 提示间质性肺炎。
AEBV 组7 例患儿出现血液系统异常:3 例白细胞增高,2 例白细胞增高伴贫血,2 例血三系降 低。7 例出现不同程度的GPT 升高,13 例LDH 升 高,2 例高胆红素血症。15 例均检测免疫球蛋白: IgG 升高8 例,降低3 例;IgA 升高7 例,降低2 例; IgM 升高5 例,降低2 例;IgE 升高8 例。2 例出 现心电图异常:1 例T 波轻度改变,1 例右心室高 电压。2 例B 超显示多浆膜腔积液。
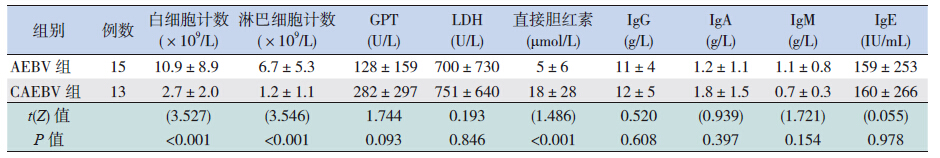
与AEBV 组患儿相比,CAEVB 组患儿外周 血白细胞计数、淋巴细胞计数降低,直接胆红素 增高( 均P<0.05),而GPT、LDH、IgG、IgA、 IgM、IgE 两组比较差异无统计学意义(表 1)。
| 表 1 两组一般实验室检查结果的比较 (x±s) |
对患儿进行的病毒学检查包括EBV 相关抗体、 外周血及骨髓EBV-DNA、肝活检组织中 EBER 的 检测。
13 例CAEBV 患儿VCA-IgM 为0.12~1.69 U/mL (参考值0~1.1 U/mL),其中仅1 例升高;VCAIgG 为83.2~200.5 U/mL(参考值0~22.0 U/mL),13 例均升高;EA-IgM 均阴性,EA-IgG 阳性1 例,核 抗原(NA)-IgG 阳性2 例。外周血EBV-DNA 检测 均为阳性,结果为1.1×103~5.4×105 拷贝/mL,中 位数为1.2×105 拷贝/mL。6 例行骨髓穿刺术,骨 髓EB-DNA 检测均为阳性,结果为1.0×103~1.1×107 拷贝/mL,中位数为3.5×105 拷贝/mL,其中3 例 明显高于血浆检测值,2 例稍高于血浆,1 例低于 血浆。4 例行肝脏穿刺活检术,肝组织中EBER 均 阳性。
15 例AEBV 患儿VCA-IgM 为0.2~1.89 U/mL (参考值0~1.1 U/mL),其中升高6 例;VCA-IgG 为19.8~200.5 U/mL(参考值0~22.0 U/mL),其中 升高14 例;EA-IgM 阳性11 例;EA-IgG 均阴性; NA-IgG 阳性4 例。外周血EBV-DNA 检测阳性7例,结果为1.0×103~7.8×105 拷贝/mL,中位数为 1.2×103 拷贝/mL。2 例行骨髓穿刺术,骨髓EBDNA 检测为阳性,结果分别为1.2×103、3.9×103 拷贝/mL,外周血检测均为阴性。无病例进行肝穿 刺活检。
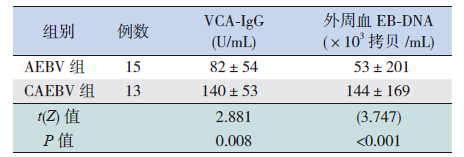
与AEBV 组患儿比较,CAEBV 组患儿VCAIgM 升高者极少,VCA-IgG 升高较AEBV 患儿明显, 外周血EBV-DNA 病毒载量较AEBV 患儿高(表 2)。
| 表 2 两组患儿VCA-IgG 和外周血EBV-DNA 病毒载量的比较 (x±s) |
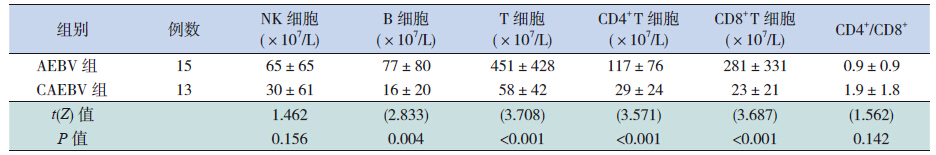
CAEBV 组外周血B 细胞计数、总T 细胞计数、 CD4+ T 细胞计数和CD8+ T 细胞计数均低于AEBV 组(P<0.01),而NK 细胞计数和CD4+/CD8+ 比值 两组比较差异无统计学意义(表 3)。
| 表 3 两组外周血淋巴细胞亚群的比较 |
随访1~42 个月,13 例CAEBV 患儿中,8 例 死亡,2 例好转(停止治疗半年后外周血病毒载量 持续阴性),2 例病情仍有反复(继续治疗中), 1 例转院后失访。15 例AEBV 患儿均治愈,随访1 年无病情反复。 3 讨论
CAEBV 的临床表现复杂多样,以持续或间断 发热、肝脾淋巴结肿大等IM 样表现为突出特征, 常见的表现还包括肝功能异常、全血细胞减少、 皮疹、蚊虫叮咬的变态反应、牛痘样水疱病、腹泻、 间质性肺炎、视网膜炎、腮腺炎、心肌炎等[6, 7]。 少见症状包括脑出血、舞蹈病、广泛性肌炎、肾 小球肾炎、肺动脉高压等,这些症状更常见于儿 童及青少年患者中[8]。本研究CAEBV 组患儿均有 发热,大部分患儿有肝脾淋巴结肿大、肝功能异 常、血细胞减少,还有皮疹、蚊虫叮咬的变态反应、 腹泻、间质性肺炎、多浆膜腔积液、心电图异常等, 未发现上述少见症状。AEBV 组患儿的临床表现与 其相似,故单从临床症状上区分CAEBV 和AEBV 比较困难,疾病表现是否持续或反复发生是两者 的鉴别点之一,蚊虫叮咬的变态反应和牛痘样水 疱病是前者的特征性皮疹表现。
EBV 抗体测定是CAEBV 诊断标准的重要组 成部分[4, 9]。CAEBV 患儿VCA-IgG 滴度多明显增高, 大部分EA-IgG 滴度增高,约20% 患儿 NA-IgG 滴度低下或阴性[10]。本研究发现CAEBV 组患儿 VCA-IgG 水平较AEBV 组明显升高,VCA-IgM、 EA-IgG、NA-IgG 偶有阳性表达,而EA-IgM 阳性 仅出现于AEBV 组。
虽然CAEBV 具有特定的EBV 抗体表达谱, 但部分患儿VCA-IgG 及EA-IgG 并不升高,可能 与机体对EBV 特异性免疫应答存在某些缺陷有 关[10, 11, 12],故目前认为抗体滴度改变并非诊断 CAEBV 的必要条件,而受累组织或外周血EBVDNA 和EBER 检测对诊断意义更大,反映体内 EBV 负荷[4, 10, 13]。尽管正常人外周血及组织中也存 在少量EBV-DNA,但CAEBV 患者的病毒载量更 高[6]。本研究发现CAEBV 患儿外周血EBV-DNA 载量明显增高,且高于AEBV 患儿,骨髓检测病毒载量更高于外周血,4 例肝脏活检标本EBER 均 阳性,证实CAEBV 确实存在病毒的大量复制, 检测外周血、组织中EBV-DNA 或EBER 是诊断 CAEBV 的有效手段。
AEBV 时EBV 感染的靶细胞为B 淋巴细胞, 但CAEBV 时EBV 主要感染T 细胞和NK 细胞。 CAEBV 情况下,EBV 感染T 细胞或NK 细胞一 般为潜伏感染方式,表达潜伏感染膜蛋白(latent membrane protein,LMP)2A 和2B,抑制其他病毒 蛋白表达,降低EBV 感染细胞的免疫原性,有助 于逃逸机体免疫监视,不被CD8+ 细胞毒性T 细胞 (CTLs)清除[14, 15]。有报道CAEBV 患儿EBV 特 异的CTL 数目和反应均降低或检测不到。本研究 中CAEBV 组患儿外周血CD4+ 和CD8+ T 细胞计数 均明显低于AEBV 组,可能导致EBV 感染后宿主 的正常免疫应答反应很弱或检测不到,感染EBV 的细胞不易被清除,从而引起疾病的慢性活动。 既然免疫逃逸是CAEBV 的发病机制,那么在治疗 上除了抗病毒外需强调改善或重建机体正常免疫 功能的重要性。
无论成人或儿童,CAEBV 预后均不佳,尤其 是出现严重并发症以及发病年龄在8 岁以下者预 后更差,半数以上CAEBV 患者从首发症状出现后 5 年内因严重并发症死亡[11]。北京儿童医院曾报 道53 例儿童CAEBV 病例,随访的42 例患者中, 26.2% 在发病后7 个月至3 年内死亡[7]。国外学者 有报道称CAEBV 患者随访8 个月至12 年病死率 为43%[1, 4]。本研究随访13 例CAEBV 患儿4 个月 至3 年,8 例(62%) 死亡,2 例(15%) 好转, 2 例(15%)病情仍有反复,1 例转院后失访,病 死率明显高于上述报道。异基因造血干细胞移植 (allogeneic hematopoietic stem cell transplantation, allo-HSCT)为目前CAEBV 根治性治疗手段之一, 不仅能消除EBV 阳性宿主细胞,也可重建EBV 特 异性细胞免疫功能[16] 。但由于allo-HSCT 相关并 发症是CAEBV 患者潜在的巨大风险和死亡原因, 必须综合考虑多种因素决定是否进行allo-HSCT。
| [1] | Maeda A, Sato T, Wakiguchi H. Epidemiology of Epatein-Barr virus (EBV) infection and EBV-associated diseases[J]. Nihon Rinsho, 2006, 64(3):609-612. |
| [2] | 宋红梅, 吴晓燕, 王薇, 等. 严重慢性活动性EB 病毒感染12 例临床回顾与随访[J]. 中华儿科杂志, 2009, 47(9):682-686. |
| [3] | 陆晓茜, 高举. 慢性活动性EBV 感染诊治进展[J]. 中国小儿 血液与肿瘤杂志, 2013, 18(5):198-200. |
| [4] | Okano M, Kawa K, Kimura H, et al. Proposed guidelines for diagnosing chronic active Epstein-Barr virus infection[J]. Am J Hematol, 2005, 80(1):64-69. |
| [5] | Wakiguchi H, Maeda A, Dohno S, et al. Infectious mononucleosis[J]. Nihon Rinsho, 2006, 64(3):625-629. |
| [6] | Kimura H, Hoshino Y, Kanegane H, et al. Clinical and virologic characteristics of chronic active Epstein-Barr virus infection[J]. Blood, 2001, 98(2):280-286. |
| [7] | Lu G, Xie ZD, Zhao SY, et al. Clincical analysis and followup study of chronic active Epstein-Barr virus infection in 53 pediatric cases[J]. Chin Med J, 2009, 122(3):262-266. |
| [8] | Hong M, Ko YH, Yoo KH, et al. EBV-positive T/NK-cell lymphoproliferative disease of childhood[J]. Korean J Pathol, 2003, 47(2):137-147. |
| [9] | Straus SE. The chronic mononucleosis syndrome[J]. J Infect Dis, 1988, 157(3):405-412. |
| [10] | 殷红梅, 谢正德, 申昆玲. 慢性活动性EB 病毒感染的研究 进展[J]. 临床儿科杂志, 2007, 25(2):153-156. |
| [11] | Yamashita N, Kimura H, Morishima T. Virological aspects of Epstein-Barr virus infections [J]. Acta Med Okayama, 2005, 59(6):239-246. |
| [12] | Bollard CM, Gottschalk S, Leen AM, et al. Complete responses of relapsed lymphoma following genetic modification of tumorantigen presenting cells and T-lymphocyte transfer [J]. Blood, 2007, 110(8):2838-2845. |
| [13] | Gartner B, Preiksaitis JK. EBV viral load detection in clinical virology[J]. J Clin Virol, 2010, 48(2):82-90. |
| [14] | Grywalska E, Markowicz J, Crabarczyk P, et al. Epstein-Barr virus-associated lymphoproliferative disorders[J]. Postepy Hig Med Dosw (online), 2013, 67(5):481-490. |
| [15] | Carbone A, Gloghinia A, Dotti G. EBV-associated lymphoproliferative disorders:classification and treatment[J]. Oncologist, 2008, 13(5):577-585. |
| [16] | Cohen JI, Jaffe ES, Dale JK, et al. Characterization and treatment of chronic active Epstein-Barr virus disease:a 28-year experience in the United States[J]. Blood, 2011, 117(22):5835-5849. |
 2014, Vol. 16
2014, Vol. 16