轻度胃肠炎伴婴幼儿良性惊厥(BICE)是 1982 年由日本学者Morooka 首次提出的。目前对 于BICE 的病因及发病机制尚无明确的定论。有的 学者考虑其发病机制同高热惊厥有一定的共性: 小儿的脑发育尚未成熟,在一定的诱因影响之下, 体内的环境受到了影响,引起大脑细胞异常放电 从而发生了惊厥[1]。硫化氢(H2S)是人们继一氧 化氮(NO)与一氧化碳(CO)之后所发现的又一 个气体信号传导分子,随着研究的深入,有越来 越多的证据显示,H2S 对于人体具有广泛的病理生理作用,内源性H2S 具有很强的抗氧化以及保护 神经的功能,并在惊厥的发生、发展过程中起着 重要的作用,但是内源性H2S 是否参与了 BICE 的 发病机制目前尚不清楚。本研究通过测定在我院 住院治疗的42 例BICE 患儿血清H2S 水平的变化, 分析其在BICE 病程中的意义及临床价值。 1 资料与方法 1.1 研究对象
2012 年1 月至2014 年1 月在我院确诊为 BICE 并住院治疗的42 例患儿作为观察组,其中男 22 例,女20 例,平均年龄1.7±1.2 岁。选择同期 因单纯急性胃肠炎入院治疗的46 例患儿为对照组, 其中男25 例,女21 例,平均年龄1.8±1.3 岁。 对照组患儿既往健康,发育正常,均无惊厥病史。 本研究经过了医院医学伦理委员会批准并均签署 了家属知情同意书。 1.2 诊断标准
BICE 的诊断标准[2]:(1)婴儿既往健康; (2)惊厥发作时不发热,可有轻度脱水,但无明 显酸中毒和电解质紊乱;(3)常发生在冬季急性 胃肠炎病程的第1~5 天;(4)惊厥基本形式为 全身强直—阵挛性发作,可为单次或多次发作; (5)发作间歇期脑电图正常;(6)血清电解质、 血糖、脑脊液常规检查正常。 1.3 静脉血的采集
在确诊后的24 h 内两组患儿用无抗凝干燥管 分别抽取静脉血2 mL,在室温下静置约30 min, 然后保持温度在4℃,离心分离血清后保存在-60℃ 的冰箱里。 1.4 H2S 的检测方法
在空试管中加入醋酸锌0.5 mL(10 g/L),然 后加入0.1 mL 解冻好的血清标本,充分振荡摇匀, 使血浆中的硫离子与醋酸锌结合形成硫化锌胶体, 再先后加入0.5 mL 的20 mmol/L 对苯二铵盐酸盐 以及0.4 mL 的30 mmol/L 三氯化铁溶液,在室温 下放置约20 min,之后加入三氯醋酸(100 g/L), 在蛋白沉淀后再加入去离子水使之定容至2.5 mL, 离心12 000 r/min,5 min,吸取上清液,使用分光 光度计在670 nm 处来测定吸光度值。最后根据 H2S 标准曲线计算出H2S 水平。以上试剂均购自美 国Sigma 公司。 1.5 统计学分析
应用SPSS 17.0 统计软件包进行统计分析, 计量资料用均数± 标准差(x±s)表示,组间 比较采用方差分析或成组t 检验。相关分析采用 Pearson 线性相关分析检验。P<0.05 为差异有统计 学意义。 2 结果 2.1 两组患儿血清H2S 水平的比较
观察组患儿血清H2S 水平显著低于对照组, 差异有统计学意义(P<0.O1),见表 1。
| 表 1 两组患儿血清H2S 水平的比较 |
BICE 患儿不同惊厥发作次数(< 2 次和≥ 2 次)患儿血清H2S 水平比较差异有统计学意义 (t=2.46,P=0.018)。不同惊厥持续时间(< 5 min 和≥ 5 min)患儿血清H2S 比较差异无统计学意义 (t=0.93,P=0.36)。见表 2。
| 表 2 不同惊厥发作次数、惊厥持续时间患儿血清H2S 水 平的比较 ( x±s,μmol/L) |
BICE 组患儿惊厥发作次数与血清H2S 水 平呈负相关(r=-0.485,P=0.001),见图 1; 惊厥持续时间与血清H2S 水平呈负相关性 (r=-0.457,P=0.002)。分组统计后显示,惊厥 持续时间<5 min 组患儿的发作时间与血清H2S 水平无明显相关性(r=0.135,P=0.486),惊厥持续 时间≥ 5 min 组患儿的发作时间与血清H2S 水平呈 负相关(r=-0.736,P=0.004),见图 2。
 |
图 1 惊厥发作次数与血清H2S 水平的关系 |
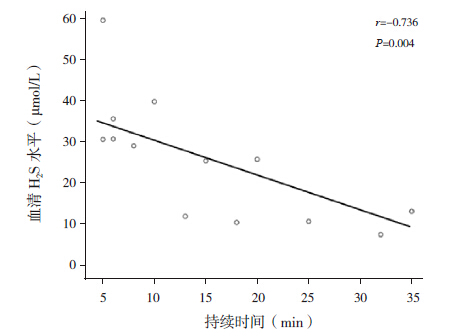 |
图 2 惊厥持续时间≥ 5 min 组患儿惊厥发作时间与 血清H2S 水平的关系 |
既往研究多数认为BICE 预后良好,并无后 遗症出现,但随着对BICE 研究的逐渐增多,对 BICE 的临床表现及预后有了较为深入的认知。有 研究报道在755 例轮状病毒肠炎患者中,17 例出 现了热性惊厥,42 例出现了无热惊厥,并且无热 惊厥发作的频率要比热性惊厥发作的频率显著增 高[3]。路新国等[4] 考虑BICE 在频繁惊厥发作时对 中枢神经元会造成损伤。国外有报道BICE 向癫癎 的转化率为2.3%,热性惊厥发生率为5.5%,复发 率为4.7%[5]。国内也有报道40 例BICE 患儿中1例进展为癫癎,另外有8 例在发作间期检测到癫 癎样放电[6]。
H2S 分子小,并且脂溶性较高,无需特异性的 载体就可以进出细胞膜来进行介导各种生物学效 应的特点。哺乳动物体内的H2S 主要是L- 半胱氨 酸的代谢,体内胱硫醚-β- 合成酶(CBS)同胱硫 醚-γ- 裂解酶(CSE)能裂解半胱氨酸产生H2S, 它们同属于磷酸吡多醛-5'- 磷酸依赖性酶,经过它 们的酶解催化是体内产生H2S 的主要途径[7]。大多 数的CBS 存在于中枢神经系统,在皮层、丘脑、 纹状体、海马、小脑的神经元胞体以及突起都有 表达。
韩颖等[8] 报道H2S 能够上调GABAB 受体。 H2S 上调GABA 受体可能对于维持大脑兴奋/ 抑 制平衡方面起重要的作用。生理浓度的H2S 可 以通过调节γ- 氨基丁酸受体以维持大脑神经元 兴奋/抑制的平衡状态[9]。Timm 染色结果显示 CBS 抑制剂hydroxylamine 干预后的海马发芽加 重,NaHS 干预后的海马苔藓纤维发芽减轻。海马 苔藓纤维发芽可引起基于轴突发芽基础上的新的 回返兴奋环路的形成和突触重构,从而引起突触 兴奋性的增高以及惊厥阈下降[10]。以上研究表明 H2S 的减少可以引起惊厥阈值的下降。有研究报道 H2S 可以抑制NOS 的酶活性,还可以降低NO 对 CGMP 的敏感性,从而使NO 产出减少[11]。有报道 NO 的代谢产物在轮状病毒所导致的BICE 患儿血 清以及脑脊液中升高,而在脑炎、化脓性脑膜炎、 热性惊厥及正常儿童中正常[12]。同时有研究报道 NO 可增加患儿对惊厥的敏感性[13]。基于以上研 究考虑体内H2S 水平下降可能会引起体内NO 水 平的升高,从而导致患儿易出现惊厥。Huang 等[2] 认为婴幼儿在急性胃肠炎或病毒血症状态下,惊 厥的发生与“惊厥阈值”降低有关。本研究显 示,BICE 组患儿血清H2S 水平较对照组明显降 低。从而可以推测,在BICE 患儿病程中,患儿体 内的CBS 受到抑制,致使内源性H2S 生成减少, 对NOS 的酶活性抑制减少,NO 合成增多,导致 BICE 患儿的惊厥阈值降低,容易诱发惊厥发作。
有研究报道H2S 可以通过增加抗氧化剂谷胱 甘肽的水平并且激活KATP 以及氯离子通道从而 保护神经细胞氧化应激,同时通过清除氧自由基 来保护神经元[14, 15]。有报道H2S 可直接清除氧自由基[16]。而氧自由基生成增多是氧化应激损伤脑 组织的重要的机制。H2S 可以通过抑制NO/NOS 体系,防止由于NO 过度增多所造成的自由基损 伤[9]。H2S 还可以通过舒张血管从而改善脑血液循 环[17]。有报道过度抑制缺血- 再灌注损伤初期大 鼠升高的H2S 可以加重脑损伤[18]。在脑损伤的早 期给予小剂量H2S 可以使内源性H2S 达到生理水 平,可以明显减轻脑损伤[19]。以上研究表明内源 性H2S 具有保护神经元的作用,提示体内H2S 的 水平与脑损伤的程度密切相关,而早期给予外源 性H2S 可以减轻脑损伤。本研究发现BICE 组患儿 血清H2S 水平显著低于对照组,惊厥发作次数与 血清H2S 水平呈负相关;在惊厥持续时间的分组 统计中,惊厥持续时间<5 min 组患儿的发作时间 与血清H2S 水平无明显相关性,而惊厥持续时间 ≥ 5 min 组患儿的发作时间与血清H2S 水平呈负相 关。考虑BICE 患儿惊厥持续时间大于5 min 后血 清H2S 水平存在随惊厥持续时间的延长而降低的 趋势。内源性H2S 水平与BICE 患儿惊厥发作的次 数以及持续时间有关。推测BICE 患儿惊厥发作早 期体内自由基大量产生,为清除体内大量的自由 基而过度消耗内源性H2S,导致体内的内源性H2S 进一步减少。而体内H2S 水平降低越明显,患儿 惊厥持续时间越长,惊厥发作次数越频繁,患儿 出现脑损伤的可能性越大。
血清 H2S 的检测对于判断BICE 的发生以及惊 厥持续时间、惊厥发作次数具有重要价值,其水 平降低程度对于预测BICE 患儿的预后也有一定的 参考价值。检测血清H2S 的操作简单方便,所需 费用较低,方便在医院普遍开展,建议在临床工 作中开展血清H2S 水平的检测。
| [1] | 吴惧, 甘晓玲, 姜舟, 等. 轻度胃肠炎伴婴幼儿良性惊厥24 例[J]. 实用儿科临床杂志, 2007, 22(12):914-915. |
| [2] | Huang CC, Chang YC, Wang ST. Acute symptomatic seizure disorders in young children:a population study in southern Taiwan [J]. Epilepsia, 1998, 39(9):960-964. |
| [3] | Kang B, Kim DH, Hong YJ, et al. Comparison between febrile and afebrile seizures associated with mild rotavirus gastroenteritis[J]. Seizure, 2013, 22(7):560-564. |
| [4] | 路新国, 廖建湘, 周桂芬, 等. 轻度胃肠炎伴发良性婴幼儿 惊厥30 例脑脊液中神经元特异性烯醇化酶检测分析[J]. 中 国实用儿科杂志, 2010, 25(12):948-949. |
| [5] | Verrotti A, Nanni G, Aqostinelli S, et al. Benign convulsions associated with mild gastroenteritis:a multicenter clinical study[J]. Epilepsy Res, 2011, 93(2-3):107-114. |
| [6] | 黄铁栓, 路新国, 李冰, 等. 轻度胃肠炎并婴幼儿良性惊厥 40 例临床分析[J]. 中国当代儿科杂志, 2010,12(7):533-535. |
| [7] | Stipanuk MH, Beck PW. Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat[J]. Biochem J, 1982, 206(2):257-277. |
| [8] | 韩颖, 秦炯, 常杏芝, 等. 发育期大鼠高热惊厥前后海马γ2 氨基丁酸β 受体亚基表达的变化[J]. 北京大学学报:医学版, 2003, 35(3):288-291. |
| [9] | Han Y, Qin J, Chang X, et a1. Modulating effect of hydrogen sulfide on gamma-aminobutyric acid B receptor in recurrent febrile seizures in rats[J]. Neurosci Res, 2005, 53(2):216-219. |
| [10] | Hassan H, Pohle W, Rüthrich H, et al. Repeated long-term potentiation induces mossy fiber sprouting and changes the sensibility of hippocampal granule cells to subconvulsive doses of pentylenetetrazol[J]. Eur J Neurosci, 2000, 12(4):1509-1515. |
| [11] | 韩颖, 秦炯, 常杏芝, 等. 反复热性惊厥过程中气体信号分 子硫化氢对一氧化氮/一氧化氮合酶体系的影响[J]. 中国病 理生理杂志, 2007, 23 (4):785-788. |
| [12] | Kawashima H, Inage Y, Ogihara M, et al. Serum and cerebrospinal fluid nitrite/nitrate levels in patients with rotavirus gastroenteritis induced convulsion[J]. Life Sci, 2004, 74(11):1397-1405. |
| [13] | Rejdak K, Eikelenboom MJ, Petzold A, et al. CSF nitric oxide metabolites are associated with activity and progression of multiple sclerosis[J]. Neurology, 2004, 63(8):1439-1445. |
| [14] | Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004, 18:1165-1167. |
| [15] | Kimura Y, Dargusch R, Schubert D, et al. Hydrogen sulfide protects HT22 neuronal cells from oxidative stress[J]. Antioxid Redox Signal, 2006, 8(3-4):661-670. |
| [16] | Meng JL, Mei WY, Dong YF, et al. Heat shock protein 90 mediates cytoprotection by H2S against chemical hypoxiainduced injury in PC12 cells[J]. Clin Exp Pharmacol Physiol, 2011, 38(1):42-49. |
| [17] | Gong QH, Shi XR, Hong ZY, et a1. A new hope for neurodegeneration:possible role of hydrogen sulfide[J]. J Alzheimers Dis, 2011, 24(2):173-182. |
| [18] | 任彩丽, 李东亮, 赵红岗, 等. 全脑缺血-再灌注大鼠脑组 织内源性硫化氢的动态变化[J]. 中国脑血管病杂志, 2008, 5(4):177-181. |
| [19] | Zhang M, Shah H, Wang T, et a1. Dynamic change of hydrogen sulfide after traumatic brain injury and its effect in mice[J]. Neurochem Res, 2013, 38(4):714-725. |
 2014, Vol. 16
2014, Vol. 16



