2. 解放军第401 医院儿科, 山东 青岛 266071
外周型原始神经外胚层肿瘤(peripheral primitive neuroectodermal tumor,pPNET)是由原始 未分化的神经管胚基细胞衍生的发生于周围肌肉、 骨骼组织等间叶组织,具有多向分化潜能的小细胞 恶性肿瘤。该病发病率低,白种人和拉丁裔人发 病率高于黑种人和黄种人[1]。目前多采用术前化疗、 术后放疗和继续化疗来减少肿瘤的复发和转移。 常用的化疗方案为美国儿童癌症协作组CCG7942 治疗方案和美国儿童肿瘤协作组POG9354 治疗方 案,由于POG9354 方案与CCG7942 方案相比具有 疗程长和化疗强度强的特点,因此对于有转移的 pPNET 患儿,我们采用美国POG9354 方案,现将 CCG7942/POG9354 方案的疗效及相关毒副反应报 告如下。 1 资料与方法 1.1 临床资料
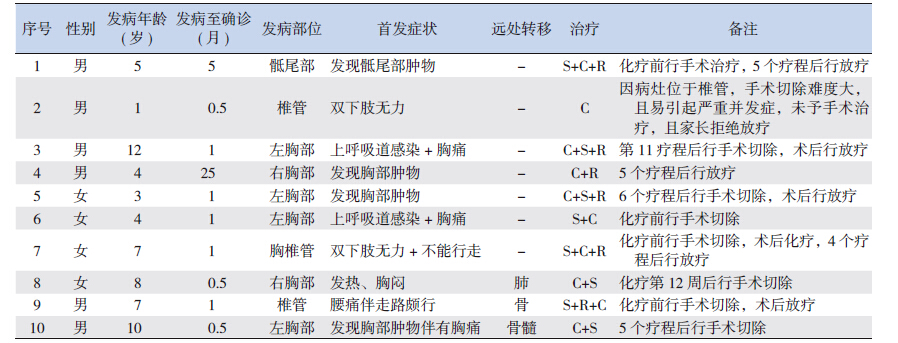
回顾性分析2008 年10 月至2013 年10 月我 科收治的10 例pPNET 患儿的临床资料,除1 例最 后通过分子遗传学确诊外,余均经病理活检和免 疫组化确诊。10 例患儿中,男6 例,女4 例,男 女比例为1.5 : 1,发病年龄在1~12 岁,中位发病 年龄6 岁;其中3 例存在转移,采用POG9354 方 案进行化疗,7 例无转移,采用CCG7942 方案进 行化疗。患儿性别、发病年龄、发病至确诊时间、 首发症状、远处转移及治疗情况见表 1。
| 表 1 10 例pPNET 患儿的临床资料 |
采用33 周(11 疗 程)VDC 与IE 交替方案。第1、3、5、8、10 疗 程采用VDC 方案;第2、4、6、7、9、11 疗程采 用IE 方案;第5、6、7 疗程行辅助手术和/ 或放 疗。(1)VDC 方案:环磷酰胺(CTX)+ 吡柔比 星(THP)+ 长春新碱(VCR)。第0、6 周( 即 第1、3 疗程第1 周): 第1~2 天静脉滴注CTX (2.1 g/m2) 6 h; 第1 天于静脉滴注CTX 前静 脉推注VCR(1.5 mg/m2); 第1~2 天持续静脉 滴注THP(37.5 mg/m2)。第1、2、7、8 周( 即 第1、3 疗程第2、3 周) 第1 天静脉推注VCR (1.5 mg/m2)。第12、21、27 周( 即第5、 8、10 疗程第1 周): 第1~2 天静脉滴注CTX (1.2 g/m2)6 h;第1 天于静脉滴注CTX 前静脉 推注VCR(1.5 mg/m2);第1~2 天避光持续静脉 滴注THP(37.5 mg/m2)。(2)IE 方案:异环磷 酰胺(IFOS)+ 依托泊苷(VP-16)。于治疗第 3、9、15、18、24、30 周( 即第2、4、6、7、 9、11 疗程第1 周)第1~5 天分别静脉滴注IFOS (2.4 g/m2)和VP-16(100 mg/m2)。 1.2.2 POG9354 治疗方案
采用48 周(16 疗 程)的综合化疗。(1)窗口治疗:在第0、3 周 (即第1、2 疗程第1 周)第1~5 天静脉滴注CTX (250 mg/m2) 和托泊替康(0.75 mg/m2)。 (2)诱导治疗:第6、18 周(即第3、7 疗程第1 周)第1~5 天静脉滴注VP-16(100 mg/m2);第6周(即第3 疗程第1 周)第1~5 天静脉滴注IFOS (3.6 g/m2); 第12、18 周( 即第5、7 疗程第1 周)第1~5 天静脉滴注IFOS(2.8 g/m2);第9、 15 周(即第4、6 疗程第1 周):第1~2 天静脉持 续滴注CTX(2.1 g/m2)和THP(37.5 mg/m2),第 1 天静脉滴注CTX 前静脉推注VCR(2 mg/m2); 第10、11、16、17 周(即第4、6 疗程第2、3 周) 第1 天静脉推注VCR(2 mg/m2)。(3)局部治疗 (原发部位):第21、24、27 周(即第8、9、10 疗程第1 周)第1 天静脉滴注CTX(1.5 g/m2)前 静脉推注VCR(2 mg/m2);第22、25、28 周(即 第8、9、10 疗程第2 周) 第1 天静脉推注VCR (2 mg/m2); 第21 周( 即第8 疗程第1 周) 第 1~2 天避光持续静脉滴注THP(37.5 mg/m2);第 24、27 周(即第9、10 疗程第1 周)第1~3 天静 脉滴注VP-16(150 mg/m2)。(4)继续化疗:第 30、36 周(即第11、13 疗程第1 周):第1~3 天 静脉滴注VP-16(100 mg/m2),第1~5 天静脉滴 注IFOS(2.1 g/m2);第33 周(即第12 疗程第1 周): 第1 天静脉滴注CTX(1.5 g/m2)前静脉推注VCR (2 mg/m2),第1~2 天避光持续静脉滴注THP (37.5 mg/m2)48 h;第34、35 周(即第12 疗程第2、 3 周)第1 天静脉推注VCR(2 mg/m2)。(5)局 部治疗(有转移):第14~16 疗程化疗方案同(3)。 1.2.3 化疗注意事项
(1)水化碱化液按每日 3 000 mL/m2 持续静脉滴注,同时注意保肝止吐、 护胃、营养心肌等。(2)用CTX 和IFOS 的同时, 应用美司钠预防出血性膀胱炎,每次用量为CTX 和IFOS 用量的0.4 倍,每3 h 1 次,每日4 次。 (3)在完成每个化疗的24~48 h 内开始应用粒细 胞集落刺激因子(G-CSF,5 μg/kg),直到中性粒 细胞>1.0×109/L。(4)化疗期间每周第5~7 日使 用复方磺胺甲噁唑片(25 mg/kg,每日2 次)预防 卡氏肺囊虫肺炎。(5)粒细胞缺乏的病人在出现 发热时,应急查血常规、C- 反应蛋白(CRP)、 降钙素原并行血培养,在病原菌未明确情况下应 经验预防性使用抗生素,待血培养结果回报后调 整抗生素。(6)当血红蛋白﹤ 70 g/L 或血小板 ﹤ 30×109/L 时,及时成分输血治疗。(7)每个 疗程为21 d,如骨髓造血恢复可开始下一疗程。 1.3 治疗反应及相关毒副反应评价标准
(1)疗效评价:按WHO 实体瘤客观疗效评定标准进行评价,分为完全缓解(complete remission,CR)、部分缓解(partial remission, PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。(2)相关毒副反应评价标准:按 照美国国立癌症研究所(National Cancer Institute, NCI)通用不良反应术语标准(CTCAE v4.0)进行 评价,分为1~5 级。 2 结果 2.1 疗效
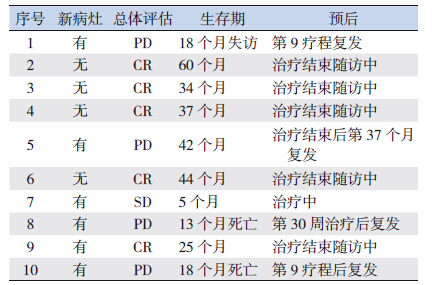
10 例患儿中,5 例CR,1 例SD,4 例PD。 采用CCG7942 方案治疗的7 例无转移患儿中,4 例CR;1 例在第9 疗程中复发,18 个月时失访; 1 例在治疗结束第37 个月复查PET 示原发灶复 发;1 例SD 患儿对化疗药物不敏感,目前正行放 疗。采用POG9354 方案治疗的3 例存在转移的患 儿中,1 例CR;2 例在疗程中复发后死亡。目前7 例无转移的患儿生存期为5~60 个月,2 年无事件 生存率(EFS)为71%;3 例有转移的患儿生存期 为13~25 个月,2 年EFS 为33%。见表 2。
| 表 2 10 例pPNET 患儿的疗效及预后 |
所有患儿化疗中均出现骨髓抑制,且均为4 级毒性损害;化疗中均出现恶心、呕吐等胃肠道 反应,为1~2 级毒性损害;3 例出现肝功能损害, 1 例出现肾功能损害,均为1~2 级。放疗中除1 例 患儿出现Ⅱ度放射性皮炎外,其余均未发现其他 并发症。 3 讨论
pPNET 是从原始未分化的神经管胚基细胞衍 生的,由未分化的小圆细胞组成的恶性肿瘤,好 发于儿童和青少年。该病发病率低,白种人和拉 丁裔人发病率高于黑种人和黄种人。pPNET 多发 生于躯干、四肢、腹部、骨盆,包括胸壁、脊柱 旁,较少见于实质脏器如胰腺、脾、肾脏、输尿 管、 膀胱、前列腺、睾丸、卵巢及颅内等[2, 3]。本 文中10 例患儿中,有6 例发生在胸壁,4 例发生 在脊柱旁,与上述报道相似。临床特点为有触痛 的软组织肿块,肿瘤呈浸润性生长,可活动或固定。 发生在胸壁的pPNET 称为Askin 肿瘤,以胸痛、 胸闷为主要表现,部分可合并胸腔积液,此外胸 部包块也是常见主诉。CT 有一定特征,表现为胸 壁上密度不均匀的实质性肿块,增强后呈不均匀 强化,肋骨多受侵蚀破坏,可伴胸腔积液,肿块 与肺组织界限不清[3]。影像学检查可以显示肿瘤的 内部结构、受侵范围,对诊断有提示作用,但大 多数情况下仍需与儿童好发的横纹肌肉瘤、神经 母细胞瘤、淋巴瘤等鉴别。
该病发病率低,由于肿瘤生长位置不同临床 表现也不全相同。病理组织形态上由小圆细胞构 成,与儿童其他常见的小圆细胞类肿瘤(如恶性 淋巴瘤、神经母细胞瘤、横纹肌肉瘤、未分化小 细胞癌等)相似,故单凭临床表现和病理很难确诊。 目前主要采用病理、免疫组化及细胞遗传学的方 法来确诊pPNET。常用的诊断标准为:出现H-W 菊形团或CD99 阳性,并有两种以上不同神经标志 物( 如NSE、Syn、VIM、MIC-2、S-100、CgA、 NF 和PZ 微球蛋白等)的表达,且淋巴细胞共同 抗原(LCA)阴性及肌源性肿瘤的免疫组化检查 阴性即可诊断PNET [4]。国外目前将基因检测作为 诊断PNET 的重要手段,如在肿瘤细胞发现EWS/ FLI-1 或EWS/ERG 或EWS/ETV,EWSR1(22q12) 染色体易位融合基因也可确诊PNET。本组病例中 9 例是通过病理和免疫组化确诊,1 例因CD99(-), 病理提示PNET 可能性大,最后通过分子遗传学提 示EWSR1(22q12)染色体易位而确诊。
目前国内对pPNET 的治疗尚无统一方案, 本研究采用术前化疗,术后放疗和继续化疗来减 少肿瘤的复发和转移。目前国内外应用化疗的药物主要是CTX、柔红霉素、放线菌素D、VCR、 IFOS、VP-16 六种化疗药物联合应用。 最常用的 化疗方案为VCA 方案(VCR+CTX+ 阿霉素)与IE 方案(IFOS+VP-16),每3 周交替化疗[5]。本研 究采用CCG7942 方案治疗的7 例无转移的患儿, 其中4 例获CR;1 例在治疗中复发,18 个月后失 访;1 例在治疗结束后复发;1 例SD 患儿对化疗 药物不敏感,目前正行放疗;2 年EFS 为71%, 生存期为5~60 个月。采用POG9354 方案治疗的3 例有转移的患儿,其中1 例获CR;2 例在疗程中 复发死亡;2 年EFS 为33%,生存期为13~25 个 月。这与国外报道无转移和存在转移的5 年EFS 分别为70%[6, 7] 和30%[5, 7] 相似。可见有无转移是 判断pPNET 预后的一个极为重要的因素。此外, 肿瘤体积的大小、发病部位、发病年龄等[7] 以及 肿瘤原发部位对放疗的反应和预后也有关[8]。尽 管通过正规的化疗可以使大多数患儿达到CR,但 复发率仍然很高。本研究中无转移病例的复发率 为29%,有转移病例的复发率达67%,总体复发 率为40%。虽然密集型的强化疗可以提高无转移 的pPNET 预后,但对存在远处转移的pPNET 效果 仍不明显[7]。目前对于标准治疗联合自体造血干细 胞移植的治疗效果仍不确切。有研究报道采用高剂 量化疗联合自体造血干细胞移植可以提高高风险 的尤文氏肉瘤/ 原始神经外胚层肿瘤的预后[9, 10]。 Meyers 等[11] 研究通过在巩固治疗阶段用高剂量的 马法兰、VP-16、全身照射联合自体干细胞移植治 疗32 例高风险的尤文氏肉瘤,其中2 年无事件生 存率为24%,可见采用密集型的强化治疗和造血 干细胞移植没有改善生存率。另外,国内张伟令 等[12] 研究报道采用大剂量化疗结合自体外周血造 血干细胞移植对PNET 的治疗效果不佳。
本研究中,患儿化疗的主要毒副反应为骨髓 抑制和胃肠道反应等,但通过粒细胞刺激因子的 应用及积极抗感染、保肝、护胃、营养心肌等治疗, 患儿可以较好地耐受化疗。放疗的毒副反应见于 放射性皮炎,经治疗可恢复,未见其他副反应。
由此可见,采用CCG7942 方案对未有转移的 pPNET 患儿有效、安全;对存在转移的pPNET 患 儿即使采用POG9354 方案效果仍然欠佳,我们期 待纳米肿瘤技术的发展及应用为肿瘤的治疗提供 新的途径[13]。
| [1] | Fraumeni JF, Glass AG. Rarity of Ewing's sarcoma among US. Negro children[J]. Lancet, 1970, 1(7462):366-367. |
| [2] | Carvajal R, Meyers P. Ewing's sarcoma and primitive neuroectodermal family of tumors[J]. Hematol Oncol Clin North Am, 2005, 19(3):501-525. |
| [3] | Schulman H, Newman-Heinman N, Kurtzbart E, et al. Thoracoabdominal peripheral primitive neuroectoderma1 tumors in children:radiological features[J]. Eur Radiol, 2000, 10(10):1649-1652. |
| [4] | Kiatsoontorn K, Takami T, Ichinose T, et al. Primary epidural peripheral primitive neuroectodermal tumor of the thoracic spine[J]. Neurol Med Chir(Tokyo), 2009, 49(11):542-545. |
| [5] | Ohgaki K, Horiuchi K, Mizutani S, et al. Primary Ewing's sarcoma/primitive neuroectodermal tumor of the kidney that responded to low-dose chemotherapy with ifosfamide, etoposide, and doxorubicin[J]. Int J Clin Oncol, 2010, 15(2):210-214. |
| [6] | Womer RB, West DC, Krailo MD, et al. A randomized controlled trial of interval-compressed chemotherapy for the treatment of localized Ewing's sarcoma:a report from the Children's Oncology Group[J]. J Clin Oncol, 2012, 30(33):4148-4154. |
| [7] | Grier HE, Krailo MD, Tarbell NJ, et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing's sarcoma and primitive neuroectodermal tumor of bone[J]. N Engl J Med, 2003, 348(8):694-701. |
| [8] | Luksch R, Tienghi A, Hall KS, et al. Primary metastatic Ewing's family tumors:results of the Italian Sarcoma Group and Scandinavian Sarcoma Group ISG/SSG IV Study including myeloablative chemotherapy and total-lung irradiation[J]. Ann Oncol, 2012, 23(11):2970-2976. |
| [9] | Drabko K, Raciborska A, Bilska K, et al. Consolidation of firstline therapy with busulphan and melphalan, and autologous stem cell rescue in children with Ewing's sarcoma[J]. Bone Marrow Transplant, 2012, 47(12):1530-1534. |
| [10] | Atra A, Whelan JS, Calvagna V, et al. High-dose busulfan/melphalan with autologous stem cell rescue in Ewing's sarcoma[J]. Bone Marrow Transplant, 1997, 20(10):843-846. |
| [11] | Meyers PA, Krailo MD, Ladanyi M, et al. High-dose melphalan, etoposide, total-body irradiation and autologous stem-cell reconstitution as consolidation therapy for high-risk Ewing's sarcoma does not improve prognosis[J]. J Clin Oncol, 2001, 19(11):2812-2820. |
| [12] | 张伟令, 张谊, 黄东升, 等. 大剂量化疗结合自体外周血干 细胞移植治疗神经外胚层来源的儿童实体瘤疗效分析[J]. 中 国当代儿科杂志, 2010, 12(4):244-247. |
| [13] | Thakor AS, Gambhir SS. Nanooncology:The future of cancer diagnosis and therapy[J]. CA Cancer J Clin, 2013, 63(6):395-418. |
 2014, Vol. 16
2014, Vol. 16