2. 中日友好临床医学研究所, 北京 100029
儿童肥胖的发病率呈逐年上升趋势,美国 在2009~2010 年间进行的全国健康和营养调查发 现,儿童和青少年的肥胖发病率为16.9%[1],我 国10 年前的大规模调查显示儿童肥胖的发病率为 5%~8%[2],近年张格祥等[3] 通过对兰州市城区3~ 6 岁儿童2001~2010 年的体格发育趋势分析,显示 超重和肥胖的平均患病率呈逐年上升。已知摄入 过多脂肪等高热量饮食是导致肥胖的重要原因之 一,虽然随着全民健康教育水平的普及和推广, 越来越多的人们已经意识到高脂饮食及肥胖对自 身及后代健康的危害,并自觉地进行预防和干预, 但大量的人群研究显示,母亲高脂饮食以及肥胖 对后代的危害仍然是一个重要的社会问题[4]。但目 前的报道多侧重于高脂饮食导致的母亲肥胖对后 代体重、代谢异常及心血管疾病危险性的研究[5, 6, 7, 8], 而关于母亲高脂饮食对后代骨骼影响的报道很少。 本课题组的前期研究显示,幼鼠在高脂饮食喂养 5 周后导致了非酒精性脂肪肝,同时出现了生长 障碍,并伴随有胰岛素样生长因子-I(insulin-like growth factor,IGF-I)的表达下降[9]。因此,本研究 希望在前期研究的基础上利用高脂饮食建立动物 模型,观察母鼠孕前和孕期高脂饮食对新生仔鼠体 长的影响,加强对母亲肥胖所致后代生长发育障 碍的认识。IGF-I 对生长有促进作用[10],其与受体 结合后,磷酸化胰岛素受体底物1(insulin receptor substrate 1,IRS-1),并可通过激活磷酯酰肌醇3- 激酶(phosphatidylinositol 3-kinase,PI3K)/ 蛋白激 酶B(protein kinase B,AKT1)和促分裂原活化蛋 白激酶(mitogen-activated protein kinases,MAPK) 两条信号转导通路而调节骨骼生长。因此,本研究 进一步检测了母鼠高脂饮食后仔鼠IGF-I 的变化、 以及IGF-I 对以上两条信号通路的影响,初步探讨影响胎儿骨骼生长的病理机制,为临床采取措施 早期干预提供实验依据。 1 材料与方法 1.1 实验动物与分组
64 只3 周龄断乳Sprague Dawley 大鼠购于军 事医学科学院实验动物中心,其中雌鼠40 只,雄 鼠24 只,体重50~60 g。将40 只雌性大鼠随机分 为高脂组和对照组,每组20 只。 1.2 试剂与材料
35% 高脂饲料( 总热量5 240 kcal/kg,脂 肪占能量比例为60%) 和普通饲料( 总热量 3 850 kcal/kg,脂肪占能量比例为10%)购于北京 华阜康生物科技股份有限公司。IGF-I 酶联免疫 吸附试验试剂盒购于美国R&D Systems 公司,抗 PI3K 抗体、抗磷酸化PI3K(Phospho-PI3K)抗体、 抗AKT1 抗体、抗磷酸化AKT1(Phospho-AKT1) 抗体、抗IRS-1 抗体和抗磷酸化IRS-1(Phospho- IRS-1)抗体均购于美国abcam 公司,抗MAPK 抗 体和抗磷酸化MAPK(Phospho-MAPK)抗体均购 于美国CST 公司。 1.3 动物模型的制备
高脂组喂养35% 高脂饲料,对照组及24 只 雄鼠喂养普通饲料。喂养8 周后,高脂组和对照 组各取8 只母鼠行苏木精- 伊红(HE)染色,观 察肝脏病理;其余按雌雄比例1 : 1 合笼交配,孕 期3 周左右,孕期分别继续给予高脂饮食或普通 饲料喂养。仔鼠出生后检测各项指标。 1.4 仔鼠体长测量及血清学检测
仔鼠出生24 h 内使用游标卡尺测量鼻尾长度 (鼻尖到尾尖)后,断头取血,离心后取上清液,酶联免疫吸附试验测定血清IGF-I 水平。 1.5 组织病理分析及免疫组织化学检测
高脂组和对照组各取10 只仔鼠的肝脏组织, 行HE 染色,光镜下观察肝脏组织病理情况。同 时取两组仔鼠的左下肢长骨(胫骨、股骨),10% 中性甲醛溶液固定72 h,然后进行脱水、透明、浸蜡、 包埋、制片,应用免疫组化EnVision 法标记骨组 织切片IRS-1 和Phospho-IRS-1;采用IPP(Image- Pro Plus,Media Cybernetics 公司,美国)图像分析 软件分析长骨组织切片IRS-1 的含量,每个样本随 机选取3 张切片,每张切片随机选取6 个视野, 读取阳性区域的积分光密度值和平均吸光度值, 取每组均值进行比较。 1.6 蛋白质印迹技术
两组各另取6 只仔鼠左下肢长骨(胫骨、股 骨)存于-80℃冰箱待检,检测仔鼠长骨PI3K/ Phospho-PI3K、AKT1/Phospho-AKT1、MAPK/ Phospho-MAPK 的蛋白表达量。常规行SDS-PAGE 电泳,将蛋白转移至PVDF 膜,加入一抗后4℃过 夜。第2 天洗膜,加入相应二抗37℃孵育1 h 后, 应用WCL 法行化学发光、显影、定影,最后用 Quantity One 软件分析各蛋白图像的灰度值,以与 内参β-actin 的灰度值之比作为其蛋白的相对表达 量。 1.7 统计学分析
应用SPSS 17.0 统计软件对数据进行统计学 分析,符合正态分布的计量资料用均数± 标准差 (x±s)表示,两组比较采用两个独立样本t 检验。 P<0.05 为差异有统计学意义。 2 结果 2.1 两组仔鼠的体长比较
高脂组共产95 只仔鼠,平均体长67±4 mm; 对照组共产128 只仔鼠,平均体长77±4 mm。 两组比较,高脂组仔鼠的体长较对照组显著降低 (t=-2.282,P=0.023)。 2.2 两组仔鼠的血清IGF-I 水平比较
高脂组仔鼠血清IGF-I 水平为43±17 pg/mL,对照组为54±12 pg/mL,高脂组较对照组下降, 但差异无统计学意义(t=-1.324,P=0.185)。 2.3 两组母鼠及仔鼠的肝脏组织病理比较
对照组母鼠和仔鼠的肝小叶结构完整,肝细 胞呈多边形,围绕中央静脉呈放射状分布,大小 一致。而高脂组母鼠及仔鼠肝组织可见脂肪样变, 肝细胞胞浆内有较多小而密的脂质沉积,肝细胞 胞浆呈透明的空泡状,小叶结构不清。见图 1。
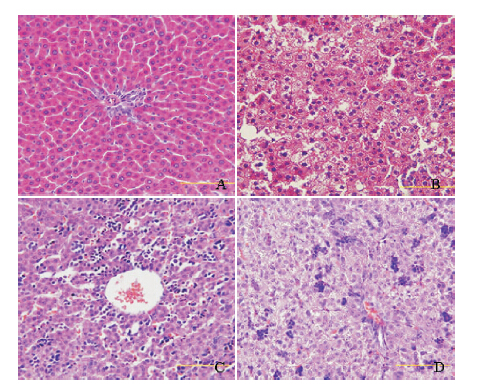 |
图 1 两组母鼠和仔鼠的肝脏病理染色(苏木精- 伊红 染色,×400) A 和C 分别为对照组母鼠和仔鼠,肝小叶结构 完整,肝细胞呈多边形,围绕中央静脉呈放射状分布,大小一致; B 和D 分别为高脂组母鼠和仔鼠,与对照组相比,肝组织可见脂 肪样变,肝细胞胞浆内有较多小而密的脂质沉积,肝细胞胞浆呈 透明的空泡状,小叶结构不清。 |
免疫组化结果显示,高脂组和对照组的IRS-1 和Phospho-IRS-1 在长骨软骨细胞中均呈阳性表达, 且两组间IRS-1 表达的积分光密度值和平均吸光度 值差异均无统计学意义(均P>0.05),见表 1,图 2。
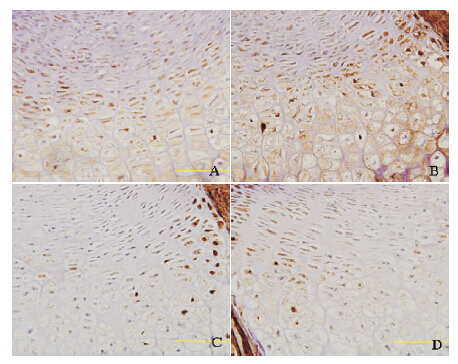 |
图 2 两组仔鼠长骨中IRS-1 及Phospho-IRS-1 的 表达(EnVision 法,×400) A 和C 分别为对照组IRS-1 和 Phospho-IRS-1 的表达;B 和D 分别为高脂组IRS-1 和Phospho- IRS-1 的表达。两组IRS-1 和Phospho-IRS-1 的表达分布均无明显 差异。IRS-1 和Phospho-IRS-1 的阳性表达呈棕黄色。 |
| 表 1 两组仔鼠长骨中IRS-1 的表达比较 |
高脂组长骨软骨细胞中MAPK 表达高于对照 组(P<0.05),而PI3K 和AKT1/Phospho-AKT1 与 对照组比较差异均无统计学意义。见表 2,图 3。
| 表 2 两组仔鼠长骨中MAPK、PI3K 及AKT1/Phospho- AKT1 的表达比较 |
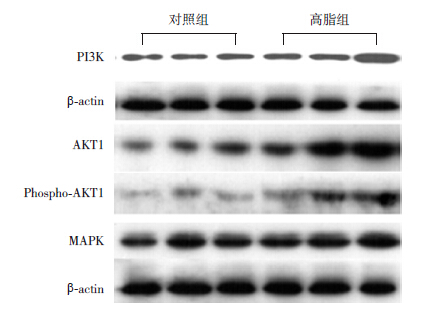 |
图 3 Western blot 检测两组仔鼠长骨中MAPK、 PI3K 及AKT1/Phospho-AKT1 水平 |
目前仅有少量研究探讨了母亲孕期高脂饮食 对后代骨骼的影响,结果提示部分后代、尤其是 其中的雌性后代在成年期将出现骨小梁的结构改 变,并进一步影响长骨的结构[11, 12]。在本研究中发 现,高脂组新生仔鼠体长较对照组显著降低,提 示母鼠孕期高脂饮食对胎鼠体长发育的抑制作用。 这些结果与在临床上发现的部分非酒精性脂肪肝 患儿身高增长缓慢,就诊时身高常低于同龄儿身 高的现象基本一致[9]。文献显示,高脂饮食导致的 肥胖母鼠具有显著增多的凋亡卵泡,且卵母细胞 小而少、胚胎的IGF-I 受体染色减少,最终导致胎 鼠发育较小,提示母亲肥胖产生的不良影响可以 早至卵母细胞阶段和胚胎植入阶段,这些影响将 导致后代长期的病态[13]。但也有文献显示,3 周龄 的小鼠在高脂饮食喂养6 周后,其体长和胫骨生 长速度、胫骨生长板高度和血清胰岛素浓度均高 于普通饮食组[14],这与本研究结果有所不符,作 者推测由于胰岛素抵抗和继发的高胰岛素血症导 致了骨骼的生长加速。与本研究对比,推测研究 结果的差异受到所应用高脂饮食的具体成分比例、 所选用的动物种类及年龄、高脂喂养的持续时间、 以及是否伴随代谢异常(如高胰岛素血症)等多 种因素的影响。
Kavanagh 等[15] 研究发现,高脂饮食喂养的大 鼠,其仔鼠出生身长较短,出生后如果继续给予 高热量饮食喂养,则会发生生长追赶,成年后体 长将明显超过正常对照组。本研究的局限性在于 未能对出生仔鼠继续高脂饮食喂养并观察体长的 动态变化,有待以后进一步连续观察。尽管如此, 本研究初步的研究结果显示母亲高脂饮食对后代 体长的不良影响,提示应重视母亲孕期合理饮食 的重要性,避免过量的高脂等高热量饮食,对指 导孕妇合理营养仍具有一定的临床意义。
人体的纵向生长主要通过长骨的线性生长来 完成,骨骺软骨生长板是实现长骨纵向生长的重 要场所。在儿童生长发育过程中,IGF-I 的促生长 作用是通过介导作用于软骨生长板、刺激软骨细 胞的增殖而实现的[16, 17]。IGF-1 基因敲除鼠骺板软 骨增殖受损、矿化延迟、肥大区软骨细胞减少[18]。 Govoni 等[19, 20] 通过灭活鼠软骨细胞和成骨细胞中IGF-I 的活性,发现身长分别降低7% 和14%,骨 骺板宽度分别降低7% 和20%。本研究中,高脂组 的仔鼠在出生体长下降的同时,伴有血清IGF-I 水 平下降,似乎提示,可能由于IGF-I 的下降影响了 胎鼠在宫内的生长发育。肝脏是IGF-I 合成的主要 场所,本实验显示,高脂饮食导致母鼠和仔鼠的 肝脏均出现了明显的脂质沉积,提示肝脏脂质代 谢能力下降,并影响了IGF-I 的合成。虽然未对母 鼠的IGF-I 水平进行检测,但结合既往本课题组的 研究结果[9],推测母鼠的IGF-I 水平同样是下降的。 IGF-I 水平下降对仔鼠体长及骨骼影响的下游机制 如何,本研究进行了初步探讨。
IGF-I 与受体结合后,磷酸化受体底物IRS-1 并使其活化,形成Phospho-IRS-1。研究显示, IRS-1 基因敲除小鼠股骨和胫骨的长度比野生型小 鼠短20%,说明IRS-1 通过对软骨细胞的调节作 用参与骨骼生长,而在IRS-1 基因敲除后IGF-I 的 作用不能传导而影响了骨骼生长[21]。本实验结果 显示,高脂组仔鼠软骨细胞不论是基础的IRS-1、 还是活化后的Phospho-IRS-1 的表达,与对照组比 较均无明显差异。提示高脂组的IGF-I 水平虽然 有所下降,但并未影响到IRS-1 的活化。Phospho- IRS-1 激活两条信号转导通路,以调节代谢为主 的PI3K/AKT1 通路和介导促细胞增殖效应为主的 MAPK 信号通路,以促进骺板软骨细胞增殖分化、 矿化,抑制软骨细胞凋亡,缓解骺板闭合[10]。在 这两条信号通路中,PI3K/AKT1 和MAPK 只有在 发生磷酸化后才能最大程度地发挥活性作用,并 维持活性稳定性,故研究中多以磷酸化后的表达 水平作为衡量其活性的指标。本结果中,高脂组 仔鼠软骨细胞的MAPK 表达高于对照组,而PI3K 和AKT1/Phospho-AKT1 与对照组比较均无显著差 异,限于技术原因,未能检测到Phospho-PI3K 和 Phospho-MAPK 的表达。因此,尚不能肯定母鼠高 脂饮食是否通过该两条信号通路影响仔鼠的骨骼 生长。另外,已知MAPK 存在于大多数细胞内, 在将细胞外刺激信号转导至细胞及其核内、引起 细胞生物学反应(如细胞增殖、分化、转化及凋亡) 的过程中具有至关重要的作用。本实验中出现高 脂组仔鼠MAPK 表达高于对照组的结果,推测是 否因为高脂饮食导致机体的一系列变化影响了其 它信号通路所致,目前尚未可知。此外,高脂饮食中不同的蛋白质和脂肪比例是否对仔鼠的生长 有不同的影响、IGF-I 下降的程度是否会对下游通 路产生不同影响、以及是否通过其它信号通路发 挥作用等,都有待于进一步研究。
综上,本研究的意义在于通过母亲孕期高脂 饮食建立动物模型,在国内率先探讨了孕前和孕 期高脂饮食对仔鼠体长及骨骼发育的影响,并希 望了解IGF-I 下降导致体长发育迟缓的病理机制。 初步结果显示,孕前及孕期暴露于高脂环境不利 于胎鼠在宫内的发育,造成仔鼠出生短小,可能 与IGF-I 的下降有关,但对骨骺板软骨的确切影响 机制尚有待进一步阐明。
| [1] | Ogden CL, Carroll MD, Kit BK, et al. Prevalence of obesity and trends in body mass index among US children and adolescents, 1999-2010[J]. JAMA, 2012, 307(5):483-490. |
| [2] | 米杰, 程红, 侯冬青, 等. 北京市2004 年2-18 岁儿童青少 年超重和肥胖流行现状[J]. 中华流行病学杂志, 2006, 27(6):469-474. |
| [3] | 张格祥, 余小龙, 马剑华, 等. 兰州市城区3-6 岁儿童 2001-2010 年体格发育变化趋势分析[J]. 中国当代儿科杂志, 2012, 14(7):539-542. |
| [4] | Olson CM, Demment MM, Carling SJ, et al. Associations between mothers' and their children's weights at 4 years of age[J]. Child Obes, 2010, 6(4):201-207. |
| [5] | Nivoit P, Morens C, Van Assche FA, et al. Established dietinduced obesity in female rats leads to offspring hyperphagia, adiposity and insulin resistance[J]. Diabetologia, 2009, 52(6):1133-1142. |
| [6] | Long NM, George LA, Uthlaut AB, et al. Maternal obesity and increased nutrient intake before and during gestation in the ewe results in altered growth, adiposity, and glucose tolerance in adult offspring[J]. J Anim Sci, 2010, 88(11):3546-3553. |
| [7] | Samuelsson AM, Morris A, Igosheva N, et al. Evidence for sympathetic origins of hypertension in juvenile offspring of obese rats[J]. Hypertension, 2010, 55(1):76-82. |
| [8] | 梁贞贞, 朱鹏, 高荣, 等. 孕期增重对婴幼儿体重和肥胖风 险影响的随访研究[J]. 中国当代儿科杂志, 2011, 13(10):794-798. |
| [9] | 张琼, 张知新, 苏慧敏, 等. 高脂饮食对幼鼠生长及胰岛素样 生长因子表达的影响[J]. 临床儿科杂志, 2011, 29(12):1137-1142. |
| [10] | Zhang ZX, Liu YK, Pan H, et al. The effect of polyethylene glycol recombinant human growth hormone on growth and glucose metabolism in hypophysectomized rats[J]. Growth Horm IGF Res, 2012, 22(1):30-35. |
| [11] | Lanham SA, Roberts C, Hollingworth T, et al. Maternal highfat diet:effects on offspring bone structure[J]. Osteoporos Int, 2010, 21(10):1703-1714. |
| [12] | Devlin MJ, Grasemann C, Cloutier AM, et al. Maternal perinatal diet induces developmental programming of bone architecture[J]. J Endocrinol, 2013, 217(1):69-81. |
| [13] | Jungheim ES, Schoeller EL, Marquard KL, et al. Diet-induced obesity model:abnormal oocytes and persistent growth abnormalities in the offspring[J]. Endocrinology, 2010, 151(8):4039-4046. |
| [14] | Wu S, Aguilar AL, Ostrow V, et al. Insulin resistance secondary to a high-fat diet stimulates longitudinal bone growth and growth plate chondrogenesis in mice[J]. Endocrinology, 2011, 152(2):468-475. |
| [15] | Kavanagh K, Sajadian S, Jenkins KA, et al. Neonatal and fetal exposure to trans-fatty acids retards early growth and adiposity while adversely affecting glucose in mice[J]. Nutr Res, 2010, 30(6):418-426. |
| [16] | Wang Y, Cheng Z, Elalieh HZ, et al. IGF-1R signaling in chondrocytes modulates growth plate development by interacting with the PTHrP/Ihh pathway[J]. J Bone Miner Res, 2011, 26(7):1437-1446. |
| [17] | Wang J, Zhou J, Cheng CM, et al. Evidence supporting dual, IGF-I-independent and IGF-I-dependent, roles for GH in promoting longitudinal bone growth[J]. J Endocrinol, 2004, 180(2):247-255. |
| [18] | Wang Y, Nishida S, Sakata T, et al. Insulin-like growth factor-I is essential for embryonic bone development[J]. Endocrinology, 2006, 147(10):4753-4761. |
| [19] | Govoni KE, Lee SK, Chung YS, et al. Disruption of insulin-like growth factor-I expression in type Ⅱ alphaI collagen-expressing cells reduces bone length and width in mice[J]. Physiol Genomics, 2007, 30(3):354-362. |
| [20] | Govoni KE, Wergedal JE, Florin L, et al. Conditional deletion of insulin-like growth factor-I in collagen type 1 alpha2-expressing cells results in postnatal lethality and a dramatic reduction in bone accretion[J]. Endocrinology, 2007, 148(12):5706-5715. |
| [21] | Hoshi K, Ogata N, Shimoaka T, et al. Deficiency of insulin receptor substrate-1 impairs skeletal growth through early closure of epiphyseal cartilage[J]. J Bone Miner Res, 2004, 19(2):214-223. |
 2014, Vol. 16
2014, Vol. 16