2. 华中科技大学同济医学院附属同济医院儿科, 湖北 武汉 430030
新型支气管肺发育不良(bronchopulmonary dysplasia,BPD)是常见于早产儿的一种慢性肺疾 病。生后高氧暴露引起肺微血管发育障碍,肺泡 化过程受阻可能是其发生发展的重要原因[1, 2]。血 管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是目前已知最有效调控肺微血管生 成和发育的血管生成素蛋白[3]。本课题组前期研究 发现60% 氧暴露时肺组织VEGF 及其受体表达下 降[4, 5]。新近研究发现脂肪型脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)是调节支气管微血 管循环的重要因子,为VEGF 基因下游因子,受 VEGF 调控[6]。本实验拟对早产大鼠进行60%氧暴 露,观察高氧肺损伤时肺组织及BALF 中FABP4 的表达,进一步探讨高氧暴露对肺血管发育信号 传导通路的影响及与BPD 发生发展的关系。 1 材料与方法 1.1 材料
健康Sprague-Dawley(SD)大鼠由郑州大学 实验动物中心提供。总RNA 提取试剂(TRIzol) 购于美国Gibco 公司;小鼠抗FABP4 单克隆抗体 购于美国Santa Cruz 公司;随机引物Oligo dT12- 18、M-MLV 逆转录酶、RNA 酶抑制剂(Rnasin) 及TaqDNA 聚合酶购于美国Promega 公司;FABP4 引物由上海英骏公司合成;ELISA 检测试剂盒购自 美国R & D 公司。 1.2 动物模型的制备及分组
清洁级SD 雌雄大鼠按3 : 1 夜间合笼交配,次 日晨取雌鼠阴道分泌物涂片,镜检见精子,当日 记为妊娠第1 天,早产大鼠于母鼠孕21 d 剖宫娩 出,由当日分娩的其他母鼠作其代母鼠。早产鼠 于生后6 h 内随机分为对照组和高氧组,对照组置 于常压空气中,高氧组置于浓度为60% 的高氧舱 中,氧浓度维持在60%,每天开箱约1 h 用于添加 饲料及更换垫料,并与对照组互换母鼠以避免母 鼠氧中毒影响哺乳。当某一组新生鼠发生死亡后, 同时将其他组去掉相同数目的新生鼠,以保持各 组新生鼠数目相同,防止因营养因素引起的差异。 两组早产鼠分别于出生后第3 天(P3)、第7 天 (P7)及第14 天(P14)各取8 只,以20% 乌拉 坦0.5 mL 腹腔麻醉,气管插管保持肺充气状态,开胸放血,右支气管结扎,迅速切取右肺,用于 免疫组织化学检测。用4℃无菌生理盐水对左肺行 肺泡灌洗(2.5 mL×3 次),回收率>85%,将灌 洗液在4℃条件下,以4 000 r/min 离心10 min,取 上清,保存到-80℃冰箱中待测FABP4 的表达。 1.3 免疫组织化学染色检测FABP4 蛋白的表达
采用链霉素抗生物素蛋白-过氧化物酶连接 法(S-P 法)检测FABP4 的表达。石蜡切片常规 脱蜡至水,抗原修复,3%H2O2 阻断内源性过氧化 物酶,正常山羊血清封闭,滴加一抗,4℃过夜, 0.01M PBS 充分洗涤后加入生物素标记的羊抗兔 IgG,37℃孵育30 min,加入辣根过氧化物酶标记 的链霉卵白素37℃孵育30 min,DAB 显色、复染 封片、镜下观察。结果判定以细胞浆有棕黄色颗 粒沉着为阳性细胞。阴性对照为0.01M PBS 替代一 抗。FABP4 抗体稀释度均为1 : 100。每例随机抽取 染色清晰的切片5 张,每张切片于光镜下随机选 取5 个视野,固定窗口面积,利用HMIAS-2000 高 清晰度彩色医学图文分析系统,测定平均吸光度 (A)以表示阳性产物的强度。 1.4 RT-PCR 检测FABP4 基因的表达
采用TRIzol 试剂提取总RNA,逆转录为 cDNA,以此为模板行PCR 扩增。FABP4 基因及内 参基因引物序列见表 1。PCR 反应体系(25 μL): 2×MasterMix 12.5 μL,上、下游引物各1 μL,β-actin 上、下游引物各0.5 μL,cDNA 1 μL,灭菌水8.5 μL。 PCR 反应条件:94 ℃ 预变性5 min;94 ℃ 变性 45 s,53.6℃退火45 s,72℃延伸1 min,共32 个循环; 最后72℃延伸7 min。然后用1.5% 琼脂糖凝胶电 泳30 min。结果在MUVB220 凝胶分析系统(美国 Ultralum 公司)对扩增产物条带进行分析,分别测 定各扩增带吸光度(A 值),将目的基因FABP4 扩增带分别与内参照β-actin 扩增带的A 值比作 为其mRNA 水平的定量指标。
| 表 1 PCR 引物序列 |
采用双抗体夹心酶联免疫吸附分析法(ELISA) 检测BALF 中FABP4 的含量,操作步骤严格按说 明书进行。 1.6 统计学分析
应用SPSS 17.0 统计软件对数据进行统计学分 析,计量资料以均数± 标准差(x±s)表示,两 组间比较采用t 检验;多组间比较采用单因素方差 分析,组间两两比较采用LSD-t 检验,P<0.05 为 差异有统计学意义。 2 结果 2.1 两组早产大鼠肺组织FABP4 蛋白检测结果
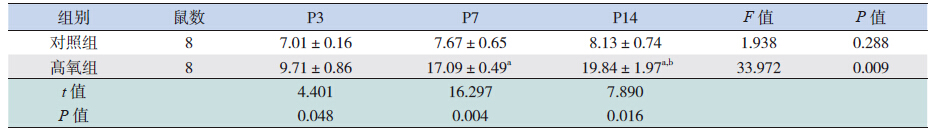
FABP4 主要在肺巨噬细胞、支气管上皮细胞 和血管内皮细胞表达。两组FABP4 蛋白的表达随鼠龄递增,呈逐渐升高的趋势,至P14 时最高。 与对照组相比,高氧组FABP4 蛋白的表达在P3、 P7 及P14 均高于对照组,且差异有统计学意义(均 P<0.05)。见表 2、图 1。
 |
图 1 FABP4 在不同时间点两组早产大鼠肺组织中的表达(S-P 法,×400)各时间点对照组FABP4 均有少 量表达,同时间点高氧组FABP4 较对照组明显增多,胞浆有棕黄色颗粒沉着为FABP4 阳性表达。 |
| 表 2 不同时间两组早产大鼠肺组织FABP4 蛋白水平比较 |
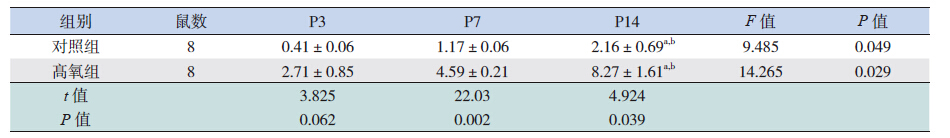
检测发现两组大鼠FABP4 mRNA 表达均随鼠 龄递增,至P14 时达峰值。与对照组相比,高氧 组FABP4 mRNA 水平在P7 和P14 均高于对照组, 且差异有统计学意义(均P<0.05)。见表 3、图 2。
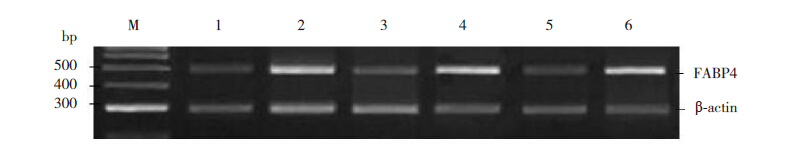 |
图 2 RT-PCR检测不同时间两组早产大鼠肺组织FABP4 mRNA表达情况M:Marker,1 000 bp DNA ladder;1、 3 和5 分别为P3、P7 和P14 时对照组;2、4 和6 分别为P3、P7 和P14 时高氧组。 |
| 表 3 不同时间点两组早产大鼠肺组织FABP4 mRNA 水平比较 |
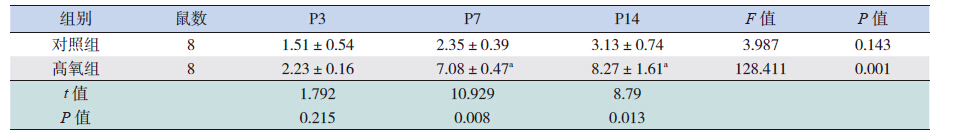
检测发现两组大鼠BALF 中FABP4 含量均随 鼠龄递增而逐渐增加,至P14 时达峰值。与对照 组相比,高氧组大鼠BALF 中FABP4 蛋白的表达 在P7 及P14 均高于对照组,且差异有统计学意义 (均P<0.05)。见表 4。
| 表 4 不同时间两组早产大鼠BALF 中FABP4 含量的比较 |
近年来,随着新生儿重症监护水平的提高, 越来越多的早产儿得以存活。新型BPD 发病率也 逐年增高[7]。与以肺纤维化为主要病理特征的传 统BPD 比较,新型BPD 患者肺泡结构简单化,肺 泡数目和表面积减少,肺泡化和肺微血管发育停 滞,提示肺发育在管道形成期受到干扰或停滞[8]。 VEGF 是调节肺微血管生成和发育的重要因子。 VEGF 及其受体表达减少是引起新型BPD 发生的 重要原因[4, 8, 9]。但其具体机制目前不清。本研究从 VEGF 下游因子FABP4 与微血管发育之间信号传 导途径入手,进一步探讨高氧暴露对肺微血管发 育信号传导通路的影响,有助于阐明新型BPD 发 生的分子机制,可望带来防治领域的突破。
肺微血管发育主要包括支气管微血管发育 和肺泡微血管发育。传统研究多集中在肺泡微血 管发育,对支气管微血管发育研究则甚少[10]。 FABP4 是FABPs 家族的一员,是主要调节支气管 微血管发育的重要因子及VEGF 的下游因子,其 表达受VEGF 调控[6, 11, 12]。本研究发现高氧肺损伤 时除肺巨噬细胞有大量FABP4 表达外,支气管上 皮细胞和血管内皮细胞均有表达。这与Shum 等[13] 研究表达部位一致,而与Ghelfi 等[10] 研究表达部 位略微不同,可能是因为研究对象不同:本研究 对象为SD 大鼠,而Ghelfi 等[10] 研究对象为狒狒。
本研究发现随鼠龄增加及高氧暴露时间延 长,肺组织FABP4 表达均较对照组增加。这与本 课题组前期研究发现高氧暴露肺损伤时VEGF 及 其受体2 的表达减少正好相反。其可能机制为: (1)新近研究认为肺毛细血管发育包括支气管毛 细血管网发育和肺泡毛细血管网发育。VEGF 主要 由肺泡上皮细胞合成,通过旁分泌途径作用于肺 泡毛细血管网。而FABP4 则主要由肺泡巨噬细胞、 支气管血管内皮细胞及支气管血管上皮细胞合成, 作用于支气管毛细血管网,因此,高氧肺损伤时, 二者由于分泌细胞受损程度不同,反应不同[6, 13]。 (2)高氧肺损伤时随着高氧暴露时间延长,肺巨 噬细胞逐渐流入聚集,引起FABP4 表达逐渐增加。 而目前研究认为FABP4 在促进支气管毛细血管网 生成的同时,又可抑制肺泡上皮细胞分泌VEGF 及其受体2,VEGF 及其受体2 分泌减少可使肺泡毛细血管网生成障碍[11]。因此高氧肺损伤时主要 是抑制肺泡微血管发育,引起肺微血管病理性重 塑,肺泡化合成受阻。
本研究还发现高氧肺损伤时BALF 中FABP4 表达增多。这可能与FABP4 是低分子蛋白 (<14 kd),在高氧肺损伤时容易从损伤细胞渗 漏到BALF 中有关。也有学者研究发现BPD 患 儿BALF 中FABP4 含量增多[14, 15]。提示BALF 中 FABP4 含量可作为监测BPD 发生发展的重要指标。
综上所述,高氧肺损伤可能通过调控FABP4 与VEGF 信号传导通路,使肺微血管发育障碍, 发生病理性重塑,肺泡化合成受阻,进而导致新 型BPD 的发生。同时BALF 中FABP4 含量可作为 监测新型BPD 发生发展的临床标志物。
| [1] | Hadchouel A, Delacourt C. Premature infants bronchopulmonary dysplasia:past and present[J]. Rev Pneumol Clin, 2013, 69(4):207-216. |
| [2] | Madurga A, Mizíková I, Ruiz-Camp J, et al. Recent advances in late lung development and the pathogenesis of bronchopulmonary dysplasia[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(12):893-905. |
| [3] | Talwar T, Srivastava MV. Role of vascular endothelial growth factor and other growth factors in post-stroke recovery[J]. Ann Indian Acad Neurol, 2014, 17(1):1-6. |
| [4] | 王伟, 韦伟, 王安茹, 等. 60%氧暴露对早产大鼠肺血管内 皮生长因子及其受体表达的影响[J]. 中华围产杂志, 2007, 9(3):153-159. |
| [5] | 韦伟, 王伟, 宁琴, 等. 早产鼠高氧暴露后肺组织血管内皮 生长因子和一氧化氮合酶的动态变化及相互关系[J]. 中国当 代儿科杂志, 2007, 9(5):473-478. |
| [6] | Ghelfi E, Yu CW, Elmasri H, et al. Fatty acid binding protein 4 regulates VEGF-induced airway angiogenesis and inflammation in a transgenic mouse model:implications for asthma[J]. Am J Pathol, 2013, 182(4):1425-1433. |
| [7] | Ozdemir OM, Gözkeser E, Bir F, et al. The effects of resveratrol on hyperoxia-induced lung injury in neonatal rats[J]. Pediatr Neonatol, 2014, 124(10):1875-1891. |
| [8] | Levesque BM, Kalish LA, Winston AB, et al. Low urine vascular endothelial growth factor levels are associated with mechanical ventilation, bronchopulmonary dysplasia and retinopathy of prematurity[J]. Neonatology, 2013, 104(1):56-64. |
| [9] | Esquibies AE, Karihaloo A, Quaggin SE, et al. Heparin binding VEGF isoforms attenuate hyperoxic embryonic lung growth retardation via FLK1-neuropilin-1-PKC dependent pathway[J]. Respir Res, 2014, 15:32. |
| [10] | Ghelfi E, Karaaslan C, Berkelhamer S, et al. Fatty acid-binding proteins and peribronchial angiogenesis in bronchopulmonary dysplasia[J]. Am J Respir Cell Mol Biol, 2011, 45(3):550-556. |
| [11] | Elmasri H, Karaaslan C, Teper Y, et al. Fatty acid binding protein 4 is a target of VEGF and a regulator of cell proliferation in endothelial cells[J]. FASEB J, 2009, 23(11):3865-3873. |
| [12] | Hoo RL, Lee IP, Zhou M, et al. Pharmacological inhibition of adipocyte fatty acid binding protein alleviates both acute liver injury and non-alcoholic steatohepatitis in mice[J]. J Hepatol, 2013, 58(2):358-364. |
| [13] | Shum BO, Mackay CR, Gorgun CZ, et al. The adipocyte fatty acid-binding protein aP2 is required in allergic airway inflammation[J]. J Clin Invest, 2006, 116(8):2183-2192. |
| [14] | Hadchouel A, Franco-Montoya ML, Delacourt C. Altered lung development in bronchopulmonary dysplasia[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3):15-17. |
| [15] | Sun H, Choo-Wing R, Fan J, et al. Small molecular modulation of macrophage migration inhibitory factor in the hyperoxiainduced mouse model of bronchopulmonary dysplasia[J]. Respir Res, 2013, 1465(28):14-27. |
 2014, Vol. 16
2014, Vol. 16