心肌炎是儿童发病和死亡的重要原因之一, 柯萨奇病毒(coxsakievirus B3,CVB3) 所致的病 毒性心肌炎(viral myocarditis,VMC)是最常见病 因[1],可导致严重的心肌损伤、心肌纤维化。心肌 组织过度纤维化引起心脏结构和功能异常,被认 为是心肌炎发展到心肌病的关键因素,导致多种 严重的并发症:心律失常、心力衰竭、心脏性猝 死等。目前,VMC 的治疗主要是通过改善心肌营养、 大剂量丙种球蛋白免疫调节、皮质激素等对症支 持治疗。近年来,肥大细胞和骨桥蛋白(osteopontin, OPN)在心血管疾病的研究取得了一定进展,肥大 细胞和OPN 可能参与VMC 的急性期炎症反应及 恢复期的胶原合成,最终导致心肌纤维化,并且 肥大细胞还可能通过直接自分泌OPN 来参与心肌 炎发病,影响VMC 预后。
曲尼司特(tranilast,TL)作为一种肥大细胞 稳定剂主要应用于治疗变态反应性疾病。最近, TL 被报道可抑制多种器官纤维化,比如肝纤维化、 肾纤维化、心纤维化等[2, 3, 4],为临床治疗纤维化疾 病提供一个新的途径。本研究利用CVB3 建立小鼠 VMC 模型,用肥大细胞稳定剂TL 进行干预,检测 心肌组织肥大细胞数目、OPN 及转化生长因子-β1 (transforming growth factor-β1,TGF-β1) 表达, 探讨TL 在VMC 心肌纤维化中的可能作用。 1 材料与方法 1.1 实验动物及病毒
72 只4 周龄健康纯种雄性BALB/C 小鼠 由中南大学湘雅医学院动物学部提供,体重 17.0±0.8 g,饲养于SPF 环境中。嗜心性CVB3 Nancy 株由上海第二医科大学微生物教研室惠赠。 储存于-80℃冰箱中。 1.2 主要试剂
TL 购于中国药科大学制药厂。OPN、TGF-β1 引物由南京金斯瑞生物科技公司合成;TRIzol、 PCR Mix 和Marker I 等购于康为世纪公司;逆转录 试剂盒购于Ferments 公司。兔抗小鼠OPN 一抗购 于Abcam 公司;兔抗小鼠TGF-β1 一抗购于Santa Cruz 公司。抗兔二抗、ABC 试剂盒和DAB 试剂盒 均购于美国Vector 公司。 1.3 动物模型及分组
72 只4 周龄雄性BALB/C 小鼠完全随机分为 对照组、模型组及干预组,每组24 只,各组又按 照造模后7、14、28 d 分为3 个亚组(n=8)。对 照组腹腔内注射0.1 mL 不含病毒的Eagles 培养液; 模型组及干预组小鼠参照Fairweather 等[5] 的实验 方法建立VMC 模型:即腹腔内注射0.1 mL 含100 半数组织培养感染量(TCID50)的CVB3 的病毒 液造模;造模后干预组小鼠立即予TL 灌胃给药(每 日200 mg/kg,药物浓度20 mg/mL),维持TL 给 药直到取材前一天;对照组和模型组小鼠予等量 生理盐水灌胃。全部小鼠常规饲养,全程记录小 鼠的一般情况。 1.4 标本采集
病毒接种日定为0 日,选择造模后第7、14、 28 天为时间点,各随机挑选8 只小鼠断颈法处死, 开胸摘取心脏并沿左室长轴切开,一部分迅速保 存于-70℃冰箱用于RT-PCR 测定;另一部分心脏 标本置于4% 多聚甲醛固定24 h 后,常规脱水、 浸蜡、包埋、切片,进行染色观察、免疫组化等 检测。 1.5 病理学检测
常规苏木精- 伊红(hematoxylin-eosinstaining, HE)染色,光镜下观察心肌病理改变。每个标本 随机选取5 张切片,每张切片随机观察5 个高倍 镜视野,参照Rezkalla 等[6] 方法半定量计算心肌 病理组织积分:无病变计0 分,病变面积<25% 计1 分,25%~50% 计2 分,50%~75% 计3 分, >75% 计4 分。
采用Masson 三色染色,光镜下观察心肌胶原 纤维,计算胶原容积分数(collagen volume fraction, CVF),CVF= 胶原面积/ 总面积×100%。 1.6 肥大细胞染色
常规石蜡切片,行甲苯胺蓝染色、硫堇染色, 光镜下观察肥大细胞数量及脱颗粒情况,每个标 本随机选取5 张切片,每张切片随机观察5 个高 倍镜视野,计算肥大细胞的数量。 1.7 RT-PCR 检测心肌组织中OPN mRNA、 TGF-β1 mRNA 的表达
取各时间点心肌组织,TRIzol 提取总RNA, 逆转录合成cDNA,经过PCR 扩增后,将目的产物于1.5% 的琼脂糖凝胶上进行电泳,110 V 电压 下跑胶30 min。引物序列如下: 内参β-actin 引物 序列:上游:5'-CCACAGCTGAGAGGGAAATC-3', 下游:5'-TCTCCAGGGAGGAAGAGGAT-3', 片段长度:108 bp;OPN 引物序列: 上游: 5'-CCGAGGTGATAGCTTGGCTTATG-3',下游: 5'-TGGCTGCCCTTTCCGTTGTT-3' ,片段长度 201 bp;TGF-β1 引物序列:上游:5'-CGGAAGCGCATCGAAGCCATCC- 3',下游:5'-GCAAGCGCAGCTCTGCACGGGAC- 3',片段长度345 bp。PCR 反应 体系共20 μL,OPN 反应条件为:95 ℃ 预变性 3 min;95℃变性30 s,59℃退火30 s,72℃延伸 30 s,共35 个循环;72℃再延伸5 min,4℃保存。 TGF-β1 的反应条件为:95℃预变性5 min;95℃ 变性30 s,55℃退火30 s,72℃延伸1 min,共30 个循环;72℃再延伸10 min,4℃保存。 1.8 免疫组化ABC 染色法检测OPN、TGF-β1 的表达
切片脱蜡至水,80℃抗原修复20 min,切片 自然冷却后PBS 洗2 次,每次5 min,过氧化氢浸 泡5 min,羊血清封闭40 min,一抗4℃过夜,二 抗室温放置2 h,ABC 室温放置2 h,DAB 显色, 封片。光镜下观察,每个标本随机选取5 张切片, 每张切片随机观察5 个高倍视野,采用Metic Med 6.0 数码医学图像分析系统检测每个视野内OPN、 TGF-β1 阳性表达率。 1.9 统计学分析
采用SPSS 17.0 统计软件包对数据进行统计学 分析,计量资料以均数± 标准差(x±s)表示, 多组间比较采用单因素方差分析,组间两两比较 用SNK-q 检验;相关分析采用直线相关分析, P<0.05 为差异有统计学意义。 2 结果 2.1 动物一般情况
整个实验过程中,无小鼠死亡,全部纳入研究。 对照组小鼠一般情况可,无异常表现;而模型组 及干预组小鼠在病毒接种后出现焦躁、拱背,毛 发暗淡、粗糙、易掉毛等现象,甚至出现精神萎靡、 对刺激反应减淡、觅食减少和体重减轻等现象; 干预组小鼠的表现较模型组轻。 2.2 心肌组织病理改变
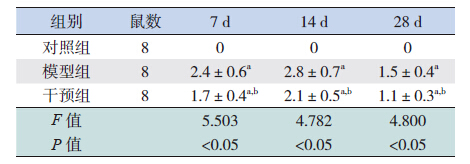
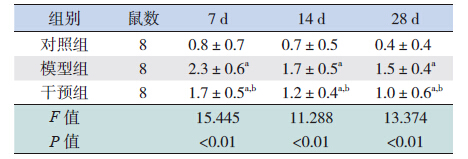
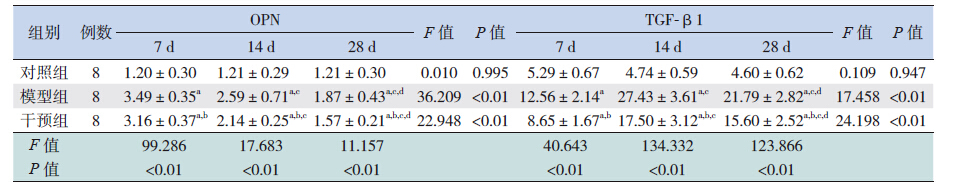
HE 染色显示对照组小鼠心肌细胞排列规则、 整齐,胞核呈卵圆形,血管周围无明显炎性细胞 浸润。模型组小鼠感染后第7 天心肌细胞出现水肿, 部分坏死崩解,伴有炎性细胞浸润,主要在血管 周围;第14 天仍可见炎性细胞浸润,心肌坏死加重, 细胞排列紊乱,部分心肌细胞萎缩;第28 天炎性 细胞浸润基本消失,代之以成纤维细胞,纤维化 明显。干预组小鼠病变较模型组小鼠病变轻(图 1)。Masson 三色染色显示光镜下心肌胶原纤维染 呈蓝色,细胞质染呈红色,细胞核呈蓝褐色。对 照组小鼠各时间点心肌血管周围及间质极少见蓝 色胶原纤维。模型组第14 天血管周围可见少量蓝 色胶原纤维,但心肌间质无明显胶原;第28 天可 见大量排列紊乱的蓝色胶原纤维。各时间点,干 预组小鼠蓝色胶原纤维较模型组小鼠少,但较对 照组多(图 2)。各时间点,对照组小鼠病理积分 为0,干预组小鼠心肌病理积分均较模型组低(均 P<0.05)(表 1);干预组CVF 均较模型组低(均 P<0.05),但高于对照组(均 P<0.05)(表 2)。
| 表 1 各时间点各组心肌组织病理积分比较 |
| 表 2 各时间点各组心肌组织CVF 比较 |
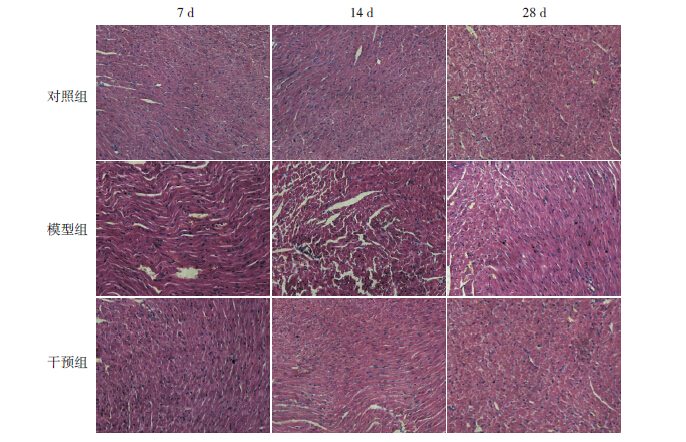 |
图 1 各组心肌组织病理改变(苏木精- 伊红染色,×200)对照组小鼠心肌排列规则、整齐,血管周围无明显 炎性细胞浸润。模型组小鼠感染后第7 天心肌细胞出现水肿,部分坏死崩解,伴有炎性细胞浸润,主要在血管周围;第14 天 仍可见炎性细胞浸润,心肌坏死加重,细胞排列紊乱,部分心肌细胞萎缩;第28 天炎性细胞浸润基本消失,代之以成纤维细 胞,纤维化明显。干预组各时间点病变较模型组病变轻。 |
 |
图 2 各组心肌组织胶原纤维染色结果(Masson 染色,×200)光镜下心肌胶原纤维染呈蓝色,细胞质染呈红色, 细胞核呈蓝褐色。对照组小鼠各时间点心肌血管周围及间质极少见蓝色胶原纤维。模型组第14 天血管周围可见少量蓝色胶原 纤维,但心肌间质无明显胶原;第28 天可见大量排列紊乱的蓝色胶原纤维。各时间点,干预组小鼠蓝色胶原纤维较模型组小 鼠少,但较对照组多。 |
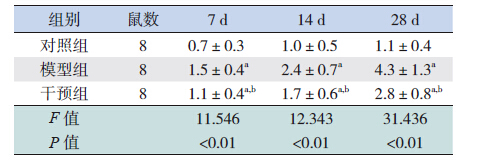
肥大细胞存在于心肌之间和靠近血管的位 置。光镜下观察,可见肥大细胞呈圆形、卵圆形 和不规则形,散在于心肌组织中。甲苯胺蓝染 色、硫堇染色显示肥大细胞为蓝紫色,对照组小 鼠心脏组织中可见少许肥大细胞,形状大多呈圆 形或椭圆形,无明显脱颗粒。模型组和干预组心 脏组织中可见较多蓝紫色的肥大细胞,主要分布 于血管周围,呈不规则状(图 3)。各时间点干预 组小鼠心肌组织肥大细胞数目均低于模型组(均 P<0.05),但均较对照组高(均P<0.05),见表 3。
| 表 3 各时间点各组心肌组织肥大细胞数目比较 |
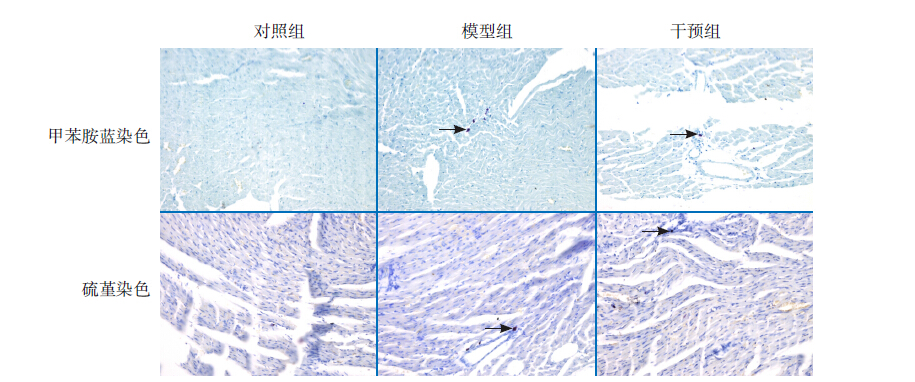 |
图 3 第7 天肥大细胞甲苯胺蓝及硫堇染色图(×200)对照组少见蓝紫色肥大细胞;模型组及干预组血管周 围可见肥大细胞聚集,呈圆形或不规则状,其中干预组的肥大细胞数目要少于模型组。图中箭头所示为肥大细胞。 |
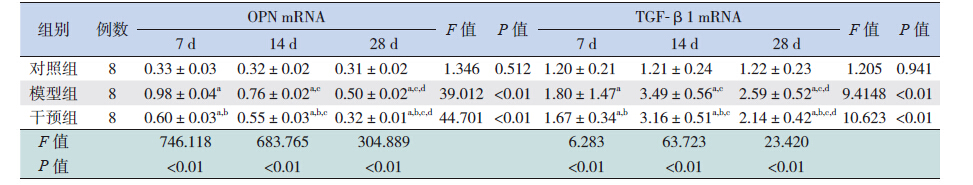
RT-PCR 检测发现,3 组小鼠心肌中均有OPN 及TGF-β1 mRNA 表达,对照组各时间点比较差 异无统计学意义。模型组和干预组小鼠心肌组织 OPN mRNA 表达在第7 天最高,第14 天次之,第 28 天最低(P<0.05);TGF-β1 mRNA 的表达第 7 天升高,第14 天达高峰,第28 天较前稍下降 (P<0.05)。其中,干预组小鼠心肌组织OPN 及 TGF-β1 mRNA 在各时间点的表达均低于模型组 (均P<0.05),但仍高于对照组(均P<0.05)。 见图 4,表 4。
 |
图 4 各时间点各组心肌组织OPN 及TGF-β1 mRNA 表达上图为OPN mRNA 表达;下图为TGF-β1 mRNA 表达; M:Marker(600 bp);1、4、7 为对照组7、14、28 d 条带;2、5、 8 为模型组7、14、28 d 条带;3、6、9 为干预组7、14、28 d 条带。 |
| 表 4 各时间点各组心肌组织OPN 及TGF-β1 mRNA 的相对表达量 |
显微镜下观察到OPN、 TGF-β1 在心肌细胞 的胞浆及间质内表达,呈棕黄色(图 5);统计学 结果提示3 组小鼠心肌细胞OPN、 TGF-β1 的蛋 白水平与mRNA 表达趋势一致,见表 5。
| 表 5 各时间点各组心肌组织OPN 及TGF-β1 的阳性面积表达率 |
 |
图 5 第14 天各组心肌组织OPN 和TGF-β1 蛋白表达(免疫组化,×400)对照组少见棕黄色产物,模型 组胞浆及间质内可见大量棕黄色产物,干预组棕黄色产物较模型组明显减少。图中棕黄色物质为OPN 、TGF-β1 的阳性表达。 |
模型组各时间点心肌组织中OPN mRNA 表 达与肥大细胞数目(甲苯胺蓝染色)呈正相关 (R2=0.4159,P<0.05)。 3 讨论
TL 化学名为N-(3,4 - 二甲氧基肉桂酰基)邻 氨基苯甲酸,其作为一种肥大细胞稳定剂,主要 作用为减少肥大细胞数目并稳定肥大细胞膜抑制 肥大细胞脱颗粒,降低炎性介质及细胞因子的释 放。TL 最初在日本由Kissei Pharmaceuticals 发明, 于1982 年在日本和韩国首次被批准用于治疗Ⅰ型 变态反应疾病如特应性皮炎、过敏性鼻炎、支气 管哮喘等[7]。最近,TL 抗纤维化研究取得了显著 的成果,使其应用的学科和适应病种也不断增加。
肥大细胞在心脏间质基质调节中起重要作用, 细胞外基质成分作为心肌细胞的骨架,决定着心 肌细胞的整体性和有序性。正常心脏表达少量肥 大细胞,在心脏负荷增加或心肌损伤等刺激下, 如VMC [8]、心肌梗死[9] 时肥大细胞数目增加,通 过各种机制介导心脏细胞和其周围的细胞外基质 的相互作用,最终引起心肌纤维化进而引起心脏 的适应性重构。因此,肥大细胞在VMC 的发病及 纤维化过程中有着不可忽视的作用,肥大细胞本 身及其颗粒活性介质以及产生的细胞因子直接或 间接参与了这一过程。OPN 作为一种多功能细胞 因子,能够协同多种炎症细胞分泌的细胞因子激 活成纤维细胞,有报道称OPN 在各种不同的细胞类型中可以调节基质金属蛋白酶的活性(MMPs) [10]。OPN 是肥大细胞脱颗粒释放的介质之一,反 过来,OPN 又可直接影响IgE 介导的肥大细胞脱 颗粒和迁移,从而参与各种病理过程。本课题组 前期研究发现: CVB3 感染心肌成纤维细胞后12 h, OPN mRNA 及蛋白表达即增高,于第2 天达到高 峰,第3 天开始有下降趋势[11],提示CVB3 可诱 导心肌成纤维细胞OPN 表达。VMC 小鼠急性期心 肌 OPN mRNA 表达增加,以第7 天最高,第14 天 开始下降,但仍高于对照组,OPN 可能与VMC 急 性期的炎症反应及恢复期后的胶原合成有关[12]。
本实验中,小鼠感染CVB3 后7 d 出现焦躁、 拱背,毛发粗糙、暗淡、易掉毛等现象,病理切 片显示心肌细胞开始出现混浊肿胀和溶解坏死, 炎性细胞广泛浸润,小鼠的行为异常及病理改变, 提示造模成功。肥大细胞数目,OPN、TGF-β1 的 表达也明显升高,急性期,OPN 通过促进各种炎 性介质的产生及单核细胞、巨噬细胞等炎性细胞 的趋化发挥促炎作用。14 d 时心肌组织仍然可见心 肌细胞坏死及炎性细胞浸润,肥大细胞数目、OPN 表达开始下降,TGF-β1 处于表达高峰,VMC 小 鼠急性期心肌组织大量TGF-β1 表达,是反映心 肌炎症性损伤修复的灵敏指标[13]。Masson 染色 显示心肌组织开始出现少量蓝色纤维。慢性期后 (28 d),心肌组织炎性细胞基本消失,成纤维细胞、 心肌间质增多,心肌纤维化明显。肥大细胞数目、 OPN 的表达明显下降,TGF-β1 的表达较前稍减少, 但仍高于对照组,Masson 染色可见心肌内出现大 量束状、排列紊乱的蓝色纤维,此期CVF 最高, 说明OPN、TGF-β1 参与VMC 慢性期胶原合成。 结合Masson 染色及CVF 结果可知模型组小鼠第28 天时心肌组织纤维化最明显,而此时纤维化因子 TGF-β1 的表达较前有下降,可能与以下原因有 关:(1)慢性VMC 的发展依赖于病毒的持续存 在,聂宏刚等[14] 发现CVB3 反复感染组TGF-β1 含量明显增高,与一次感染组相比差异具有统计 学意义。而本次实验中慢性期VMC 模型组仅采用 了单次病毒注射造模;(2)在心脏纤维化过程中, TGF-β1 的表达先于纤连蛋白和Ⅰ型、 Ⅲ型胶原 的增加,进入慢性期后,TGF-β1 表达虽在下降, 但仍高于对照组,TGF-β1 仍在不停促进胶原及成 纤维细胞生成,累积生成的成纤维细胞又可促进胶 原的合成,因此胶原蛋白表达持续增加。综上所述正常心肌组织中可表达少量OPN 和TGF-β1。模 型组小鼠感染CVB3 后,OPN 的表达第7 天最高, 第14 天次之,第28 天最低,这与本课题组前期 研究相符合[12]。肥大细胞数目与OPN 的表达呈正 相关,提示肥大细胞可能通过自分泌OPN 参与心 肌炎的发生发展过程。TGF-β1 的表达第7 天较 高,第14 天明显升高,第28 天较前稍下降,这 与韩福生等[15] 的研究结果一致。各时间点,TL 干 预后心肌组织肥大细胞数目、OPN 及TGF-β1 的 表达均低于模型组,说明TL 可减少心肌组织OPN 及TGF-β1 的表达,改善心肌纤维化。TL 改善心 肌纤维化的机制可能为:(1)TL 抑制TGF-β1 介导的胶原形成和心肌间质细胞的增殖分化。 TGF-β1 被认为是致心肌纤维化的首要因子,在各 系统与胶原代谢之间起桥梁作用。已有研究发现 TL 有抑制TGF-β1 和抗心肌纤维化的作用[16, 17]。 (2)肥大细胞脱颗粒时可释放OPN,肥大细胞-OPN 信号通路参与VMC 的病理过程。此信号通路可被 肥大细胞稳定剂TL 抑制。正常心脏只表达少量的 OPN,病理状态下,OPN 在心脏中的表达显著增 加[18]。研究发现,肥大细胞可能产生OPN,并通 过各种机制影响OPN 的功能和参与不同的病理过 程[19]。OPN 增强IgE 介导的肥大细胞脱颗粒和迁移, 通过配体结合到肥大细胞表面的同源OPN 受体[20]。 OPN 主要促进Ⅰ型胶原和Ⅲ型胶原分泌,OPN 基 因缺失的小鼠其血管损伤后的胶原含量较正常对 照组明显减少,提示OPN 有可能直接影响胶原生 成[21, 22]。
TL 在临床被广泛应用于变态反应性疾病的治 疗,有良好的耐受性。本实验也证实了它具有较 好的抗心肌纤维化的作用。已有研究证明它能抑 制TGF-β1 的表达,本实验提示其还可能通过减 少肥大细胞数目,进而抑制OPN 的表达,为改善 心肌纤维化提供了一个新的途径。心脏肥大细胞 在心肌炎的发病和纤维化过程中起着重要作用, 应用肥大细胞稳定剂为心肌炎治疗提供了新方法。
志谢:感谢湖南省自然科学基金、中南大学创新 课题基金以及中南大学湘雅三医院重点学科建设基金经 费的支持,感谢形态学实验室周老师及分子生物学实验 室黄老师的实验指导,感谢师姐师妹的无私帮助,使我 得以顺利完成论文。最后,再次对关心、帮助我的老师 和同学表示衷心地感谢。
| [1] | Hua W, Jiang JB, Rong X, et al. The dual role of the cystathionine γ-lyase/hydrogen sulfide pathway in CVB3-induced myocarditis in mice[J]. Biochem Biophys Res Commun, 2009, 388(3):595-600. |
| [2] | Said E, Said SA, Elkashef WF, et al. Tranilast ameliorates impaired hepatic functions in Schistosoma mansoni-infected mice[J]. Inflammophar, 2012, 20(2):77-87. |
| [3] | Tan SM, Zhang Y, Cox AJ, et al. Tranilast attenuates the upregulation of thioredoxin-interacting protein and oxidative stress in an experimental model of diabetic nephropathy[J]. Nephrol Dial Transplant, 2011, 26(1):100-110. |
| [4] | See F, Watanabe M, Kompa AR, et al. Early and delayed tranilast Treatment reduces pathological fibrosis following myocardial infarction[J]. Heart Lung Circ, 2013, 22(2):122-132. |
| [5] | Fairweather D, Rose NR. Coxsackievirus-induced myocarditis in mice:a model of autoimmune disease for studying immunotoxicity[J]. Methods, 2007, 41(1):118-122. |
| [6] | Rezkalla S, Kloner RA, Khatib G, et al. Effect of metoprolol on the acute phase of coxsackievirus B3 murine myocarditis[J]. J Am Coll Cardiol, 1988, 12(2):412-414. |
| [7] | Azuma H, K.Banno T, Yoshimura, et al. Pharmacological properties of N-(3', 4'-dimethoxycinnamoyl) anthranilic acid (N-5'), a new anti-atopic agent[J]. Br J Pharmacol, 1976, 58(4):483-488. |
| [8] | 李辉, 黄林枫, 文纯, 等. 心脏肥大细胞及TLR4 在小鼠病毒 性心肌炎的作用[J]. 中国当代儿科杂志, 2013, 15(10):896-902. |
| [9] | Engels W, Reiters PH, Daemen MJ, et al. Transmural changes in mast cell density in rat heart after infarct induction in vivo[J]. J Pathol, 1995, 177(4):423-429. |
| [10] | Krishnamurthy P, Peterson JT, SubramanianV, et al. Inhibition of matrix metalloproteinases improves left ventricular function in mice lacking osteopontin after myocardial infarction[J]. Mol Cell Biochem, 2009, 322(1-2):53-62. |
| [11] | 孙跃女, 陈淳媛, 杨作成, 等. 柯萨奇病毒B3 诱导体外培 养心肌成纤维细胞增殖与骨桥蛋白表达[J]. 中华儿科杂志, 2008, 46(12):930-931. |
| [12] | 蔡姿丽, 杨敏, 黄林枫, 等. 病毒性心肌炎小鼠心肌骨桥蛋 白和Ⅰ型胶原表达的动态变化[J]. 中南大学学报医学版, 2012, 37(3):271-277. |
| [13] | 成建定, 陈玉川, 胡丙杰, 等. 病毒性心肌炎急性期心肌胶 原增生与TGF-β1 的表达[J]. 法医学杂志, 2000, 16(4):208-216. |
| [14] | 聂宏刚, 关振中, 侯桂英, 等. 反复CVB3 感染对小鼠心肌的 影响[J]. 中国地方病学杂志, 2003, 22(4):295-297. |
| [15] | 韩福生, 孙辉, 刘立志, 等. TIMP-1 mRNA 表达在病毒性心 肌炎小鼠心肌胶原重构中的作用及其与TGF-β1 的关系[J]. 中国地方病学杂志, 2005, 24(6):604-606. |
| [16] | Pinto YM, Pinto-Sietsma SJ, Philipp T, et al. Reduction in left ventricular messenger RNA for transforming growth fact or beta(1) attenuates left ventricular fibrosis and improves survival without lowering blood pressure in the hypertensive TGR(mRen2) 27 rat[J]. Hypertens, 2000, 36(5):747-754. |
| [17] | Hocher B, Godes M, Oliver J, et al. Inhibition of left ventricular fibrosis by tranilast in rats with renovascular hypertension[J]. J Hypertens, 2002, 20(4):745-751. |
| [18] | Schipper ME, Scheenstra MR, van Kuik J, et al. Osteopontin:a potential biomarker for heart failure and reverse remodeling after left ventricular assist device support[J]. J Heart Lung Transplant, 2011, 30(7):805-810. |
| [19] | Nagasaka A, Matsue H, Matsushima H, et al. Osteopontin is produced by mast cells and affects IgE-mediated degranulation and migration of mast cells[J]. Eur J Immunol, 2008, 38(2):489-499. |
| [20] | Bulfone-Paus S, Paus R. Osteopontin as a new player in mast cell biology[J]. Eur J Immunol, 2008, 38(2):338-341. |
| [21] | Ström Å, Franzén A, Wängnerud C, et al. Altered vascular remodeling in osteopontin-deficient atherosclerotic mice[J]. J Vasc Res, 2004, 41(4):314-322. |
| [22] | Trueblood NA, Xie Z, Communal C, et al. Exaggerated left ventricular dilation and reduced collagen deposition after myocardial infarction in mice lacking osteopontin[J]. Circ Res, 2001, 88(10):1080-1087. |
 2014, Vol. 16
2014, Vol. 16