亚低温治疗在一定程度上能够提高新生儿缺 氧 缺 血 性 脑 病(hypoxic-ischemic encephalopathy, HIE)患儿的生存质量,但是仍有 40% 的 HIE 患 儿遗留神经系统后遗症[1]。目前没有良好的血清学 指标能够提示患儿是否在低温治疗中获益和预测 患儿的预后[2],仅能依靠神经系统的检查和评分来 评价患儿的预后。近几年发现神经胶质酸性蛋白 (glial fibrillary acidic protein, GFAP)和泛素羧基末 端 水 解 酶 L1(ubiquitin carboxyl-terminal hydrolase L1, UCH-L1)对脑部疾病有一定的诊断价值 [3,4], 但是在 HIE 中的研究鲜有报道。因此,本研究通 过对 HIE 患儿亚低温治疗前和治疗后血清中 GFAP 和 UCH-L1 进行检测,分析其与患儿血清学指标、 神经学检查、15~18 个月后神经发育评分的关系, 以评价亚低温治疗后这两个指标的变化及其在预 测患儿疗效和预后方面的临床价值。 1 资料与方法 1.1 研究对象
研究对象为2010年1月至2013年1月期间 在我院新生儿重症监护病房住院的 HIE 患儿 64 例, 其中男 34 例,女 30 例。纳入标准包括:(1)胎 龄≥36 周;(2)出生体重≥2 500 g。排除标准包括: 其他合并症、颅内疾病、先天性或遗传性疾病。 HIE 患儿的诊断标准和临床分度参考中华医学会儿 科学分会制定的 HIE 诊断方法[5] ,并均经头颅 CT 扫描确诊。
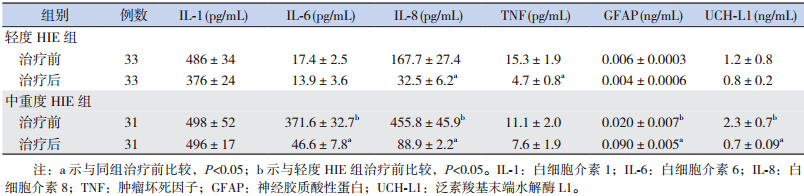
64 例 HIE 患儿中,轻度 HIE 33 例,中、重 度 31 例。两组患儿母亲的一般临床特征和分娩方 式差异无统计学意义(P>0.05),两组患儿的胎 龄、出生体重和性别构成比差异亦无统计学意义 (P>0.05)。轻度患儿采取常规和对症支持治疗, 中、重度患儿除了给予常规和对症支持治疗外, 在出生后 6 h 给予全身亚低温治疗,监测维持肛温 在 34℃左右,持续 72 h。 1.2 血液指标的检测
采集两组患儿治疗前和治疗后(6~12 h)的 血液样本 2 mL,检测患儿血液中的尿素氮(BUN)、 肌酐(Cr)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、 白介素 1(IL-1)、白介素 6(IL-6)、白介素8 (IL-8)、肿瘤坏死因子(TNF)。采用酶联免疫 双抗夹心法(ELISA)检测患儿血清中 GFAP 和 UCH-L1 的水平, GFAP 的 ELISA 试剂盒购自上 海雅吉生物科技有限公司,UCH-L1 的 ELISA 试 剂盒购自北京华夏远洋科技有限公司,操作过程 严格按照试剂盒的说明书操作。酶联免疫分析仪 在 450 nm 处测定光密度 A 值,根据标准曲线计算 GFAP 和 UCH-L1 的含量。 1.3 神经学检查与发育评估
出生后 1 min 对患儿进行 Apgar 评分:≤ 3 分 为重度窒息,4~7 分为轻度窒息,8~10 分为正常。 出生后 2~4 周对患儿进行头颅 MRI 检查,进行临 床神经学评估;出生后 15~18 个月内对接受亚低 温治疗的患儿用贝利婴幼儿发育量表(BSID)[6] 进行评估,评估由 2 位副高以上职称的相关医师 分别单独完成,评分<80 分的患儿为神经发育不良。 1.4 统计学分析
采用 SPSS 19.0 统计软件对所得数据进行统 计学分析。计量资料以均数 ± 标准差(x±s)表 示,两独立样本比较采用成组t检验,治疗前后 的比较采用配对t检验。变量间的相关性分析采用 Spearman 相关性分析。绘制受试者工作特征(ROC) 曲线,选定最佳阈值,分别计算阈值的敏感性、 特异性。以P<0.05 为有统计学意义。 2 结果 2.1 患儿治疗前后血液中各指标的比较
治疗前中、重度 HIE 组血液中 IL-6、IL-8、 GFAP 以及 UCH-L1 水平显著高于轻度组(分别 t=3.375、3.397、3.991、4.493,均P<0.05),见表 1。 相关性分析显示,在所有的入选患儿中,治疗前 的 GFAP 水平与血清 IL-6、 IL-8 水平呈正相关(分 别r=0.54、0.63,均P<0.05),与 Apgar 评分呈负 相关(r=-0.47,P<0.05)。
| 表 1 患儿治疗前和治疗后血液中各指标的比较(x±s) |
轻度HIE组常规治疗后血清IL-8 和 TNF 明显低于治疗前水平(分别t=2.192、1.741, P<0.05)。在中、重度 HIE 组,低温治疗后(6~12 h) 患儿血液中的 IL-6、IL-8、UCH-L1 水平显著低于 治疗前(分别t=3.388、3.390、3.441,P<0.05); 而中、重度患儿血GFAP 水平显著高于治疗前 (t=3.768,P<0.05)。见表 1。 2.2 中、重度HIE患儿治疗后血液各指标与 BSID 评分的关系
生后 2~4 周头颅 MRI 检查发现 4 例中、重度 HIE 患儿有神经学表现的异常,这 4 例患儿亚低 温治疗后(6~12 h)血液中 GFAP 的水平均高于 0.07 ng/mL。生后 15~18 个月时 BSID 评分显示, 6 例患儿神经发育不良(评分 <80 分),其中 4 例 有神经学检查异常,这 6 例患儿认定为预后不良。 表 2 显示,预后不良患儿血液IL-6、 IL-8、TNF 及 GFAP 水平高于预后良好的患儿(P<0.05)。
| 表 2 中、重度 HIE 患儿治疗后血液各指标与神经发育转归的关系(x±s) |
绘 制 ROC 曲 线 发 现,IL-6的诊断曲线下 面 积 (AUC) 为 0.601(95% CI: 0.576~0.705, P<0.05),IL-8 的 AUC 为 0.511(95% CI: 0.487~0.534,P<0.05),GFAP 的 AUC 为 0.714(95% CI: 0.701~0.771,P<0.05),优 于 IL-6和IL-8; UCH-L1 的 AUC 为 0.703(95% CI: 0.687~0.742, P<0.05)( 图 1)。 当 GFAP 的 诊 断 阈 值 为 0.07 ng/mL 时,其诊断的敏感性为 77%,特异性为 78%。
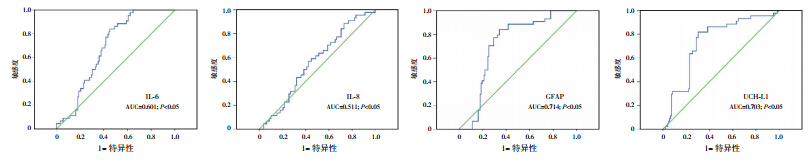 |
图 1 不同血液指标诊断患儿神经学异常的 ROC 曲线 |
HIE 最严重的后遗症是导致患儿神经和智力 发育不良[6]。GFAP 是星形胶质细胞的骨架中间丝 蛋白,是重要的组成部分,是专门的中枢神经系 统表达蛋白[3],近几年研究发现它对颅脑损伤、 脑出血等疾病具有较高的诊断价值,患者血清水 平随着颅脑损伤的严重程度而增加[7]。在脑组织 缺血缺氧的早期,主要刺激星形胶质细胞分泌 GFAP [8],GFAP 又能促进祖细胞分裂为新的星形胶 质细胞,GFAP 表达增强能反映星形胶质细胞处于 活化和分裂状态[9]。但是,随后的研究发现,虽然 星形胶质细胞早期激活能够通过分泌各种因子促 进神经细胞的再生与神经组织的修复,但是由于 星形胶质细胞又能够被多种炎症细胞因子或介质 激活,导致细胞过度增生,因而在脑损伤部位产 生瘢痕修复,反而抑制其他神经细胞的再生和修 复。研究发现 HIE 患儿血清中各种炎症细胞因子 显著升高[10],在脑损伤的后期,由于炎症细胞因 子诱导星形胶质细胞的增生,反而会阻碍神经细 胞的恢复,此时,此类炎症细胞因子对疾病的提 示作用显得不明确起来。而 GFAP 作为星形胶质 细胞的特异性标志,能够一直准确反映细胞增殖 的活动,对 HIE 的提示作用相对准确和稳定。本 研究同时监测了血清 UCH-L1 的水平,UCH-L1 是 一种高度特异性表达在神经元细胞的蛋白[11],其 在血液中含量的升高一般与脑神经细胞损伤或血 脑屏障破坏相关[12]。本研究显示,治疗前中、重 度 HIE 组患儿的血 GFAP、UCH-L1 水平显著高于 轻度组,表明在疾病早期脑细胞遭受一定程度的 破坏,并且早期即开始了星形胶质细胞的自我修 复。而且相关分析显示,治疗前患儿的 GFAP 水 平与血清 IL-6、 IL-8 水平呈正相关、与 Apgar 评 分呈负相关,表明 GFAP 与常规指标一致,均能 反映神经损伤的严重程度。但是,亚低温治疗后 (6~12 h)中、重度患儿血液中 UCH-L1 水平显著 低于治疗前,可能是由于亚低温治疗改善了神经 元细胞破坏的程度,细胞释放的UCH-L1 开始减少, 但中、重度患儿 GFAP 水平仍然高于治疗前水平, 表明星形胶质细胞仍由于各种炎症细胞因子的刺 激处于活跃状态,与 Chalak 等[13] 的研究结果一致。 与其他常见指标相反,GFAP 水平的持续升高或许 能进一步反映患儿后期神经损伤的程度。
虽然一直认为可以通过 MRI 来观察病变脑组 织的损伤类型和损伤部位,从而预测患儿的预后。 但是 MRI 仍然具有诊断的局限性[14],部分患儿由 于脑组织无显著变化,但在后来的发育评分中却 发现神经发育异常,因而错失了早期的监测和治 疗。本研究显示,6 例患儿在 15~18 个月的 BSID 评分中表现出异常,继而被评为发育不良,而在 这 6 例患儿中,仅有 4 例患儿有神经学评估的异常, 可见,MRI 在诊断 HIE 上欠缺一定的灵敏度。除 此之外,这 6 例患儿的血清 GFAP 的水平显著高于 预后良好的患儿。通过 ROC 曲线的分析, GFAP 和 UCH-L1 的 AUC 高于 IL-6和IL-8,当 GFAP 的 诊断阈值为 0.07 ng/mL 时,其诊断的灵敏度和特 异性均较高。因此,结合患儿血清 GFAP 的水平 能够辅助头颅 MRI 的诊断和预测患儿神经发育不 良,提高现有诊断手段的灵敏度。
总之,对HIE 患儿亚低温治疗和预后的临 床评估目前有一定的局限性,寻找能够准确反映 脑细胞变化的血清学标记物是目前的重要挑战。 本研究中,在亚低温治疗后,HIE 患儿血清中 UCH-L1 水平明显降低,而 GFAP 水平持续升高, 提示血清 GFAP、UCH-L1 能够反映亚低温治疗后 脑细胞的变化,有望成为新一代的血清学辅助诊 断标记物。
| [1] | 母得志. 新生儿缺氧缺血性脑病的诊断与治疗[J]. 实用儿科临床杂志, 2011, 26(14): 1144-1147. |
| [2] | Douglas-Escobar M, Weiss MD. Biomarkers of brain injury in The premaTure infanT[J]. FronT Neurol, 2012, 3(1): 185-192. |
| [3] | Middeldorp J, Hol EM. GFAP in healTh and disease[J]. Prog Neurobiol, 2011, 93(3): 421-443. |
| [4] | Papa L, Akinyi L, Liu MC, eT al. UbiquiTin C-Terminal hydrolase is a novel biomarker in humans for severe TraumaTic brain injury[J]. CriT Care Med, 2010, 38(1): 138-144. |
| [5] | 中华医学会儿科学新生儿学组. 新生儿缺血缺氧性脑病诊断标准[J]. 中国当代儿科杂志, 2005, 7(2): 97. |
| [6] | 赖燕全, 陈敬华, 龙凤雅. 贝利婴幼儿发育量表对婴幼儿脑瘫康复疗效的评估[J]. 中国妇幼保健, 2008, 23(5): 659-660. |
| [7] | Papa L, Lewis LM, Falk JL, eT a1. ElevaTed levels of serum glialfibfilary acidic proTein breakdown producTs in mild and moderaTe TraumaTic brain injury are associaTed wiTh inTracranial lesions and neurosurgical inTervenTion[J]. Ann Emerg Med, 2012, 59(6): 471-783. |
| [8] | Silver J, Miller JH. RegeneraTion beyond The glial scar[J]. NaT Rev Neurosci, 2004, 5(2): 146-156. |
| [9] | Liu NK, Zhang YP, TiTsworTh WL, eT a1. A nove1 role of phospholipase A2 in mediaTing spinal cord secondary injury[J]. Ann Neurol, 2006, 59(4): 606-619. |
| [10] | FosTer-Barber A, Dickens B, Ferriero DM. Human perinaTal asphyxia: correlaTion of neonaTal cyTokines wiTh MRI and ouTcome[J]. Dev Neurosci, 2001, 23(3): 213-218. |
| [11] | Brophy GM, Mondello S, Papa L, eT a1. BiokineTic analysis of ubiquiTin C-Terminal hydrolase-L1(UCH-L1) in severe TraumaTic brain injury paTienT biofluids[J]. J NeuroTrauma, 2011, 28(6): 86l-870. |
| [12] | Mondello S, LinneT A, Buki A, eT a1. Clinical uTiliTy of serum levels of ubiquiTin C-Terminal hydrolase as a biomarker for severe TraumaTic brain injury[J]. Neurosurgery, 2012, 70(3): 666-675. |
| [13] | Chalak LF, Sanchez PJ, Adams-HueT B, eT al. Biomarkers for severiTy of neonaTal hypoxic-ischemic encephalopaThy and ouTcomes in newborns receiving hypoThermia Therapy[J]. J PediaTr, 2014, 164(3): 468-474. |
| [14] | 蔡清, 薛辛东, 富建华. 新生儿缺氧缺血性脑病研究现状及进展[J]. 中国实用儿科杂志, 2009, 24(12): 968-971. |
 2014, Vol. 16
2014, Vol. 16