Th17及其效应因子白细胞介素-17 (interleukin-17,IL-17)与呼吸道过敏性疾病有 着密切的关系。有研究指出:Th17、IL-17 可以导 致过敏性哮喘(allergic asthma, AS),IL-17 与哮 喘小鼠的气道高反应有关[1]。目前认为,诱导调 节性 T 细胞(regulatory T cells, Tregs)的生成可能 是舌下特异性免疫治疗(sublingual immunotherapy, SLIT)的机制。然而,Tregs 的效应因子 IL-10 不 能抑制 IL-17 的表达 [2]。那么,究竟何种物质能 够抑制 IL-17 的表达呢?近期研究发现:IL-17 及 IL-17 依赖性气道高反应被明显抑制与IL-35 有 关,而 与 IL-10 无 关 [3] 。 为 探 索 SLIT 与 IL-17、 IL-35 之间的关系,本文拟对过敏性鼻炎(allergic rhinitis,AR)和 / 或轻度 AS 患儿经 SLIT 治疗 1、 2 年时血清 IL-17、IL-35 水平的变化及临床疗效进 行研究,现报告如下。 1 资料与方法 1.1 研究对象
随机选取 2011 年 1~12 月在江西省儿童医院 门诊治疗的 30 例粉尘螨 AR 和 / 或 AS 患儿为研究 对象,其中男 21 例,女 9 例;年龄 4~14 岁,平 均年龄 7.3±2.4 岁;病程 1~3 年(平均 1.6 年)。 AR 患儿 5 例,AS 患儿 17 例,AR 合并 AS 患儿 8 例。 入组标准:(1)AS 入选者均为非急性发作 期的轻度患儿,诊断及分级标准依据儿童哮喘防 治常规(试行)[4],且在行 SLIT 前 1 秒钟用力呼 气容积(FEV1)或气道阻力与预计值之比(%) 在正常范围,如 FEV1/ 预计值≥ 85% 或气道阻力 / 预计值≤ 100%;AR 患儿诊断符合变应性鼻炎的 诊断及疗效判定标准[5];(2)治疗前粉尘螨点刺 试验阳性(2+ 及以上),其他过敏原阴性或阳性(2+ 以下);(3)过去从未使用过尘螨提取液治疗; (4)排除免疫缺陷疾病、肿瘤及一直服用 β 受 体阻滞剂的患儿;(5)采血前 7 d 未用过抗过敏 药物;(6)均规则使用吸入或鼻内皮质类固醇治 疗 1 个月以上,效果欠佳(发作次数或使用对症 缓解药物治疗的剂量未见明显减少)。
另随机选取 30 例来我院儿童保健科体检的 健康儿童为对照组,其中男 22 例,女 8 例;年龄 4~14 岁,平均年龄 7.2±2.3 岁。均无家族及个人 过敏性疾病史,且近 1 个月内无上呼吸道感染病 史。两组性别、年龄比较差异均无统计学意义(均 P>0.05),具有可比性。本研究获得医院伦理委员 会批准,并取得患儿家属知情同意。 1.2 治疗方案
采用舌下含服粉尘螨滴剂(浙江我武生 物科技有限公司生产,商品名:畅迪,批号: 201101001、201104004、201108005、201111004) 对病例组患儿进行脱敏治疗。治疗分为剂量递 增期和维持期两个阶段,具体使用方法依照药 品说明书进行:第 1、2、3 周分别使用滴剂 1 号 (1 μg/mL)、2 号(10 μg/mL)、3 号(100 μg/mL) 作为递增期用药,1、2、3 号滴剂每周 7 d 的剂量 依次为 1、2、3、4、6、8、10 滴;从第 4 周开始 使用滴剂 4 号(333 μg/mL),每次 3 滴至治疗 2 年。 具体用药方法:患儿自行或在家长协助下将粉尘 螨滴剂滴于舌下,含 1~3 min 后吞咽,每日 1 次, 固定时间用药。因病例组患儿入组时曾规则使用 吸入或鼻内皮质类固醇治疗效果欠佳,故本组患 儿行 SLIT 治疗期间未使用吸入或鼻内皮质类固醇 药物治疗;治疗期间,如有鼻炎、哮喘发作必要 时加用对症缓解药物治疗。 1.3 标本收集、保存及处理
(1)采集对照组及病例组(SLIT 治疗前 及治疗 1、2 年时)外周静脉血 3 mL,室温放置 30 min,然后 1 000×g 离心 20 min,将上清液置 于 -80℃冰箱保存,用于酶联免疫吸附试验法检测 IL-17、IL-35 水平。
(2)取对照组及病例组(SLIT 治疗前及治疗 1、2 年时)的外周血,使用全自动血液分析仪检 测嗜酸性粒细胞(eosinophill, Eos)计数值。
(3)病例组中年龄≥ 6 岁的患儿于 SLIT 治 疗前及治疗 1、2 年时均行肺功能 FEV1/ 预计值测 定,而年龄 <6 岁的患儿行气道阻力 / 预计值测定; 对照组儿童行肺功能 FEV1/ 预计值(年龄≥ 6 岁) 或气道阻力 / 预计值(年龄 <6 岁)测定作为对照; 使用法国 SDR 肺功能仪检测。 1.4 临床疗效的判定
(1) SLIT 对鼻炎的临床疗效:以鼻炎症 状评分为准[6],并以 SLIT 治疗前及治疗 1、2 年 时病例组中患儿的鼻炎症状总评分(total rhinitis symptoms score, TRSS)来计算改善百分率,从而 评价 SLIT 对鼻炎的临床疗效,计算方法:改善 百分率 =(治疗前总分 - 治疗后总分)/ 治疗前总 分 ×100%。≥ 66% 为显效,26%~65% 为有效, ≤ 25% 为无效。
(2) SLIT 对哮喘的临床疗效:通过监测治 疗前及治疗 1、2 年时的儿童哮喘控制水平[7] 及哮 喘症状评分[8] 来评价 SLIT 对哮喘的临床疗效。儿 童哮喘控制水平分为控制、部分控制及未控制, 计算治疗前及治疗 1、2 年时病例组中哮喘患儿的 控制水平百分率及哮喘症状总评分(total asthma symptoms score, TASS)改善百分率(计算方式同 TRSS),从而评价 SLIT 对哮喘的临床疗效。 1.5 统计学分析
使用 SPSS 20.0 统计软件对数据进行统计学分 析,符合正态分布的计量资料采用均数 ± 标准差 (x±s)表示,多组间比较采用方差分析;不符合 正态分布的计量资料以中位数(四分位间距)[P50 (P25,P75)] 表示,组间比较采用秩和检验;计 数资料采用率(%)表示,组间比较采用χ 2 检验。 相关性分析采用 Pearson 相关性分析法,P<0.05 为 差异有统计学意义。 2 结果 2.1 两组血清 IL-17 和 IL-35 水平比较
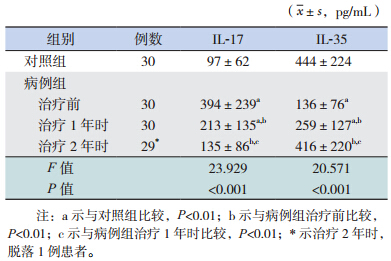
病例组 SLIT 治疗 1 年时的血清 IL-17 水平较 治疗前明显降低(P<0.01),治疗 2 年时较治疗 1 年时亦明显降低(P<0.01);且治疗前和治疗 1 年 时的血清 IL-17 水平均明显高于对照组(P<0.01), 而治疗 2 年时与对照组比较差异无统计学意义 (P>0.05)。病例组血清 IL-35 水平在治疗前后的 变化趋势与 IL-17 的变化趋势刚好相反。见表 1。
| 表 1 两组血清 IL-17 及 IL-35 水平的比较 |
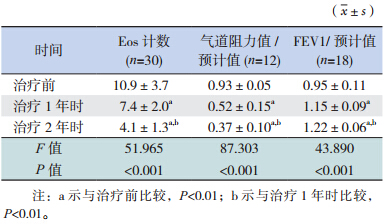
病例组 SLIT 治疗 1 年时的 Eos 计数和气道阻 力 / 预计值均较治疗前降低(P<0.01),治疗 2 年 时较治疗 1 年时均降低(P<0.01);而治疗 1 年时 的 FEV1/ 预计值较治疗前增高(P<0.01),治疗 2 年时较治疗 1 年时亦增高(P<0.01)。见表 2。
| 表 2 病例组 SLIT 治疗前后 Eos 计数及肺功能指标的比较 |
病例组SLIT治疗前及治疗1年时,血清 IL-17 与 IL-35 水平间均呈负相关(分别r=-0.35、 -0.33,均P<0.05)。 2.4 病例组 SLIT 治疗前后 TRSS 及 TASS 的比 较
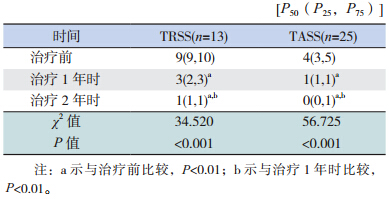
病例组 SLIT 治疗 1 年时的 TRSS 及 TASS 较 治疗前均明显降低(P<0.01),治疗 2 年时较治疗 1 年时亦均明显降低(P<0.01),见表 3。
| 表 3 病例组 SLIT 治疗前后 TRSS 及 TASS 的比较 |
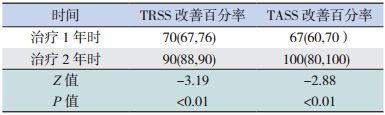
病例组 SLIT 治疗 2 年时 TRSS 及 TASS 的改 善百分率均较治疗1 年时明显增高(均P<0.01)(表 4)。SLIT 治疗 AR 1 年时显效 85%、有效 15%, 2 年时显效率达 100%;SLIT 治疗 AS 1 年时控制 76%、部分控制 24%,2 年时控制率达 92%、部分 控制率为 8%。
| 表 4 病例组 SLIT 治疗后 TRSS 及 TASS 改善百分率的 比较[P50(P25,P75 ),%] |
呼吸道过敏性疾病是儿童的常见病,主要 包括 AR、AS 等疾病。AS 与 Th17、IL-17 之间有 密切的关系。有报道指出 Th17、IL-17 可以导致 AS,IL-17 与 Eos 计数、中性粒细胞炎性反应及哮 喘小鼠的气道高反应有关[1,9,10]。
虽然 IL-17 与 AS 之间有着密切的联系,但其 在 SLIT 中的作用仍不完全明确。本研究结果表明: IL-17 在健康儿童、AR 和 / 或 AS 患儿的血清中都 有表达,且患儿的血清 IL-17 水平明显高于健康儿 童,与本课题组前期的研究结果相似[11];SLIT 不 仅能抑制 IL-17 的表达,还能使其水平恢复正常。 此外,本研究结果表明:随 SLIT 治疗时间增加, AR 和 / 或 AS 患儿的 Eos 计数、TRSS、TASS 逐渐 降低,肺功能(FEV1 或气道阻力 / 预计值)逐渐 改善。Eos 计数降低提示患儿的过敏性炎性反应得 以减轻,而 TRSS、TASS 降低及肺功能改善均表明 患儿的临床症状得以改善。可见 SLIT 能减轻 AR 和 / 或 AS 患儿的过敏性炎性反应及临床症状。
有文献报道提出促炎因子 IL-17 能诱导 Th2、 IgE 的水平增高、促进 Eos 炎性反应 [12] ,IL-17 水 平与 Eos 计数、症状评分、药物使用评分之间均 呈正相关[13]。因而,我们推测 SLIT 可能通过调节 IL-17 的表达,进而起到抑制 Eos、中性粒细胞、 IgE 及Th2 表达的作用,从而使IL-17 水平恢复正常、 减轻 AR 和 / 或 AS 患儿的过敏性炎性反应及临床 症状,最终取得对疾病的治疗效果。
一直以来,大家所探讨的免疫抑制因子主要 有 IL-10、TGF-β 两种[14]。二者来源于 Tregs,可 以调节气道炎性反应和气道高反应。然而,IL-10 不能抑制 IL-17 的表达,TGF-β 不能抑制反而促 进 IL-17 的表达 [2,15]。那么,究竟何种物质能够抑 制 IL-17 的表达呢? Collison 等 [16] 发现一种新的具 有抑制活性的 iTregs—iTr35 调节细胞,该细胞通 过 IL-35 介导其活性。IL-35 由 IL-12a、EB 病毒诱 导基因 3(EBV-induced gene 3, EBI3)亚基构成, 具有免疫抑制 / 抑炎活性。本研究结果表明 IL-35 在健康儿童、AR 和 / 或 AS 患儿的血清中都有表达, 且患儿的血清 IL-35 水平明显低于健康儿童,与张 耀源等[17] 的结论相似;SLIT 不仅能促进 IL-35 的 表达,还能使其水平恢复正常。
此外,本研究还发现病例组行 SLIT 治疗前、 治疗 1 年时,血清 IL-17 与 IL-35 水平之间呈负相 关。因而,我们认为在 SLIT 治疗中,IL-35 或许 能抑制 IL-17 的表达。有研究发现 EbI3 - 小鼠出现 IL-17 水平的显著上调 [18] 。另有研究表明 IL-35 不 仅能抑制 Th17 的应答活性,还能抑制 Th17 的生 成[19] 。上述研究表明 IL-35 与 IL-17、Th17 之间存 在密切联系,与本研究结果相符。此外,IL-35 能 有效抑制过敏原特异性 CD4+记忆/效应Th2细胞 介导的气道炎症[20] 。且 IL-35 能抑制 IL-17 的表 达及逆转 IL-17 介导的气道高反应,此过程与 IL-10、TGF-β 无关[3]。而本研究结果表明 SLIT 能抑 制 IL-17 的表达,促进 IL-35 的表达;且 IL-35 或 许能抑制 IL-17 的表达;SLIT 能减轻 AR 和 / 或 AS 患儿的过敏性炎性反应及临床症状。因而,我们 推测 SLIT 可能通过调节 IL-35、IL-17 的表达,进 而起到抑制 Eos、中性粒细胞、IgE 及 Th2 表达的 作用,从而使 IL-35 水平恢复正常,减轻 AR 和 / 或 AS 患儿的过敏性炎性反应及临床症状,最终取 得对疾病的治疗效果;而 IL-35 的作用途径可能与 抑制IL-17 的表达有关,与IL-10 无直接关系。目前, 国内外关于 IL-35 在 SLIT 机制中作用的研究报道 较少,还需作深入的研究。
SLIT 作为皮下注射免疫治疗的替代治疗方 法,不仅不良反应小、给药方便、依从性好,且 具有皮下注射免疫治疗类似的治疗效果[21] 。2009 年,世界变态反应组织宣布 SLIT 是一种安全有效 的治疗 AR 和 AS 的方法[22]。本研究认为 SLIT 能 减轻 AR 和 / 或 AS 患儿的过敏性炎性反应及临床 症状,且治疗 2 年时患儿的鼻炎 / 哮喘症状基本消 失;SLIT 治疗 2 年时的 TRSS、TASS 改善百分率 较治疗 1 年时明显增高,提示治疗的第 2 年期间, AR、AS 患儿的临床症状得到进一步改善;SLIT 治疗 2 年时,该疗法对 AR 的显效率及对 AS 的控 制百分率都较治疗 1 年时进一步增加,提示 SLIT 治疗 2 年的效果较 1 年的更好。因而,我们认为 SLIT 是一种有效治疗儿童 AR 和 AS 的方法,且治 疗 2 年的效果较 1 年的更好。
| [1] | MizuTani N, Goshima H, Nabe T, eT al. ComplemenT C3a-induced IL-17 plays a criTical role in an IgE-mediaTed laTe-phase asThmaTic response and airway hyperresponsiveness via neuTrophilic inflammaTion in mice[J]. J Immunol, 2012, 188(11): 5694-5705. |
| [2] | Naundorf S, Schroder M, Hoflich C, eT al. IL-10 inTerferes direcTly wiTh TCR-induced IFN-gamma buT noT IL-17 producTion in memory T cells[J]. Eur J Immunol, 2009, 39(4): 1066-1077. |
| [3] | WhiTehead GS, Wilson RH, Nakano K, eT al. IL-35 producTion by inducible cosTimulaTor (ICOS)-posiTive regulaTory T cells reverses esTablished IL-17-dependenT allergic airways disease[J]. J Allergy Clin Immunol, 2012, 129(1): 207-215. |
| [4] | 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [5] | 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组、小儿学组, 中华儿科杂志编辑委员会. 儿童变应性鼻炎诊断和治疗指南(2010年,重庆)[J]. 中华耳鼻咽喉头颈外科杂志, 2011, 46(1): 78. |
| [6] | 王丽敏, 付中夏, 练键勤, 等. 舌下特异性免疫治疗儿童变应性鼻炎和过敏性哮喘的临床评价[J]. 内蒙古医学院学报, 2009, 31(3): 272-275. |
| [7] | 刘靖, 张晓波, 冯海燕, 等. 影响儿童哮喘粉尘螨特异性免疫疗效的因素分析[J]. 中国当代儿科杂志, 2012, 15(10): 854-859. |
| [8] | 马香萍, 多力坤. 舌下特异性免疫治疗对粉尘螨过敏性哮喘儿童的作用[J]. 中国当代儿科杂志, 2012, 12(5): 344-347. |
| [9] | Fogli LK, Sundrud MS, Goel S, eT al. T cell-derived IL-17 mediaTes epiThelial changes in The airway and drives pulmonary neuTrophilia[J]. J Immunol, 2013, 191(6): 3100-3111. |
| [10] | Dias PM, Banerjee G. The role of Th17/IL-17 on eosinophilic inflammaTion[J]. J AuToimmun, 2013, 40: 9-20. |
| [11] | 朱双桂, 陈强, 刘建梅, 等. 粉尘螨滴剂治疗粉尘螨致敏过敏性鼻炎和哮喘的疗效及其作用机制[J]. 山东医药, 2011, 51(25): 63-64. |
| [12] | Oboki K, Ohno T, SaiTo H, eT al. Th17 and allergy[J]. Allergol InTern, 2008, 57(2):121-134. |
| [13] | Ciprandi G, De Amici M, Murdaca G, eT al. Serum inTerleukin-17 levels are relaTed To clinical severiTy in allergic rhiniTis[J]. Allergy, 2009, 64(9): 1375-1378. |
| [14] | Olson BM, Sullivan JA, Burlingham WJ. InTerleukin 35: a key mediaTor of suppression and The propagaTion of infecTious Tolerance[J]. FronT Immunol, 2013, 4: 315. |
| [15] | Lee S, Hwang HJ, Kim Y. Modeling The role of TGF-β in regulaTion of The Th17 phenoType in The LPS-driven immune sysTem[J]. Bull MaTh Biol, 2014, 76(5): 1045-1080. |
| [16] | Collison LW, Workman CJ, Kuo TT, eT al. The inhibiTory cyTokine IL-35 conTribuTes To regulaTory T-cell funcTion[J]. NaTure, 2007, 450(7169): 566-569. |
| [17] | 张耀源, 张孔. 支气管哮喘患者血清白细胞介素35水平变化及意义[J]. 中山大学学报(医学科学版), 2012, 33(3): 398-401. |
| [18] | Liu JQ, Liu Z, Zhang X, eT al. Increased Th17 and regulaTory T cell responses in EBV-induced gene 3-deficienT mice lead To marginally enhanced developmenT of auToimmune encephalomyeliTis[J]. J Immunol, 2012, 188(7): 3099-3106. |
| [19] | KocheTkova I, Golden S, Holderness K, eT al. IL-35 sTimulaTion of CD39+ regulaTory T cells confers proTecTion againsT collagen II-induced arThriTis via The producTion of IL-10[J]. J Immunol, 2010, 184(12): 7144-7153. |
| [20] | Huang CH, Loo EX, Kuo IC, eT al. Airway inflammaTion and IgE producTion induced by dusT miTe allergen-specific memory/effecTor Th2 cell line can be effecTively aTTenuaTed by IL-35[J]. J Immunol, 2011,187(1): 462-471. |
| [21] | Incorvaia C, Masieri S, ScuraTi S, eT al. The currenT role of sublingual immunoTherapy in The TreaTmenT of allergic rhiniTis in adulTs and children[J]. J AsThma Allergy, 2011, 4: 13-17. |
| [22] | Canonica GW, BousqueT J, Casale T, eT al. Sub-lingual immunoTherapy: World Allergy OrganizaTion PosiTion Paper 2009[J]. Allergy, 2009, 64 Suppl 91: 1-59. |
 2014, Vol. 16
2014, Vol. 16