支气管哮喘(简称哮喘)是淋巴细胞、嗜酸 性粒细胞和肥大细胞等多种炎性细胞及细胞因子 参与的一种慢性呼吸道炎症,目前发病机制尚不 完全清楚。随着人们对 T 淋巴细胞及其相关细胞 因子研究的不断深入及炎症因子诱导 T 细胞分化 机制的进一步阐明,调控气道 T 淋巴细胞失衡及 相关炎症因子表达将是哮喘防治的一个重要方向。 有研究发现,CD4+ CD25+ Foxp3+调节性T 细胞(Treg) 能够抑制免疫,在维持 Th1/Th2 平衡中具有重要作 用;而 IL-33 是能够增加 Th2 分泌的细胞因子,在 诱导哮喘发病中的作用亦不可或缺[1,2]。目前关于 Treg 与儿童支气管哮喘之间关系的研究刚刚起步, IL-33 在哮喘方面的研究亦较少,关于两者是如何 相互作用的将是我们进一步研究的内容之一。故 本研究拟对 CD4+ CD25+ Foxp3+ Treg 及 IL-33 在控制 哮喘免疫应答中的调节机制进行探索,以期找到 控制哮喘的新途径。 1 资料与方法 1.1 研究对象
选取2010年10月至2011年3月在我院呼吸 内科门诊就诊的哮喘急性发作期患儿 45 例和因呼 吸道合胞病毒(RSV)感染致喘息的患儿 50 例为 研究对象。哮喘组男 25 例,女 20 例,年龄范围 1~12 岁,中位年龄 4.1 岁,未予激素及其他治疗, 近期无 RSV 感染(血清 RSV-IgM 阴性);喘息组 男 24 例,女 26 例,年龄范围 1~11 岁,中位年龄 4.2 岁,均为首次发病,所有患儿明确为 RSV 近期 感染(血清 RSV-IgM 阳性,RSV-IgG 阴性),且 均未合并腺病毒、巨细胞病毒及肺炎支原体的近 期感染。以上两组患儿均为足月适龄儿,无产伤 及窒息史,排除先天性心脏病、心肺发育不全及 免疫缺陷等其他疾病,诊断标准参照《诸福棠实 用儿科学》(第 7 版)。另选取同期在我院儿童 保健科门诊行健康体检的儿童 40 例作为健康对照 组,其中男 20 例,女 20 例,年龄范围 3~10 岁, 中位年龄 4.0 岁,该组儿童近两周内无呼吸道感染 病史及服药史,无过敏性疾病及其他慢性疾病史, 家族内无过敏及哮喘史。 1.2 标本的采集
采集各组儿童的肝素锂抗凝外周血 2 mL, 提取外周血单核细胞(PBMC),一半用于流式 细胞仪检测,另一半用于 RT-PCR 检测。另采集 分离胶促凝外周血2 mL,室温静置30 min 后, 1 700 r/min 离心 5 min,取上清于 0.5 mL 离心管中, 储存于 -70℃冰箱中待用。 1.3 流式细胞仪检测
用 200 µL PBS 重 悬 并 调 节 PBMC 浓 度 为 1×10 7 /mL。 取 100 µL细胞悬液,加入20 µL CD4-FITC 和 20 µL CD25-APC 单 克 隆 抗 体(BD Pharmingen 公司,美国),避光反应 20 min;加入 2 mL PBS,250 g 离心 10 min,弃上清;加 2 mL 固 定液(BD Pharmingen 公司),避光反应 10 min; 500 g 离 心 5 min,弃 上 清; 加 入 2 mL PBS, 500 g 离心 5 min,弃上清;加 0.5 mL 破膜剂(BD Pharmingen 公司),避光反应 30 min;加入 2 mL PBS,500 g 离心 5 min,弃上清;重复洗涤 1 次; 加 20 µL Foxp3-PE(BD Pharmingen 公司),避光 反应 30 min;加入 2 mL PBS,500 g 离心 5 min, 弃上清;加入适量 PBS 后上流式细胞仪检测。 1.4 RT-PCR 检测
取3×10 6 PBMC 细胞,根据说明书用 TRIzol 提取总RNA,定量后取1 µg RNA,DNA 酶 I 处 理 后 逆 转 录,取 cDNA 产 物 4 µL 进 行 PCR。 扩增引物由上海生工生物科技有限公司设计合成, 目的基因 Foxp3 上游引物:5'-CAGCACATTCCCAGAGTTCCTC-3',下游引物:5'-GCGTGTGAACCAGTGGTAGATC-3',片段长度 154 bp;内参基因β-actin 上 游 引 物:5'-GCATGGGTCAGAAGGATTCCT-3', 下 游 引 物:5'-TCGTCCCAGTTGGTGACGAT-3', 片段长度 106 bp。PCR 反应体系(25 µL):PCR buffer 2.5 µL,dNTP 2.0 µL,Mg 2+ 1.5 µL,cDNA 1 µL,上下游引物各0.5 µL,Taq 酶 0.2 µL,加 灭菌水至 25 µL。PCR 反应条件: 95℃预变性 3 min;95℃ 变性 30 s,68℃ 退火 30 s,72℃延伸 60 s,共 40 个循环;72℃再延伸 10 min。PCR 产 物于 2% 琼脂糖凝胶上进行电泳,结果以目的基 因 Foxp3 与内参基因β-actin 的吸光度值比表示。 1.5 ELISA 检测
采用ELISA法检测各组血清IFN-γ、 IL-4、IL-5和IL-33 水 平,试 剂 盒 均 购 自 Bender MedSystems 公司(奥地利)。所有步骤严格按照 说明书执行。 1.6 统计学分析 采用 SPSS 13.0 统计软件对数据进行统计学 分析。符合正态分布的计量资料以均数 ± 标准差 (x±s)表示,多组间比较采用方差分析;采用 Pearson 相关系数法进行相关性分析。P<0.05 为差 异有统计学意义。 2 结果 2.1 各组 T 淋巴细胞亚群比例比较
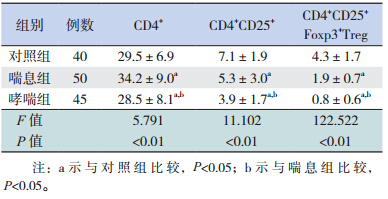
哮喘组 CD4+ 、CD4+ CD25+ 、CD4+ CD25+ Foxp3+ Treg 细胞百分比均低于喘息组及对照组(P<0.05); 喘 息 组 CD4+ 细胞百分比高于对照组,而 CD4 + CD25+ 和 CD4+ CD25+ Foxp3+Treg 细胞百分比均 低于对照组(P<0.05)。见表 1。
| 表 1 各组 T 淋巴细胞亚群比例比较(x±s,%) |
各组外周血 IFN-γ和IL-4 浓度比较差异均无 统计学意义(P>0.05);哮喘组 IL-33 和 IL-5 水平 均高于喘息组和对照组(P<0.05),但喘息组和对 照组间差异均无统计学意义(P>0.05)。见表 2。
| 表 2 各组外周血细胞因子浓度比较(x±s,pg/mL) |
哮喘组患儿体内CD4+ CD25+ Foxp3+Treg 与 IL-4、IL-5水平呈负相关(分别r=-0.325、 -0.287,均P<0.01),IL-33 水 平 与 IL-4、IL-5 呈正相关(分别r=0.214、0.158,均P<0.01), CD4 + CD25+ Foxp3+ Treg 与 IL-33 呈负相关(r=-0.156, P<0.01)。
喘息组患儿体内CD4+ CD25+ Foxp3+Treg 与 IL-4、IL-5水平呈负相关(分别r=-0.205、 -0.160,均P<0.05),IL-33 水平与 IL-4、IL-5无 明显相关性(P均 >0.05),CD4+ CD25+ Foxp3+ Treg 与 IL-33 亦无明显相关性(P>0.05)。 3 讨论
支气管哮喘在儿童中的发病率日趋增高, 70%~80% 的儿童哮喘发病于 5 岁以前,约 20% 的 患儿有家族史、特应性体质。随着对过敏性疾病 和 T 细胞研究的深入,单纯的 Th1/Th2 平衡并不 足以解释过敏性哮喘的发病[3],尚应考虑 Treg 与 Th1/Th2 失衡的关系。
Treg 是一类调节或抑制其它免疫细胞功能的 细胞,在支气管哮喘中的重要作用得到逐渐认识, 在多种免疫性疾病中发挥重要作用。Foxp3 作为一 特殊的转录因子特异地高表达于 CD4+ CD25+ Treg 上,可反映 CD4+ CD25+Treg 活性水平 [4]。在本研究 中,哮喘组 CD4+ CD25+ Foxp3+Treg 比例较对照组及 喘息组低,喘息组较对照组稍低,由此可以说明 喘息的发作机制可能与 Treg 含量降低有关。而哮 喘组患儿体内 CD4+ CD25+ Foxp3+ Treg 与 IL-4、IL-5 水平呈负相关,由此可见,Treg 作为具有调节功 能的 T 细胞,有降低 Th2 型细胞因子的作用。可 以推测, Treg 表达降低将引起 Th1 型细胞因子分 泌减少,Th2 型细胞因子分泌增多,导致 Th1/Th2 比例失衡,诱发哮喘。RSV 感染引起的喘息患儿 体内 CD4+ CD25+ Foxp3+ Treg 与 IL-4、IL-5 水平亦呈 负相关,且 Treg 表达降低,但不如哮喘组明显, 说明病毒感染诱发的喘息在发病方面与哮喘具有 共同机制。
另哮喘的发病和诸多免疫细胞、众多细胞因 子、多种生物介质以及遗传因素有关[5] 。IL-33 是 近年来受到广泛重视的具有多种生物学功能的细 胞因子,为 IL-1 家族新成员,能调节 Th2 的分化 与功能[6] 。IL-33 的受体 ST2 选择性地在 Th2 细胞 上表达,而在 Th1 上不表达。IL-33 能通过主动募 集 Th2 细胞到炎症位点,而使 IL-33 在维持慢性炎 症中起关键的作用[7]。在体外实验中发现,重组 人 IL-33 与 Th2 细胞孵育能增加 Th2 细胞产生 IL-4 和 IL-5,而与 Th1 细胞孵育能降低 Th1 细胞产生 IFN-γ 的水平[8] 。本研究结果得知,哮喘组 IL-33 浓度明显高于对照组,哮喘组患儿体内 IL-33 水平 与 IL-4、IL-5 呈正相关,由此可知,哮喘发病可能 亦与 IL-33 水平增高有关,IL-33 引起 Th2 型细胞 因子如 IL-4、IL-5 分泌增多,引起哮喘发病。RSV 感染引起的喘息患儿中 IL-33 水平较对照组并无明 显改变,且相关性分析显示 IL-33 与 IL-4、IL-5无 明显相关性,提示病毒感染引起的喘息中 IL-33 作 用较小,或者 IL-33 作用被中和。
由此引出本文的猜测,IL-33 与 Treg 之间是否 有相互作用而诱导哮喘的发病?
目前对于 IL-33 的研究较多的是类风湿性关节 炎、溃疡性结肠炎感染、心血管疾病、糖尿病、 肿瘤等[9]。在哮喘和过敏反应的动物实验和体外研 究中证实,减弱 IL-33 的分泌可以减轻疾病相关症 状[10] 。关于哮喘患者外周血 IL-33 变化的临床研 究不多,麻晓燕等[11] 对哮喘患者外周血及痰液中 IL-33 分析后发现,哮喘患者的 IL-33 显著升高, 与本研究结果相符。
本 研 究 CD4+ CD25+ Foxp3+ Treg 与 IL-33 的 相 关性分析显示,哮喘组 Treg 比例与 IL-33 呈负相 关,那么它们是如何相互作用的有待进一步研究。 Ayyoub 等 [12] 的研究结果表明,较高浓度的 IL-1可 与 IL-2 协同,诱导 Treg 细胞转化为 Th17 细胞, 并且下调 Treg 细胞的 Foxp3 表达和抑制功能,由 此我们猜测作为 IL-1 家族成员的 IL-33 可能通过 影响 Treg 分化,从而诱发哮喘。
综上所述,哮喘发病与 Treg 表达降低有关, Treg 表达降低可引起 Th1 型细胞因子分泌减少, Th2 型细胞因子分泌增多,导致 Th1/Th2 比例失衡, 诱发哮喘。RSV 感染诱发的喘息在 Treg 发病方面 与哮喘具有共同机制。哮喘发病亦与 IL-33 水平增 高有关,IL-33 引起 Th2 型细胞因子如 IL-4、IL-5 分泌增多,引起哮喘发病。病毒感染引起的喘息 中 IL-33 作用较小,或者 IL-33 作用被中和。哮喘 患儿体内 Treg 比例与 IL-33 呈负相关,说明二者 在诱发哮喘方面确有相互关系,猜测作为 IL-1家 族成员的 IL-33 可能通过影响 Treg 分化,从而诱 发哮喘。它们是如何相互作用的有待进一步研究。
志谢:感谢无锡市人民医院检验科张健老师 在收集标本中给予的帮助。感谢无锡市人民医院 中心实验室穆会君老师、殷莹老师等在本实验中 给予的悉心指导。感谢邢朝凤、潘姗姗学妹在实 验过程中给予的帮助。
| [1] | Shimizu T, Kida Y, Kuwano K. TriacylaTed lipoproTeins derived from Mycoplasma pneumoniae acTivaTe nuclear facTor-kappa B Through Toll-like recepTors 1 and 2[J]. Immunology, 2007, 121(4): 473-483. |
| [2] | 阳艳丽, 潘玉琴, 何帮顺, 等. 哮喘患儿外周血调节性T细胞和Th1/Th2的变化及其与哮喘病情的关系[J].中国当代儿科杂志, 2011, 13(6): 482-485. |
| [3] | 康妍萌, 丁明杰, 韩玉玲, 等. 重症肺炎支原体肺炎患儿肺泡灌洗液中Th1/Th2细胞免疫应答状况的研究[J]. 中国当代儿科杂志, 2011, 13(3): 188-190. |
| [4] | Zhang M, Qian YY, Chai SJ, eT al. Enhanced local Foxp3 expression in lung Tissue aTTenuaTes airway inflammaTion in a mouse model of asThma[J]. J AsThma, 2014, 51(5): 451-458. |
| [5] | Hardy RD, Jafri HS, Olsen K, eT al. ElevaTed cyTokine and chemokine levels and prolonged pulmonary airflow resisTance in a murine Mycoplasma pneumoniae pneumonia model: a microbiologic, hisTologic, immunologic, and respiraTory pleThysmographic profile[J]. InfecT Immun, 2001, 69(6): 3869-3876. |
| [6] | Baba S, Kondo K, Kanaya K, eT al. Expression of IL-33 and iTs recepTor ST2 in chronic rhinosinusiTis wiTh nasal polyps[J]. Laryngoscope, 2014, 124(4): E115-E122. |
| [7] | STelmaszczyk-Emmel A, Zawadzka-Krajewska A, Szypowska A, eT al. Frequency and acTivaTion of CD4+CD25 Foxp3+ regulaTory T cells in peripheral blood from children wiTh aTopic allergy[J]. InT Arch Allergy Immunol, 2013, 162(1): 16-24. |
| [8] | 魏明,涂玲, 梁颖红, 等. 臭氧暴露对CD4+CD25highFoxp3+T调节性淋巴细胞数量和Foxp3 mRNA表达的影响[J]. 中华劳动卫生职业病杂志, 2013, 31(9): 693-696. |
| [9] | Licona-Limón P, Kim LK, Palm NW, eT al. Th2, allergy and group 2 innaTe lymphoid cells[J]. NaT Immunol, 2013, 14(6): 536-542. |
| [10] | Saglani S, Lui S, Ullmann N, eT al. IL-33 promoTes airway remodeling in pediaTric paTienTs wiTh severe sTeroid-resisTanT asThma[J]. J Allergy Clin Immunol, 2013, 132(3): 676-685. |
| [11] | 麻晓燕, 罗雅玲, 赖文岩. 支气管哮喘患者外周血、痰液中IL-33的含量及其相关性分析[J]. 第三军医大学学报, 2011, 33(14): 1526-1529. |
| [12] | Ayyoub M, Raffin C, Valmori D. GeneraTion of Th17 from human naive CD4+ T cells preferenTially occurs from FOXP3+ Tregs upon cosTimulaTion via CD28 or CD5[J]. Blood, 2012, 119(20): 4810-4812. |
 2014, Vol. 16
2014, Vol. 16