特发性矮小(idiopathic short stature, ISS)一般 是指个体身高低于同年龄、同性别、同种族儿童 身高的平均值 2 SD 以上,无全身性、内分泌、营 养性疾病或染色体异常的状况,且生长激素(GH) 水平正常[1]。2003 年 7 月美国食品与药品管理局 (FDA)正式批准 r-hGH 用于 ISS 的治疗 [2] 。r-hGH 用于 ISS 治疗理论上除可改善矮小儿童的骨代谢、 加快生长速度、增加终身高外,也可能引起一些 风险,如糖耐量受损、心血管改变、甘油三酯和 胆固醇改变、甲状腺功能减退等。对 r-hGH 的药 物的促生长作用,目前国内外医师积累了丰富的 经验,但对于其不良反应的研究尚不多。针对 ISS 儿童应用 r-GH 治疗后是否会影响糖代谢、脂代谢、 甲状腺功能以及存在怎样的变化趋势,本研究通 过分析在北京大学第三医院儿科矮小门诊就诊并 规律应用 r-hGH 治疗、定期随诊的 ISS 儿童的临床 资料,观察 r-hGH 对患儿糖、脂代谢及甲状腺功 能的影响。 1 资料与方法 1.1 研究对象
研究对象为2009年1月至2013年1月北京 大学第三医院儿科矮小门诊治疗的 ISS 儿童 47 例 ( 男 26 例,女 21 例),年 龄 3.5~15 岁,平 均 10±3 岁,其中 12 岁以下儿童 31 例,12~15 岁儿 童 16 例。入选标准:身高低于同年龄、同性别正 常群体平均值 2 SD 以上,无全身性、内分泌、营 养性疾病或染色体异常的状况,且胰岛素或心得 安运动两项药物激发试验后至少有 1 项 GH 峰值 ≥ 10 ng/mL 者。 1.2 治疗方法及随访指标
本研究采用前瞻性研究,r-hGH 治疗前对患 儿进行常规内科检查,测量身高、体重,计算体 重指数(BMI);查血尿便常规、微量元素、肝肾 功能、血脂、甲状腺功能、空腹血糖、空腹胰岛 素、胰岛素样生长因子-1(IGF-1)、骨龄、脑垂 体 MRI 检查;女童需完善血染色体检查、妇科 B 超;完善胰岛素激发试验和心得安运动激发试验; 询问出生史、既往史、生长发育史、父母身高及 青春期发育史、遗传病史、饮食情况;评估儿童 的营养状况及生长发育水平。根据以上病史、体 检及化验检查结果除外各种全身器质性疾病、遗 传代谢病及内分泌疾病、颅内肿瘤、小于胎龄儿、 营养缺乏等,考虑诊断为 ISS。并除外骨骺闭合等 r-hGH 治疗的禁忌症,经家长知情同意后使用r-hGH 治疗。按照美国食品与药品管理局(FDA)批准 r-hGH 用于 ISS 的治疗剂量,使用的 r-hGH 为金磊 赛增水剂,30 IU/ 支(长春金赛药业有限责任公司 生产),青春期前儿童剂量为 0.12~0.15 IU/(kg · d), 青春期儿童为 0.15~0.17 IU/(kg · d),每晚睡前皮下 注射,注射部位为脐周、大腿外侧及上臂外侧。 治疗疗程为 3~24 个月,每 3 个月门诊随诊 1 次。 询问患儿有无注射部位红肿不适,有无怕冷、反 应迟钝、精神抑郁、表情淡漠、皮肤干燥、发凉、 粗糙脱屑、颜面水肿等甲状腺功能减低的表现。 治疗前及随访期间均由同一人、同一仪器测量儿 童身高、体重,并于治疗后第 3、6、9、12、15、 18 及 24 个月分别取空腹静脉血标本进行 IGF-1、 血糖(GLU)、胰岛素(INS)、血脂、甲状腺功 能及肝肾功能、血常规的检测。 1.3 评价糖代谢的指标
(1)空腹 GLU 和 INS 水平。
(2)胰岛素敏感指数(ISI):用HOMA 法计算, ISI=1/(GLU×INS)。
(3) 空 腹 GLU/INS 比 值(FGIR): 先 将 目 前 GLU(mmol/L) 转 换 为 旧 制 单 位 mg/dL (1 mmol/L=18 mg/dL),然后再进行 FGIR 的计算, 并计算 FGIR<7 的比例。
(4)高血糖症为空腹 GLU ≥ 7.0 mmol/L;高 胰岛素血症为血浆 INS>15 mU/L[3],比较治疗前后 所占比例。 1.4 评价脂代谢的指标
(1)总胆固醇(T-CHO)、甘油三酯(TG)、 高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C) 水平。
(2)动脉粥样硬化指数(AI)=(T-CHOHDL-C)/HDL-C。 1.5 评价甲状腺功能的指标
(1)应用化学发光免疫分析法测定 TSH、 FT3、FT4 水平,计算 FT3/FT4 比值。我院所采用 的 TSH、FT4 的正常值分别为 0.35~5.50 μlU/mL、 0.89~1.80 ng/dL。
(2)临床甲减及亚临床甲减:符合以下情况 定义为亚临床甲减:血清 TSH>5.50 μlU/mL,FT4 正常范围,无甲减临床表现。符合以下情况定义为 临床甲减:TSH<0.35 μlU/mL 或 TSH>5.50 μlU/mL; FT4<0.89 ng/dL;伴有或不伴怕冷、反应迟钝、精 神抑郁、表情淡漠、皮肤干燥、发凉、粗糙脱屑、 颜面水肿等临床表现。 1.6 统计学分析
采用 SPSS 19.0 统计软件进行数据处理与统计 学分析。对治疗前后的各项指标进行自身对照比 较。正态分布的计量数据用平均数±标准差(x±s) 表示,多个组的比较采用方差分析,治疗后 0~1 年、 治疗后 1~2 年的数据分别与治疗前的数据比较时 应用 LSD 检验;不满足正态性分布的计量数据用 中位数(范围)表示,治疗前后比较采用两个相 关样本非参数检验。P<0.05 为差异有统计学意义。 2 结果
47 例 r-hGH 治疗的 ISS 儿童中,44 例于治疗 后 0~1 年内,22 例于治疗后 1~2 年内有至少 1 次 复查并完善相关测量及实验室检查。 2.1 治疗前后糖代谢指标的变化
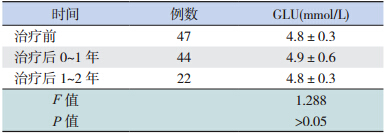
治疗后 0~1 年患儿空腹 GLU 水平与治疗前比 较差异无统计学意义(P=0.163);治疗后 1~2 年 患儿 GLU 水平与治疗前比较差异亦无统计学意义 (P=0.872)(表 1)。
| 表 1 治疗前后空腹 GLU 水平的比较 (x±s) |
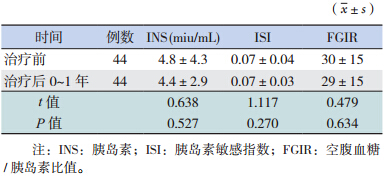
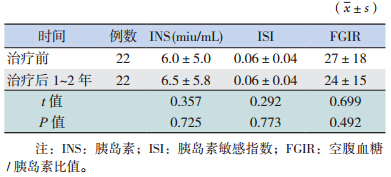
治 疗 后 0~1 年 及 1~2 年 患 儿 血 清 INS、ISI 和 FGIR 水平与治疗前比较差异均无统计学意义 (P>0.05)(表 2~3)。
治疗过程中有 1 例儿童的空腹 GLU 治疗 6 个 月时由治疗前的 5.3 mmol/L 升至 8.0 mmol/L,1 周 后复查 GLU 降至 4.7 mmol/L。治疗前无高胰岛素 血症的发生,治疗后 0~1 年高胰岛素血症的发生 率为 2%(1/44),治疗后 1~2 年为 9%(2/22)。
| 表 2 治疗后 0~1 年 INS、ISI、FGIR 与治疗前的比较 |
| 表 3 治疗后 1~2 年 INS、ISI、FGIR 与治疗前的比较 |
FGIR<7 (提示胰岛素抵抗)的患儿在治疗前 为 13%(6/47),治疗后 0~1 年为 11%(5/44), 治疗后 1~2 年为 18%(4/22)。 2.2 治疗前后脂代谢情况的比较
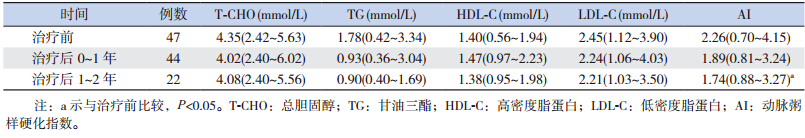
治疗后0~1年及1~2年患儿T-CHO、TG、 HDL-C、LDL-C 水平以及 BMI 与治疗前比较差异 均无统计学意义(P>0.05)。治疗后的 AI 逐渐下 降,治疗后 0~1 年与治疗前比较差异无统计学意 义(P>0.05);治疗后 1~2 年与治疗前比较差异 有统计学意义(Z=2.223,P=0.026)(表 4)。
| 表 4 治疗前后 T-CHO、TG、HDL-C、LDL-C、AI、BMI 的变化 [中位数(范围)] |
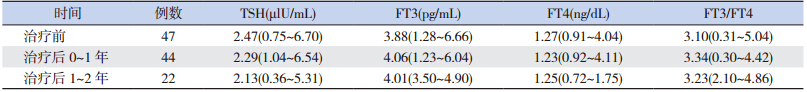
治 疗 后 0~1 年 及 1~2 年 患 儿 TSH、FT3、 FT4、FT3/FT4 比值与治疗前比较差异均无统计学 意义(P>0.05),见表 5。
| 表 5 治疗前后 TSH、FT3、FT4、FT3/FT4 比值的变化 [中位数(范围) |
r-hGH 治疗过程中,未见患儿出现甲减的症 状和体征,无 FT4<0.89 ng/dL 的病例。治疗后共有 3 例 TSH>5.5 μlU/mL,诊断为亚临床甲减,均无甲 状腺疾病家族史,经过优甲乐治疗后亚临床甲减 被控制,未再出现反复。 3 讨论
目前临床应用的 r-hGH 系基因表达技术合成 的,氨基酸含量、序列及蛋白质空间结构与人垂 体 GH 完全一致,其生物效能与 GH 有极大的一致 性[4]。因 GH 生理作用广泛[5] ,故应用 r-hGH 可促 进骨骼的线性生长,同时对糖、脂代谢、甲状腺 功能可能有一定的影响。本研究显示 r-hGH 临床 治疗 ISS 儿童是安全可靠的,可改善脂代谢,对甲 状腺功能无明显影响,无明显 GLU、INS 水平的变 化,但要预防胰岛素敏感性降低的可能。
r-hGH 可通过肝脏、脂肪组织、肌肉组织对 糖代谢发挥调节作用,长期应用可抑制糖吸收, 刺激脂肪分解,抑制糖转换为其他物质,出现 GLU 浓度升高 [6] 。本研究中 ISS 儿童应用 r-hGH 治 疗后空腹 GLU 水平与治疗前相比无显著变化,与 Burgert 等 [7] 报道一致。由 Quigley 等[8] 研究应用 r-hGH 治疗的 275 例 ISS 儿童中,2 例发生轻度糖 代谢紊乱(0.7%),停止 r-hGH 治疗后,很快恢 复正常。辉瑞国际生长数据库提供的研究结果, 在应用 r-hGH 治疗的的 23 333 人中, 85 例(0.36%) 出现糖代谢异常[9]。本研究中治疗后 6 个月时出现 1 例一过性高血糖症,分析原因可能为儿童在检查 前的一段时间内摄入较多含糖类食物造成机体短 时间内糖负荷过重,经过调整饮食后血糖很快降 至正常。研究发现长期应用 r-hGH 可能引起胰岛 素敏感性下降,出现胰岛素抵抗[6]。其机制可能为 r-hGH 诱导产生信号传导抑制蛋白,而其中的信号 传导抑制蛋白-1 和信号传导抑制蛋白-3 可能会导 致胰岛素抵抗及胰岛素信号肽下调[10]。本研究对 治疗前后的血清 INS 水平、ISI 变化进行比较,差 异均无统计学意义,但治疗后 FGIR 有下降趋势, 与 Burgert 等[7] 的试验结果相一致;且治疗后 1~2 年 FGIR<7 (提示胰岛素抵抗)的患儿百分比较治 疗前增加(18% vs 13%);另外,本研究中高胰 岛素血症的发生率有随着治疗时间的延长逐渐升 高的趋势。因此,虽然 r-hGH 治疗 ISS 儿童在治疗 后的空腹 GLU、INS 水平未出现变化,但反映胰岛 素抵抗的指标 FGIR 出现逐渐下降趋势,因此在应 用r-hGH 治疗 ISS 儿童时需注意监测糖代谢指标的 变化,而且不仅只关注 GLU 和 INS 的水平,更要 进行 ISI 和 FGIR 的计算才能更早地发现糖代谢异 常,特别是对于有糖尿病家族史的患者,需更加 密切地监测 GLU 及 INS 水平,观察 ISI 和 FGIR 的 变化[11]。
r-hGH 治疗可通过诱导肝细胞、肌细胞产生 的 GH 介质,对调节血脂起间接作用,也可通过作 用于靶细胞产生生理效应进而产生直接效应[12]。 动物实验发现 r-hGH 能够有效地降低高胆固醇饮 食条件下 TG、LDL-C 水平,以及抑制冠状动脉粥 样硬化的发生。机制可能为 GH 使肝脏 LDL 受体 mRNA表达上调,从而使肝脏摄取LDL 的能力提高, 加速血脂代谢,使 LDL 生成率下降、消除增加, 达到降血脂的作用,进而进一步降低动脉粥样硬 化的发生[13]。Hannon 等[14] 报道,对 ISS 儿童进行 r-hGH 治疗后,T-CHO、LDL 均有下降,且差异有 统计学意义,HDL、TG 无明显变化。本研究结果 显示治疗后的 T-CHO、TG、LDL-C 水平均较治疗 前下降,且呈逐渐下降趋势,但差异无统计学意义; HDL-C 水平有所升高,差异无统计学意义;AI 较 前下降,且在治疗后 1~2 年时差异有统计学意义。 以上结果表明r-hGH 治疗可改善ISS 儿童的脂代谢, 对动脉粥样硬化形成具有保护作用。
当给予 ISS 儿童外源性 r-hGH 治疗后,其体 内 GH 水平升高并刺激下丘脑生长抑素分泌,进 而抑制基础及促甲状腺素释放激素(thyrotropinreleasing hormone, TRH)刺激后的 TSH 分泌,导致 甲状腺功能减低。此外,GH 能促使甲状腺外 T4 向 T3 转化,导致 T4 水平下降[11] 。本研究中 r-hGH 治疗的 ISS 儿童中,未出现甲减的症状和体征,无 FT4、TSH 低于正常值的病例,在治疗后共有 3 例 诊断为亚临床甲减。
曾有美国学者对 105 名 ISS 儿童给予 r-hGH 治疗,TT4、T3 均有下降,但是 FT4 和 TSH 均无 变化[8] 。本研究发现应用 r-hGH 治疗后,ISS 儿童 虽有 TSH 水平逐渐下降、FT3 水平及 FT3/FT4 比 值先升高后下降、FT4 水平先下降后上升,但差异 均无统计学意义。出现 FT3 水平及 FT3/FT4 比值 先升高后下降、FT4 水平先下降后上升,分析可 能原因为:当给予外源性 r-hGH 治疗后,体内 GH 水平升高并刺激下丘脑分泌生长抑素,导致垂体 对下丘脑释放的 TRH 反应迟钝,TSH 的分泌受到 抑制。外源性 GH 治疗使得 T4 的利用和转换增加, TSH 的储备功能不足,使 T4 合成下降,导致血清 T4 水平下降 [15] 。同时可能与 r-hGH 增加 5-脱碘酶 活性,使 T4 在外周组织脱碘转化为 T3 有关。因此, r-hGH 治疗可能影响甲状腺激素的代谢,因此治疗 前应全面评价甲状腺功能,以发现甲状腺激素分 泌降低现象。如已经开始治疗需要根据甲状腺功 能检测结果调整 r-hGH 剂量,必要时补充甲状腺 素及调整 r-hGH 用量。国外有文献建议在甲状腺 素替代治疗的儿童中,r-hGH 用量需要调整 [11]。
综上,国际多中心研究机构通过对多年 r-hGH 临床应用的观察证实,长期应用 r-hGH 治疗 ISS 可 提高最终身高,且 r-hGH 是相对安全的药物,此 已成为大多数临床医师的共识。但在治疗过程中 需按时复查,有必要对怀疑有糖尿病及甲减发病 倾向的个体在接受 r-hGH 治疗时定期进行血生化 检测,对于可能出现的不良反应及时纠正,保证 药物发挥正常的作用及药物治疗的安全性。
| [1] | 颜纯, 王慕逖. 小儿内分泌学[M]. 北京: 人民卫生出版社, 2006: 91-132. |
| [2] | Kemp SF, Frindik JP. Emerging opTions in growTh hormone Therapy: an updaTe[J]. Drug Des Devel Ther, 2011, 5(1): 411-419. |
| [3] | 肖靖, 田慧, 李春霖, 等. 高胰岛素血症与正常胰岛素血症糖耐量低减人群转归差异的探讨[J]. 中华内科杂志, 2012, 51(4): 299-303. |
| [4] | Frindik JP, Kemp SF. Managing idiopaThic shorT sTaTure: role of somaTropin (rDNA origin) for injecTion[J]. Biologics, 2010, 4(1): 147-155. |
| [5] | Harvey S. ExTrapiTuiTary growTh hormone[J]. Endocrine, 2010, 38(3): 335-359. |
| [6] | GoThersTrom G, BengTsson BA, Sunnerhagen KS, eT al. The effecTs of five-year growTh hormone replacemenT Therapy on muscle sTrengTh in elderly hypopiTuiTary paTienTs[J]. Clin Endocrinol (Oxf), 2005, 62(1): 105-113. |
| [7] | BurgerT TS, Vuguin PM, DimarTino-Nardi J, eT al. Assessing insulin resisTance: applicaTion of a fasTing glucose To insulin raTio in growTh hormone-TreaTed children[J]. Horm Res, 2002, 57(1-2): 37-42. |
| [8] | Quigley CA, Gill AM, Crowe BJ, eT al. SafeTy of growTh hormone TreaTmenT in pediaTric paTienTs wiTh idiopaThic shorT sTaTure[J]. J Clin Endocrinol MeTab, 2005, 90(9): 5188-5196. |
| [9] | CuTfield WS, WilTon P, Bennmarker H, eT al. Incidence of diabeTes melliTus and impaired glucose Tolerance in children and adolescenTs receiving growTh-hormone TreaTmenT[J]. LanceT, 2000, 355(9204): 610-613. |
| [10] | Lebrun P, Van Obberghen E. SOCS proTeins causing Trouble in insulin acTion[J]. AcTa Physiol (Oxf), 2008, 192(1): 29-36. |
| [11] | Ho KK. Consensus guidelines for The diagnosis and TreaTmenT of adulTs wiTh GH deficiency II: a sTaTemenT of The GH Research SocieTy in associaTion wiTh The European SocieTy for PediaTric Endocrinology, Lawson Wilkins SocieTy, European SocieTy of Endocrinology, Japan Endocrine SocieTy, and Endocrine SocieTy of AusTralia[J]. Eur J Endocrinol, 2007, 157(6): 695-700. |
| [12] | Louveau I, GondreT F. RegulaTion of developmenT and meTabolism of adipose Tissue by growTh hormone and The insulin-like growTh facTor sysTem[J]. DomesT Anim Endocrinol, 2004, 27(3): 241-255. |
| [13] | 傅春江, 何作云, 王旭开, 等. 重组生长激素对兔冠状动脉粥样硬化的影响[J]. 重庆医学, 2008, 37(6): 572-573. |
| [14] | Hannon TS, Danadian K, Suprasongsin C, eT al. GrowTh hormone TreaTmenT in adolescenT males wiTh idiopaThic shorT sTaTure: changes in body composiTion, proTein, faT, and glucose meTabolism[J]. J Clin Endocrinol MeTab, 2007, 92(8): 3033-3039. |
| [15] | Seminara S, STagi S, Candura L, eT al. Changes of Thyroid funcTion during long-Term hGH Therapy in GHD children. a possible relaTionship wiTh caTch-up growTh?[J]. Horm MeTab Res, 2005, 37(12): 751-756. |
 2014, Vol. 16
2014, Vol. 16