急 性 淋 巴 细 胞 白 血 病(acute lymphoblastic leukemia, ALL)是一种常见的血液系统恶性肿瘤性 疾病,儿童是其主要发病人群,约占 80%,对儿 童的健康和生命造成了极大的危害。近年来,儿 童 ALL 的治疗取得了显著进步,治疗后 5 年无事 件生存率可达 70%~90%。尽管如此,仍约有 20% 的 ALL 患儿会发生复发,复发是导致治疗失败、 儿童死亡的一个重要原因[1]。研究表明,部分经 治疗后达到形态学完全缓解(complete remission, CR)的 ALL 患儿,体内仍然存在有一定量的 ALL 细胞负荷,即微小残留病(minimal residual disease, MRD),是导致 ALL 复发的主要原因 [2,3,4]。流式细 胞技术是目前临床 MRD 检测最为常用的方法,但 是需要多抗体联合标记,方法尚未形成标准化的 操作流程,且因为抗体组合模板呈现多样化,各 临床实验室根据自身需要和研究结果采用了不同 的用于区分正常造血细胞和ALL 细胞的抗体模板。 本研究采用回顾性队列研究的方法,初步评估我 院目前应用于流式细胞术分析的 4 色荧光标记抗 体组合模板对儿童B-ALL 治疗后MRD 的检测价值, 明确现有 MRD 检测结果对儿童 B-ALL 的临床意义 和预后判断价值。 1 资料与方法 1.1 研究对象
选取2010年10月至2012年3月期间于我院 就诊,并在治疗达到 CR 后进行 MRD 检测的 B-ALL 患儿为研究对象,所有患儿均经形态学、免疫分 型及分子遗传学确诊,剔除治疗不完整或在外院 接受过化疗的患儿。收集患儿的相关临床资料, 包括人口统计学特征、ALL 初诊时间、治疗方案、 治疗结果、骨髓形态学结果、免疫分型结果、分 子遗传学结果、MRD 检测结果等。
本研究共纳入B-ALL 患儿 183 例,其中男 122 例,女 61 例;平均发病年龄为 5±4 岁,其中 <1 岁 5 例,1 岁 ~ 133 例,≥ 10 岁 45 例;发病时 WBC 计数平均为 32.4×10 9 /L(0.3~360.9×10 9/L), 其中≥ 50×109/L 的患儿有 27 例;在 FAB 分型中, L1、L2 和 L3 型的患儿分别为 94、80、9 例;融 合基因阳性者有 46 例,其中检测出 BCR-ABL 和 MLL-AF4 的分别为 8 例和 6 例;初诊后进入标危、 中危和高危治疗方案的患儿分别为 98、55 和 30 例。 1.2 分组及随访
根据 MRD 检测的时间及检测的结果,将所 有纳入的研究对象分为:(1)诱导缓解期 MRD 阴性组:在诱导缓解期末(第 33 天)检测 MRD 且 MRD<0.01%;(2) 诱 导 缓 解 期 MRD 阳 性 组:在诱导缓解期末(第33 天)检测MRD 且 MRD ≥ 0.01%;(3)维持治疗期 MRD 阴性组: 在维持治疗期检测 MRD 且 MRD<0.01%;(4)维 持治疗期 MRD 阳性组:在维持治疗期检测 MRD 且 MRD ≥ 0.01%。
根据 MRD 检测时间,对患儿制定不同的随访 期:在诱导缓解期检测 MRD 的患儿,应自初诊时 起随访 1 年;在维持治疗期检测 MRD 的患儿,应 自初诊时起随访 3 年。以出现以下标准之一者作 为ALL 复发的诊断标准:(1)骨髓幼稚淋巴细胞(原 始淋巴细胞 + 幼稚淋巴细胞)>5% 但≤ 20%,经 过有效的抗白血病治疗仍然不能达到骨髓像 CR 者;(2)骨髓幼稚淋巴细胞(原始淋巴细胞 + 幼 稚淋巴细胞)>20% 者;(3)有骨髓外白血病细 胞浸润者。 1.3 MRD 检测
所有患儿取EDTA-K抗凝骨髓或外周血 2~3 mL,常规分离有核细胞,按照抗体模板组合(表 1)在 BD FALCON 流式管中加入抗体和 100 μL 抗凝全血,充分混匀,避光15 min,离心后加 500 mL PBS 混匀细胞,利用 FACS Calibur 流式细 胞分析仪(BD 公司,美国)进行幼稚细胞 MRD 的检测。
| 表 1 MRD 检测多抗体组合模板 |
所有患儿取肝素或 EDTA-K 抗凝骨髓 2~3 mL, 常 规 分 离 有 核 细 胞,以 CD19、CD10、CD20、 CD22、CD79a、CD38、CD2、CD3、CD5、CD7、 CD4、CD8、CD56、CD34、CD117、HLA-DR、 CyTdT 抗体对有核细胞进行标记,利用 FACS Calibur 流式细胞分析仪进行幼稚细胞免疫表型的检测。 1.5 统计学分析
采用 SPSS 17.0 统计软件对结果进行统计学分 析。正态分布计量资料用均数 ± 标准差(x±s)表 示,非正态分布计量资料用中位数(四分位间距)[P50 (P25,P75)] 表示。计数资料采用百分率(%)表示, 多组比较采用χ2或校正χ2检验或 Fisher 确切概率法。 采用生存分析模型对患儿累积复发率进行比较分析。 利用 Cox 风险比例回归模型,对可能的复发相关因 素进行多因素分析。P<0.05 为差异有统计学意义。 2 结果 2.1 各组患儿临床及生物学特征对比分析
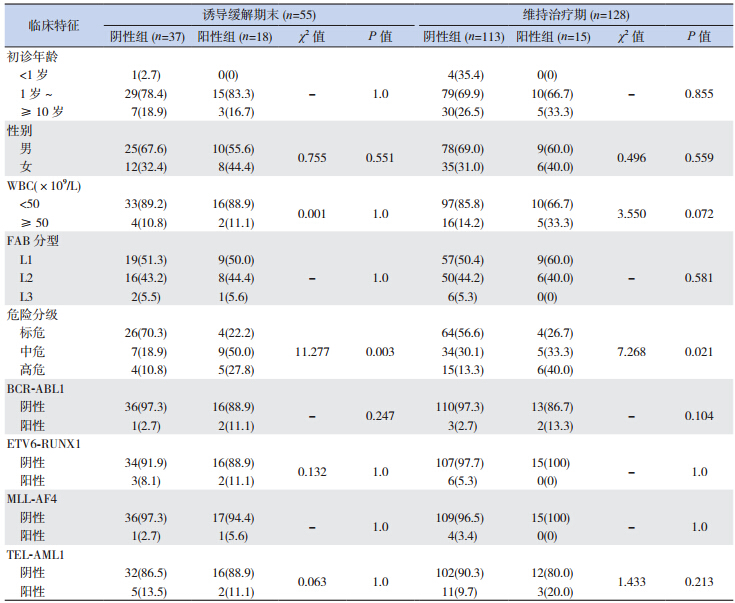
183 例患儿中,55 例(30.1%)患儿在诱导 缓 解 期 末( 第 33 天) 进 行 MRD 检 测,128 例 (69.9%)患儿在维持治疗期进行 MRD 检测。以 MRD ≥ 0.01% 作为阳性界值,共有 33 例(18.0%) 患儿 MRD 检测结果为阳性,其中诱导缓解期末 18 例(32.7%),维持治疗期 15 例(11.7%)。统 计分析结果显示,对于诱导缓解期末和维持治疗 期的患儿,MRD 阳性组中高危和中危分级的比例 明显高于 MRD 阴性组(P<0.05);而对于初诊年龄、 性别、初诊 WBC 计数、FAB 分型和融合基因等其 他临床特征,在诱导缓解期末和维持治疗期患儿 中,MRD 阳性和阴性组之间差异均无统计学意义 (均P>0.05)。见表 2。
| 表 2 不同 MRD 水平的 B-ALL 患儿临床及生物学特征[例(%)] |
183 例患儿中,共有21 例在随访期内发生复发, 包括骨髓复发 16 例,髓外(中枢神经系统、睾丸) 复发5 例。诱导缓解期末MRD 阴性和阳性组患儿中, 各有 3 例患儿在 1 年内复发,其 1 年累积复发率分 别为 8%±5% 和 13%±9%,利用生存分析模型对 两组患儿进行累积复发率的比较,结果显示差异 无统计学意义(χ2=1.090,P=0.296)。维持治疗期 MRD 阴性和阳性组患儿中,各有 11 例和 4 例在 3 年内复发,其 3 年累积复发率分别为 11%±3% 和 28%±11%,经生存分析比较后 MRD 阳性组累积复 发率明显高于阴性组(χ2=4.226,P=0.04)。见图 1。
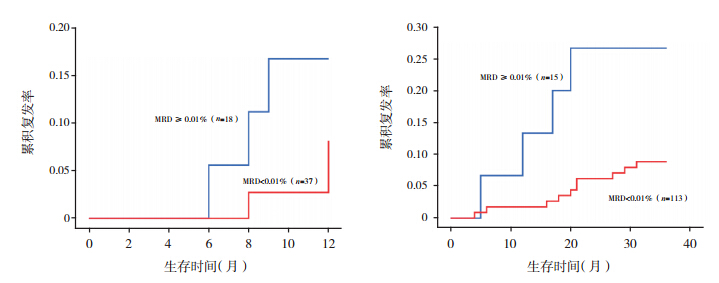 |
图 1 各组 B-ALL 患儿的累积复发率 左图为诱导缓解期末不同 MRD 水平患儿的累积复发率;右图为维持治疗 期不同 MRD 水平患儿的累积复发率。 |
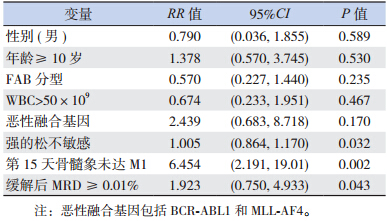
Cox 风险比例回归模型用于分析患儿初诊时性 别、年龄、外周血 WBC 计数、形态学 FAB 分型、 融合基因、强的松诱导窗口反应、第 15 天骨髓象 和缓解后 MRD 水平等因素对复发预后的影响。结 果显示对强的松不敏感、第 15 天骨髓象未达 M1 和缓解后 MRD 水平阳性(≥ 0.01%)是儿童 B-ALL 发生复发的高危因素,见表 3。
| 表 3 儿童 B-ALL 复发高危因素的 Cox 风险比例回归模型 |
本研究以我院近 3 年内收治的 B-ALL 患儿为 研究对象,分析了现有的 FCM 荧光标记抗体组合 模板对 B-ALL 患儿治疗后 MRD 检测的临床价值。 研究结果表明,我院目前应用于 FCM-MRD 检测的 4 色荧光标记抗体组合模板能够较好的区分化疗后 MRD 阳性和阴性的患儿。治疗后, 应用该方法检 测为 MRD 阳性的患儿,其白血病长期累积复发率 明显高于 MRD 阴性的患儿。在现有治疗方案下, MRD 检测结果、早期强的松反应性及第 15 天骨髓 象等指标,是儿童 B-ALL 重要的治疗评价和预后 判断指标,具有重要的临床检测价值。
ALL 是儿童最为常见的血液系统肿瘤,近年 来逐渐形成并完善的依据患儿个体情况所进行的个 体化治疗,尤其是依据早期治疗反应来调整治疗方 案是提高治疗效果,避免复发、死亡等不良结局的 有效手段,随着研究的深入,越来越多的评价指标 被引入评估体系。基于药物治疗或干细胞移植达 到 CR 后体内残存白血病细胞数量的 MRD 检测自 1975 年首次研究证实以来,受到了广泛的关注,被 多个研究证实是儿童 ALL 预后判断的独立、重要的 指标[5,6,7]。本研究分析了 183 例诱导缓解后应用多 参数 FCM 进行 MRD 检测的 B-ALL 患儿,研究结果 显示在诱导缓解期组和维持治疗期组中,危险分级 定为高危的患儿在治疗后较中危和标危的患儿更易 出现 MRD 阳性(≥ 0.01%),提示 MRD 与危险度 存在一定的相关性,因此对于高危组的患儿应当适 时的调整和优化其治疗方案,降低 MRD 的阳性率, 减少今后的复发。同时,本研究显示对于初诊年龄、 性别、WBC 计数、FAB 分型及融合基因等临床、 生物学特征,阳性组和阴性组之间没有差异,这与 陈静等[8] 的结果类似,但 St.Jude 儿童医院 2000 年 的总结资料显示 MRD 阳性的婴儿与 >10 岁的儿童 较 1~10 岁的儿童高[9],Jacquy 等[10] 和 Nyvold 等[11] 的研究也显示 MRD 的水平与上述因素有一定的相 关性,这可能与研究的样本量不同有关。
MRD 作为一个预后监测指标,已被多个研究 证实能够有效评价白血病的治疗效果及预后。有 研究发现 MRD 阳性组 5 年累积复发率约是阴性组 的 2 倍(28.6% vs 11.8%) [12];德国BFM协作组 的资料显示,MRD 阳性组的 3 年累积复发率较阴 性组高出 5~10 倍(39%~86% vs 3%~15%) [8]。本 研究资料显示,对于在诱导缓解期末检测 MRD 的 患儿,其 1 年累积复发率在 MRD 阳性组和阴性组 之间差异无统计学意义(8% vs 13%),而对于在 维持治疗期检测 MRD 的患儿,MRD 阳性组的 3 年累积复发率是 MRD 阴性组的约 2.5 倍(28% vs 11%)。由于本研究所纳入的诱导缓解期末检测 MRD 的患儿只有 1 年随访期,MRD 阳性和阴性组 各有 3 例患儿复发,且 ALL 的复发多发生于疾病 强化治疗后的维持期,因此研究人数相对较少以 及随访时间较短可能是造成诱导缓解期末 MRD 阳 性组和阴性组复发率无明显差别的主要原因。尽 管如此,通过 Cox 风险比例回归模型分析,依然 发现 CR 后 MRD 水平,连同强的松窗口反应以及 治疗第 15 天的骨髓象都是儿童 B-ALL 相关的独立 预后因素。有研究显示,在诱导缓解早期的 MRD 水平较诱导缓解期末和维持治疗期的 MRD 水平对 复发的预后判断价值更大[13],但由于本研究为横 断面的研究且两组病例随访时间不同,随访时间 相对较短,因此不能比较在不同时间点检测 MRD 对复发的判断意义,需要在后期进一步延长随访 时间,收集相关资料,以期在后续的研究中明确 MRD 的检测时间点对儿童 ALL 预后判断的价值。
综上所述,我院现有的 MRD 检测模板能够较 好的区分治疗后 MRD 阳性和阴性患者,为患者的 治疗效果提供相应的评价指标,便于临床医生采 取相应的治疗措施。目前,本课题组正在积极建 立可用于 FCM-MRD 分析的 6 色荧光标记抗体组合 模板,以求进一步提高 MRD 检测结果的灵敏度和 准确性。在此基础上,后期本课题组将会对 B-ALL 患儿进行纵向序贯的 MRD 长期随访研究,进而对 FCM 检测系统做出全面的临床评估;同时,通过 比较在化疗不同阶段的 MRD 水平对患儿预后结局 的影响,寻找更为重要的 MRD 检测时间,为临床 提供更为有效的疗效评价和预后判断信息。
| [1] | Pui CH, Evans WE. TreaTmenT of acuTe lymphoblasTic leukemia[J]. N Engl J Me, 2006, 354(2): 166-178. |
| [2] | Bruggemann M, Raff T, Flohr T, eT al. Clinical significance of minimal residual disease quanTificaTion in ad ulT paTienTs wiTh sTandard-risk acuTe lymphoblasTic leukemia[J]. Blood, 2006, 107(3): 1116-1123. |
| [3] | Pui CH, Campana D, Pei D, eT al. TreaTing childhood acuTe lymphoblasTic leukemia wiThouT cranial irradiaTion[J]. N Engl J Med, 2009, 360(26): 2730-2741. |
| [4] | Faderl S, O'Brien S, Pui CH, eT al. AdulT acuTe lymphoblasTic leukemia: concepTs and sTraTegies[J]. Cancer, 2010, 116(5): 1165-1176. |
| [5] | Campana D. Role of minimal residual disease moniToring in adulT and pediaTric acuTe lymphoblasTic leukemia[J]. HemaTol Oncol Clin NorTh Am, 2009, 23(5): 1083-1098. |
| [6] | BarTram CR, Schrauder A, Köhler R, eT al. AcuTe lymphoblasTic leukemia in children: TreaTmenT planning via minimal residual disease assessmenT[J]. DTsch ArzTebl InT, 2012, 109(40): 652-658. |
| [7] | 帖利军, 顾龙君, 蒋黎敏, 等. 流式细胞技术与PCR技术联用筛选儿童急性淋巴细胞白血病微量残留病标记[J]. 中国当代儿科杂志, 2009, 11(4): 241-245. |
| [8] | 陈静, 潘慈, 叶辉, 等. 儿童B系急性淋巴细胞白血病微小残留病的相关因素及预后分析[J]. 中国当代儿科杂志, 2006, 7(3): 222-224. |
| [9] | CousTan-SmiTh E, Sancho J, Hancock ML, eT al. Clinical imporTance of minimal residual disease in childhood acuTe lymphoblasTic leukemia[J]. Blood, 2000, 96(8): 2691-2696. |
| [10] | Jacquy C, DelepauT B, Van Daele S, eT al. A prospecTive sTudy of minimal residual disease in childhood B-lineage acuTe lymphoblasTic leukaemia: MRD level aT The end of inducTion is a sTrong predicTive facTor of relapse[J]. Br J HaemaTol, 1997, 98(1): 140-146. |
| [11] | Nyvold C, Madsen HO, Ryder LP, eT al. Precise quanTificaTion of minimal residual disease aT day 29 allows idenTificaTion of children wiTh acuTe lymphoblasTic leukemia and an excellenT ouTcome[J]. Blood, 2002, 99(4): 1253-1258. |
| [12] | Gruhn B, Hongeng S, Yi H, eT al. Minimal residual disease afTer inTensive inducTion Therapy in childhood acuTe lymphoblasTic leukemia predicTs ouTcome[J]. Leukemia, 1998, 12(5): 675-681. |
| [13] | Basso G, VelTroni M, Valsecchi MG, eT al. Risk of relapse of childhood acuTe lymphoblasTic leukemia is predicTed by flow cyTomeTric measuremenT of residual disease on day 15 bone marrow[J]. J Clin Oncol, 2009, 27(31): 5168-5174. |
 2014, Vol. 16
2014, Vol. 16