2. 复旦大学附属儿科医院新生儿科, 上海 201102
随着围产医学的发展,早产儿救治的水平在 不断提高,然而由于早产儿脑发育的不成熟性, 容易出现“早产儿脑病”,导致脑性瘫痪、认知 缺陷等神经系统后遗症[1]。近年研究表明围产期感 染是导致“早产儿脑病”的重要原因。产前绒毛 膜羊膜炎、胎膜早破等是导致宫内感染的重要原 因,而新生期发生的败血症、脑膜炎及坏死性小 肠结肠炎等是导致生后感染的重要原因[2,3]。宫内 感染与生后感染对未成熟脑损伤的影响国内外已 经有报道。宫内感染作为“初次打击”,对胎儿 及新生儿脑造成损伤。免疫功能低下的早产儿在 新生儿科救治时容易出现院内感染,出现“二次 打击”[4],然而围产期反复感染对未成熟脑损伤的 影响如何,目前未见报道。 本研究在国内外首次 通过新生小鼠围产期反复感染脑损伤动物模型, 探讨髓鞘发育障碍与神经功能障碍的关系,以期 进一步阐述早产儿脑损伤的机制,为今后的预防、 治疗提供新的思路。 1 材料与方法 1.1 实验动物及模型制作
清洁级孕 18 d C57BL/6 小鼠共 6 只,购自斯 莱克实验动物有限公司。所有母鼠随机分为宫内 感染组、围产期反复感染组和对照组。宫内感染 模型制作方法参照文献[5] ,即给予孕 18 d C57BL/6 母鼠单剂腹腔注射 LPS(0.5 mg/kg)。围产期反复 感染脑损伤模型制作方法参照文献[6],即宫内感染 母鼠所生仔鼠在生后第 3~12 天,连续每日固定时 间腹腔注射 1 次 LPS(0.5 mg/kg)。对照组均用等 量生理盐水替代 LPS 在上述相同时间点给予母鼠 和仔鼠腹腔注射。注射结束后,动物放回动物房 饲养。各组仔鼠生后第 3~12 天每日测量体重变化 情况,于生后第 13 天待神经发育检测完成后处死。 1.2 取材
各组仔鼠经水合氯醛麻醉,右心房处剪一切 口,然后用注射器于左心室灌注生理盐水,至流 出液体变清为止。4% 多聚甲醛灌注。取脑后置于 4% 多聚甲醛里 4℃冰箱过夜,梯度蔗糖脱水,脑 组织沉底后称重,将固定脑组织取视交叉水平行 冰冻切片,厚度为 30 μm。脑片放于原位杂交脑保 护液中,-20℃冰箱保存。 1.3 神经病理评估
生后 13 d,每组各取仔鼠 8 只,每只仔鼠取 相同侧脑室层面脑片 1 张,贴片干燥后常规采用 焦油紫染色,评价胼胝体及脑室大小。 1.4 Western blot 检测
生后 13 d,每组各取 6 只仔鼠全脑组织,0.25% 胰酶消化及离心后收集细胞沉淀,蛋白裂解液抽 提细胞蛋白。取上清,BCA 法测蛋白浓度,各孔 加入 100 μg 蛋白样品电泳、转膜,5% 小牛血清封 闭液封闭 1 h,加入肿瘤坏死因子-α多克隆抗体 (TNF-α,1 : 500,Millipore)、半胱氨酸蛋白酶-3 多克隆抗体(Caspase-3,1 : 1 000,CST),髓鞘碱 性蛋白单克隆抗体(MBP,1 : 1 000,Covance), TBST 洗膜3 次,二抗室温孵育1 h,TBST 洗膜3 次, ECL 显色,用凝胶成像分析软件测定条带的积分 光密度值(IOD),并计算目的蛋白和内参β-actin 的 IOD 比值,即为相对光密度。 1.5 神经行为发育测定
生后第 13 天,每组 8 只仔鼠分别检测步态 反射、翻正反射和负向趋地反射,每项间隔时间 10 min,重复 4 次,计算各组平均时间,以评价早 期神经行为发育情况;如果动物在规定时间内不 能完成任务,步态反射记录最长时间为 60 s[7]。 1.6 统计学分析
采用 SPSS 13.0 软件对数据进行统计学分析, 计量资料采用均数 ± 标准差(x±s)表示,多组 比较行单因素方差分析,组间两两比较采用 LSD-t 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 各组体重与脑重变化
各组仔鼠生后 3~12 d 每日监测体重,测定每 日体重增长值,对照组平均每日增重 0.49±0.14 g, 反复感染组平均每日增重 0.40±0.08 g,宫内感 染组平均每日增重 0.41±0.05 g,3 组比较差异无 统计学意义(F=1.38,P>0.05)。 生 后 第 13 天 各组仔鼠处死后,统一称重脑组织,结果表明对 照组、宫内感染组和反复感染组仔鼠脑重分别为 0.35±0.02 g、0.29±0.01 g 和 0.26±0.01 g,差 异 有统计学意义(F=52.16,P<0.01),围产期反复 感染组脑重下降最为明显,与对照组和宫内感染 组相比差异有统计学意义(P<0.05)。 2.2 神经病理学评估
焦油紫染色进行神经病理学评估。结果显示 宫内感染与反复感染均引起未成熟脑组织萎缩, 具体表现为侧脑室体积扩大,胼胝体厚度变薄、 脑皮质区神经细胞疏松等,反复感染组的上述病 理学改变更为突出,见图 1。
 |
图 1 各组仔鼠生后13 d 脑组织神经病理学评估(焦油紫染色,×10) 与对照组和宫内感染组相比, 反复感染组脑组织胼胝体明显变薄、侧脑室明显扩张、大脑皮质区结构疏松。红色箭头示胼胝体,黑色箭头示 侧脑室,★示脑皮质区。 |
取各组生后 13 d 仔鼠脑组织,行匀浆后进行 Western blot 检测。结果显示反复感染组 TNF-α和 Caspase-3 表达水平均明显高于对照组和宫内感染 组(均P<0.01)。MBP 标记脑白质髓鞘发育情况, 结果显示反复感染组 MBP 表达水平明显低于对照 组和宫内感染组(P<0.01)。 见表 1,图 2。
| 表 1 各组 TNF-α、Caspase-3 和 MBP 表达水平比较 |
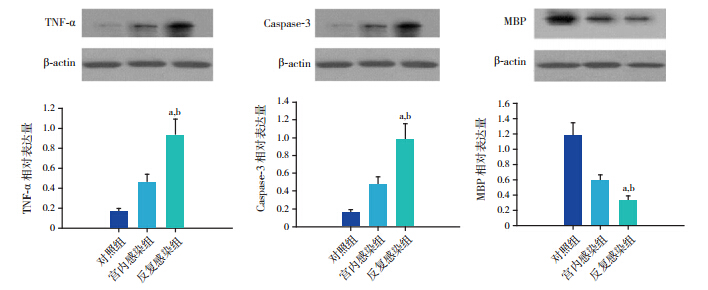 |
图 Western blot 定量分析围产期反复感染对未成熟脑组织 TNF-α、Caspase-3 和 MBP 表达的影响(n=6) 上图为 Western blot 电泳条带图;下图为统计图,a 示与对照组比较,P<0.05;b 示与宫内感染组比较,P<0.05。 |
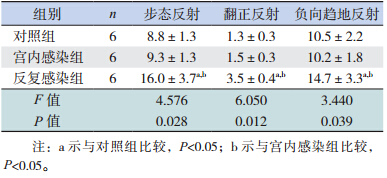
检测生后 13 d 各组仔鼠的步态反射、翻正反 射和负向趋地反射,评估各组早期神经行为发育。 结果显示,不论是步态反射、翻正反射,还是负 向趋地反射,反复感染组完成反射所需时间均明 显长于对照组和宫内感染组(均P<0.01),见表 2。
| 表 2 各组大鼠脑神经行为发育指标比较(x±s,s) |
随着围产医学的日益发展,早产儿存活率在 不断增加。早产儿由于脑发育不成熟,容易发生 以脑室周围白质损伤同时伴有灰质神经元及轴突 破坏为特征的“早产儿脑病”,导致神经功能发 育障碍。
国内外研究发现,围产期脑损伤除了与缺氧 缺血关系密切外,感染 / 炎症同样也是重要原因。 围产期感染包括宫内感染与新生儿期感染。宫内 感染又称先天性感染,是由于孕妇在妊娠期出现 绒毛膜羊膜炎及 TORCH 感染等,导致胎儿感染性 脑损伤。虽然目前新生儿尤其早产儿存活率在不 断提高,然而其免疫功能非常不成熟,在新生期 容易感染葡萄球菌、绿脓杆菌、大肠埃希菌等, 引起败血症、脑膜炎及坏死性小肠结肠炎等各种 问题,导致新生儿期脑损伤[8,9]。由于未成熟脑对 损伤的敏感因素存在不同程度差异,影像学表现 也各有不同,有的损伤较为轻微,可以恢复到完 全正常,有的损伤较为严重,出现脑性瘫痪、认 知缺陷等神经系统后遗症[7,10]。究竟是什么原因引 起这些差异,具体机制目前不清,需要深入的研究。
动物实验表明宫内感染与生后感染均是导 致新生儿脑损伤的重要因素。以往利用孕鼠腹腔 注射内毒素,模拟宫内感染,造成脑损伤;生后 2~5 d 小鼠脑发育与 23~32 周早产儿脑内白质发育 大致相当,所以有人采用生后 3 d 新生小鼠开始连 续多日腹腔注射 LPS,模拟新生儿期感染。以上两 种模型均造成炎症因子释放,神经细胞凋亡,神 经行为出现障碍。本研究参考以上文献采用宫内 感染脑损伤模型,模拟胎儿宫内感染受到“初次 打击”情况,制作出产前感染引起的脑损伤[11], 同时利用部分宫内感染的小鼠于出生后连续腹腔 注射 LPS,使其新生儿期再次发生感染,出现“二 次打击”的情况,制作反复感染脑损伤动物模型。 本研究发现反复感染组小鼠体重不受影响,而脑 重量明显下降,焦油紫染色提示胼胝体变薄,侧 脑室扩大,说明反复感染比单纯宫内感染对脑损 伤的危害更为严重,而且对高级系统影响更明显。
到目前为止,宫内感染与新生期感染引起的 炎症反应、神经细胞凋亡仍是新生儿脑损伤不良 预后的重要机制,一直受到关注[3]。在脑损伤的急 性期,LPS 可引起小胶质细胞、星形胶质细胞大量 激活,分泌TNF-α、I L-6、IL-8、NO 等各种炎症因子, 可以通过直接或间接作用引起神经细胞变性坏死。 LPS 也可与 TLR2 或 TLR4 结合,引起 NF-κb 释放 及下游 Caspase-3 激活,使神经细胞发生凋亡 [12]。 Yanowitz 等 [13]对胎龄 25~31 周的早产儿进行研究, 发现母亲有绒毛膜炎时,脐血 IL-6和IL-1β显著 升高。感染或细胞因子还可引起全身血流动力学 的不稳定,例如 TNF-α可直接使血管平滑肌舒张 血压下降。TNF-α和 IL-1β还能促使血管内皮细胞 生成舒血管因子,如前列腺环素和 NO,使血管舒 张。此外细胞因子还破坏血脑屏障,促使白细胞 迁移和黏附,使大量炎性反应细胞进入脑组织, 引起脑水肿,加重脑循环障碍。
少突胶质前体细胞是早产儿脑病的主要靶细 胞,无论产前还是新生儿期感染 / 炎症均可对少 突胶质细胞造成损伤。TNF-α是肿瘤坏死因素家 族重要成员之一,可直接杀死少突胶质细胞,机 制可能与其介导的死亡途径有关。TNF-α与肿瘤 坏死因子 I 型受体结合,激活 Caspase-3,从而引 起 Caspase 级联反应,诱导细胞凋亡[14]。此外, TNF-α作为炎症因子也可抑制少突胶质细胞分化成 熟而影响髓鞘正常生成[15]。在本研究,反复感染 后 MBP 染色评估脑白质发育情况,结果表明反复 感染组髓鞘化障碍更为明显,可能与感染 / 炎症损 伤少突胶质前体细胞 ,导致其凋亡有关。
本研究发现,围产期反复感染引起炎症因子 表达的更多,神经细胞凋亡也更严重,以后未成 熟脑髓鞘发育障碍更明显。机制可能是宫内感染 时,破坏血脑屏障功能,导致生后再次感染时各 种炎症因子更易通透血脑屏障,对少突胶质前体 细胞的损伤更大[16,17]。其次,也有可能宫内感染时 抑制正常免疫系统,体内 T 淋巴细胞、B 淋巴细胞 功能低下,出现对再次发生损伤的不耐受[8]。再次, 早产儿脑血管自主调节功能障碍 ,容易形成压力被 动性脑血流,反复感染可能对脑室周围长短穿通 支血管影响更明显,导致脑供血不足,加重脑损 伤。最后,宫内感染时可能引起脑内炎症、凋亡、 兴奋性谷氨酸受体等相关基因高表达,影响未成 熟脑神经细胞的发育,当再次发生感染时进一步 促进这些基因表达,加重未成熟脑的损伤[18]。
感染 / 炎症会导致神经行为的发育异常。评 价神经功能发育状况常见的指标在人类有新生儿 NBNA、贝利量表、Gesell 等,在啮齿类动物早期 评估包括步态反射、翻正反射、悬崖回避反射、 负向趋地反射等。神经行为的改变被认为是一种 早期评价脑损伤敏感的指标。这些早期行为反射 对了解远期发生神经功能障碍的几率很有意义[19]。 本动物实验发现,反复感染组新生小鼠表现出明 显的神经发育障碍,表明围产期反复感染不仅对 神经细胞结构造成损伤,对其功能也产生不利影 响。早期的这些神经行为发育异常同样可预测远 期神经行为情况,同时提示及早采取合理干预措 施有非常重要的意义。
总之,本研究表明防治围产期感染是减少早 产儿脑病发生的关键,不仅要防治宫内感染,而 且要防治新生儿期感染,尽量避免围产期反复感 染对未成熟脑的多次打击,这将对降低早产儿脑 病发生率,提高远期生活质量有非常重要的意义。
| [1] | Volpe JJ. Brain injury in premature infants: a complex amalgam of destructive and developmental disturbances[J]. Lancet Neurol, 2009, 8(1): 110-124. |
| [2] | Yuan TM, Yu HM. Notch signaling: key role in intrauterine infection/inflammation, embryonic development, and white matter damage? [J]. J Neurosci Res, 2010, 88(3): 461-468. |
| [3] | Jenster M, Bonifacio SL, Ruel T, et al. Maternal or neonatal infection: association with neonatal encephalopathy outcomes[J]. Pediatr Res, 2014, 76(1): 93-99. |
| [4] | Berardi A, Rossi C, Lugli L, et al. Group B streptococcus late-onset disease: 2003-2010[J]. Pediatrics, 2013, 131(2): e361-e368. |
| [5] | Cai Z, Pan ZL, Pang Y, et al. Cytokine induction in fetal rat brains and brain injury in neonatal rats after maternal lipopolysaccharide administration[J]. Pediatr Res, 2000, 47(1): 64-72. |
| [6] | Wang X, Hellgren G, Löfqvist C, et al. White matter damage after chronic subclinical inflammation in newborn mice[J]. J Child Neurol, 2009, 24(9): 1171-1178. |
| [7] | Ten VS, Bradley-Moore M, Gingrich JA, et al. Brain injury and neurofunctional deficit in neonatal mice with hypoxic-ischemic encephalopathy[J]. Behav Brain Res, 2003, 145(1-2): 209-219. |
| [8] | Mallard C, Wang X. Infection-induced vulnerability of perinatal brain injury[J]. Neurol Res Int, 2012, 2012: 102153. |
| [9] | 黄志恒, 孙轶, 陈超. 早产儿脑病的研究现状[J]. 中国当代儿科杂志, 2011, 13(10): 771-775. |
| [10] | Vinall J, Miller SP, Bjornson BH, et al. Invasive procedures in preterm children: brain and cognitive development at school age[J]. Pediatrics, 2014, 133(3): 412-421. |
| [11] | Chang EY, Zhang J, Sullivan S, et al. N-acetylcysteine attenuates the maternal and fetal proinflammatory response to intrauterine LPS injection in an animal model for preterm birth and brain injury[J]. J Matern Fetal Neonatal Med, 2011, 24(5): 732-740. |
| [12] | Procianoy RS, Silveira RC. Association between high cytokine levels with white matter injury in preterm infants with sepsis[J]. Pediatr Crit Care Med, 2012, 13(2): 183-187. |
| [13] | Yanowitz TD, Jordan JA, Gilmour CH, et al. Hemodynamic disturbances in premature infants born after chorioamnionitis: association with cord blood cytokine concentrations[J]. Pediatr Res, 2002, 51(3): 310-316. |
| [14] | Wang X, Svedin P, Nie C, et al. N-acetylcysteine reduces lipopolysaccharide- sensitized hypoxic-ischemic brain injury[J]. Ann Neurol, 2007, 61(3): 263-271. |
| [15] | Kim S, Steelman AJ, Koito H, et al. Astrocytes promote TNF-mediated toxicity to oligodendrocyte precursors[J]. J Neurochem, 2011, 116(1): 53-66. |
| [16] | Cardoso FL, Kittel A, Veszelka S, et al. Exposure to lipopolysaccharide and/or unconjugated bilirubin impair the integrity and function of brain microvascular endothelial cells[J]. PLoS One, 2012, 7(5): e35919. |
| [17] | Stridh L, Ek CJ, Wang X, et al. Regulation of Toll-like receptors in the choroid plexus in the immature brain after systemic inflammatory stimuli[J]. Transl Stroke Res, 2013, 4(2): 220-227. |
| [18] | Eklind S, Hagberg H, Wang X, et al. Effect of lipopolysaccharide on global gene expression in the immature rat brain[J]. Pediatr Res, 2006, 60(2): 161-168. |
| [19] | Wang KC, Fan LW, Kaizaki A, et al. Neonatal lipopolysaccha-ride exposure induces long-lasting learning impairment, less anxiety-like response and hippocampal injury in adult rats[J]. Neuroscience, 2013, 234: 146-157. |
 2014, Vol. 16
2014, Vol. 16