支气管哮喘(简称哮喘)是以嗜酸性粒细胞、 淋巴细胞、肥大细胞和中性粒细胞等多种细胞及 细胞组分参与的一种气道慢性炎症性疾病。气道 慢性炎症是哮喘的本质特点,是导致气道高反应 和肺功能持续性下降的重要原因。明确气道慢性 炎症机制是预防和控制气道慢性炎症的必要条件, 也是干预和治疗哮喘的有效途径。
骨桥蛋白(osteopontin, OPN)是细胞外基质 中一种重要的多功能磷酸化糖蛋白,表达于 T 细 胞、树突状细胞(dendritic cell, DC)、单核细胞、 嗜酸性粒细胞和肥大细胞等多种免疫细胞内。研 究表明,OPN 作为一种新型细胞因子参与免疫炎 症反应[1],包括介导多种细胞分泌促炎性因子 [2,3,4,5], 维持气道慢性炎症[6,7,8,9]等。近年来,对于 OPN 是 否参与哮喘发病机制,以及 OPN 在哮喘发病中的 具体作用,越来越引起国内外学者的关注。已有 研究表明 OPN 参与哮喘气道重塑[10,11,12] 。然而 OPN 是否也参与哮喘气道炎症呢,国内外的研究相对 较少。此外,糖皮质激素作为治疗哮喘的一线用药, 明确其对 OPN 表达的影响,也具有重要的意义。
本研究通过建立不同程度哮喘及糖皮质激 素干预治疗的小鼠模型,并对各组小鼠肺组织中 OPN 表达进行检测,来明确 OPN 是否参与哮喘发 病、是否与气道炎症程度相关、是否受糖皮质激 素的影响,进而初步探讨 OPN 在哮喘发病中的具 体作用,为阐明哮喘的发病机制开辟新的方向。 1 材料与方法 1.1 材料
卵清蛋白(OVA)和氢氧化铝购于SigmaAldrich 公司;兔源 OPN 一抗购于 Bioss 公司;免 疫组化试剂盒购于北京中杉金桥生物技术公司; SDS-PAGE 凝胶配制试剂盒购于碧云天生物技术研 究所;ECL 显色试剂盒及 BCA 蛋白定量试剂盒为 Pierce 公司产品;TRIzol 试剂液及 OPN 引物购于 Invitrogen 公司;SYBR Premix Ex Taq 及 PrimeScript RT 试剂盒购于 TaKaRa 公司;β-actin 引物为凯基 生物产品;小鼠血清 OVA-sIgE ELISA 试剂盒购于 沈阳宝信生物公司。 1.2 小鼠分组及模型建立
4~6 周龄 SPF 级雌性 BALB/c 小鼠 50 只,体 重 16~20 g,由中国医科大学附属盛京医院中心实 验室提供并饲养。按随机数字表法分为正常对照 组、不同程度哮喘组(OVA 激发 1 周组、OVA 激 发 2 周组)及相应的地塞米松(DXM)治疗组(DXM 治疗 1 周组、DXM 治疗 2 周组),每组 10 只。 模型制备参考文献[13,14]:哮喘组及 DXM 治疗组小 鼠分别于第 0、7 和 14 天腹腔内注射含 10 μg OVA 和 1 mg 氢氧化铝的混悬液共 0.4 mL 致敏,第 21 天开始雾化吸入 2%OVA 诱导激发哮喘 1 周或 2 周, 1 次 /d,30 min/ 次。DXM 治疗组则在每次激发前 1 h,腹腔内注射 DXM 3 mg/kg。正常对照组致敏 和激发均用等体积的缓冲液(PBS)替代 OVA。 1.3 标本制备
每只小鼠于取材前腹腔注射 10% 水合氯醛 0.1 mL 麻醉,最后一次激发后 24 h 内断颈处死小 鼠,行左心取血,低温离心后取上清,用于 ELISA 分析。取新鲜双肺组织,将左肺以 10 倍体积的 4% 多聚甲醛溶液固定,常规方法石蜡包埋、切片。 采用连续切片,厚度 4 μm,每 3 张切片中取 1 张, 行苏木精 - 伊红(HE)染色及免疫组织化学检 测。按肺叶结构解剖右肺,分装后液氮冻存用于 Western blot 法及 Real-time PCR 法分析。 1.4 肺组织 HE 染色
随机选取每只小鼠肺组织 3 张切片,常规二 甲苯脱蜡及酒精复水,然后苏木素染色、冲洗、 伊红染色,最后梯度酒精脱水、二甲苯透明及中 性树胶封片,显微镜下每张切片随机选取 5 个以 上的高倍镜视野,观察支气管壁的形态学变化。 1.5 ELISA 法检测血清 OVA-sIgE 的表达
根据 ELISA 试剂盒说明书步骤,设标准孔、 待测样品孔、空白孔,分别加样,37℃温育 1 h, 洗板 5 次,加入 A、B 显色液,37 ℃温育 30 min, 然后加入终止液终止,利用酶标仪按照 450 nm 波长测量各孔的光密度,根据标准曲线计算样品 OVA-sIgE 的浓度。 1.6 免疫组化法定位检测 OPN 表达
免疫组化步骤按说明书进行。随机选取每 只小鼠肺组织 3 张切片,行常规脱蜡水化,3% H2O2阻断 30 min,进行抗原修复,山羊血清封闭 30 min,滴加兔源 OPN 一抗 4℃过夜,生物素标记 山羊抗兔 IgG 37℃温箱孵育 40 min,辣根酶标记 链酶卵白素 37℃温箱孵育 15 min,DAB 显色,然 后复染、脱水、透明、封片,光镜下观察。空白 对照组用 PBS 代替一抗,步骤同前。每张切片随 机选取 5 个以上的高倍镜视野,应用 NIS-Elements Br 3.0 图像分析软件计算出平均灰度值(Mean Density)作为该片蛋白半定量结果。 1.7 Western blot 检测肺组织中 OPN 的表达
分别取每只小鼠 1 份右肺叶标本,肺叶组织 称重后按每 100 mg 标本加入 0.5 mL PIPA 裂解液, 冰上剪碎组织,超声匀浆 30 s,4℃ 14 000 r/min 离 心 15 min,取上清分装 -80℃保存。上样后以 10% SDS-PAGE 凝胶电泳,分离蛋白质并转到 PVDF 膜 上。5% 脱脂奶粉封闭 2 h,4℃一抗孵育过夜,二 抗室温孵育 2 h,ECL 发光,凝胶成像仪成像。结 果用 ImageJ 软件分析测定条带的积分光密度值, 结果以 OPN 与内参 GAPDH 的比值表示。 1.8 Real-time PCR 检测肺组织中 OPN mRNA
的表达 分别取每只小鼠肺组织称重剪碎,加入适量 TRIzol 提取总 RNA。参照反转录及扩增试剂盒说 明书,将总 RNA 反转录为 cDNA,取 cDNA 2 μL、 SYBR 预混液 16 μL、上下游引物 2 μL 共计 20 μL 总反应体系行实时定量PCR。小鼠OPN引物 (336 bp)上游序列:5'-TGTGTCCTCTGAAGAAAAGGATGAC-3';下游序列:5'-TCTGTGGCATCAGGATACTGTTCA-3'。小鼠内参β-actin 引物(136 bp)上 游序列:5'-CATCCGTAAAGACCTCTATGCCAAC-3 '; 下 游 序 列:5'-ATGGAGCCACCGATCCACA-3'。 扩 增反应条件均为 95℃变性 30 s,59℃退火 1 min, 72℃延伸30 s,共40 个循环。荧光定量PCR 仪 (ABI7500 型号)自动分析并计算出每个样本的 CT 值,OPN mRNA 的相对表达量以 2 -ΔΔCT形式得出。 1.9 统计学分析
所有数据采用 SPSS 19.0 统计软件分析,计量 数据以均值 ± 标准差(x±s)表示,多组间比较 采用单因素方差分析。P<0.05 为差异有统计学意 义。 2 结果 2.1 各组小鼠症状比较
哮喘组雾化激发后出现烦躁不安、呼吸急促、 抓耳抓鼻、腹肌抽搐和大小便失禁等表现,多次 激发后出现毛发杂乱、光泽度差、体重增长缓慢; DXM 组上述症状较轻;对照组无上述症状。 2.2 各组小鼠肺组织病理改变
HE 染色可见对照组小鼠支气管管壁完整光 滑,上皮细胞排列整齐,管腔光滑无狭窄,支气 管及周围血管组织无明显炎性细胞浸润。哮喘组 小鼠支气管管壁完整性受损,上皮细胞排列紊乱、 脱落,管腔明显缩窄;支气管及周围血管组织可 见大量的炎性细胞浸润;且 OVA 激发 2 周组上述 病理学改变较 OVA 激发 1 周组重。DXM 组小鼠上 述表现较哮喘组轻,见图 1。
 |
图 1 各组小鼠肺组织病理形态学变化(苏木素 - 伊红染色,×200) 对照组气道管壁完整,上皮细胞排列整齐, 管腔无狭窄,无明显炎性细胞浸润。哮喘组小鼠气道管壁完整性受损,上皮细胞排列紊乱,管腔明显缩窄;大量炎性细胞浸润; 且 OVA 激发 2 周时上述病理学改变较 1 周时重。DXM 组气道管壁较哮喘组相对完整,上皮细胞脱落减少,炎性细胞浸润减少。 |
ELISA结果显示,哮喘组小鼠血清OVAsIgE 明显高于对照组(P<0.001),且 OVA 激发 2 周组血清 OVA-sIgE 水平较激发 1 周组明显升高 (P<0.001);DXM 治疗组血清 OVA-sIgE 水平低 于哮喘组但仍高于对照组(P<0.001),且 DXM 治疗 2 周组与治疗 1 周组比较差异无统计学意义 (P=0.549),见图 2。
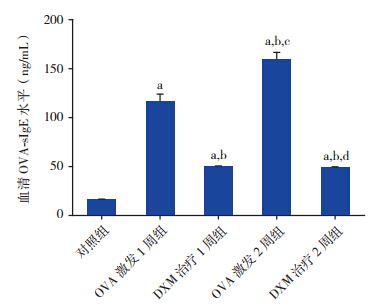 |
图 2 ELISA 法检测各组小鼠血清 OVA-sIgE 表达水 平(n=10) a:与对照组比较,P<0.001;b:与 OVA 激发 1 周组比较,P<0.001;c:与 DXM 治疗 1 周组比较,P<0.001;d: 与 OVA 激发 2 周组比较,P<0.001。 |
位表达 免疫组化法结果显示,OPN 在肺组织中的表 达主要定位于支气管上皮及气道和血管周围浸润 的炎症细胞;经图像分析,OVA激发1 周(44.8±3.5) 及 2 周组(66.3±4.9)肺组织 OPN 表达高于对照 组(11.5±2.8)(P<0.001),且 OVA 激发 2 周组 OPN 水平高于激发 1 周组(P<0.001);DXM 治疗 1 周(29.2±3.7)及 2 周组(28.5±3.3)OPN 表达 均分别低于同时间点 OVA 组(P<0.001),见图 3。
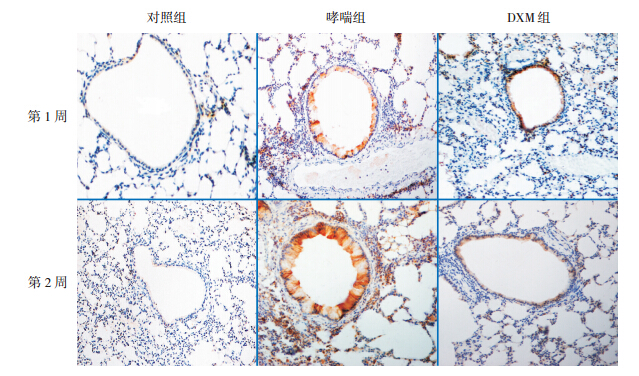 |
图 3各组小鼠肺组织 OPN 表达(DAB 染色,×200) 棕褐色为 OPN 阳性表达,哮喘组 OPN 表达明显高于对照组, 且 OVA 激发 2 周时 OPN 表达高于 1 周时,DXM 组 OPN 表达在各时间点均低于哮喘组。 |
Western blot 结果显示,哮喘组小鼠肺组织 OPN 表达明显高于对照组(P<0.001),且激发 2 周组 OPN 水平较激发 1 周组明显升高(P<0.001); DXM 治疗组 OPN 水平低于哮喘组却高于对照组 (P<0.001),且治疗 2 周组与治疗 1 周组比较差 异无统计学意义(P=0.925),见图 4。
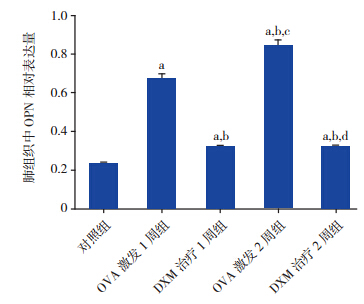 |
图 4Western blot 法检测各组小鼠肺组织 OPN 表 达水平(n=10) a:与对照组比较,P<0.001;b:与 OVA 激 发 1 周组比较,P<0.001;c:与 DXM 治疗 1 周组比较,P<0.001; d:与 OVA 激发 2 周组比较,P<0.001。 |
的相对表达量 Real-time PCR 结果显示,哮喘组小鼠肺组织 OPN mRNA相对表达量明显高于对照组(P<0.001), 且激发2 周组OPN mRNA 水平较激发1 周组明 显升高(P<0.001);DXM 治疗组 OPN mRNA 水 平低于哮喘组却高于对照组(P<0.001),且治 疗2 周组与治疗1 周组比较差异无统计学意义 (P=0.928),见图 5。
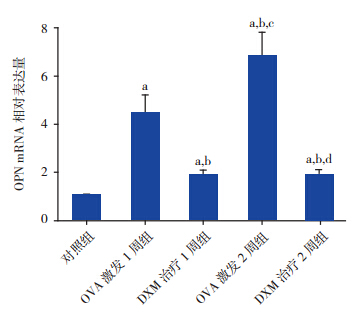 |
图 5 Real-time PCR 法检测各组小鼠肺组织 OPN mRNA 表 达 水 平(n=10) a: 与 对 照 组 比 较,P<0.001; b:与 OVA 激发 1 周组比较,P<0.001;c:与 DXM 治疗 1 周组比较, P<0.001;d:与 OVA 激发 2 周组比较,P<0.001。 |
OPN 是细胞外基质中一种重要的多功能磷酸 化糖蛋白,最早从骨基质中分离,因其能介导骨组 织细胞与骨基质的连接、参与骨基质矿化和重吸 收过程而得名。OPN 基因位于人染色体 4q13 上(位 于鼠 5 号染色体上),分子量为 44~75 KDa,具有 良好的可溶性。在活化的 T 细胞、DC、单核细胞、 嗜酸性粒细胞和肥大细胞等多种免疫细胞中均有 其诱导性表达[1] 。已有研究证实,OPN 与多种 Th1 细胞免疫相关疾病的发病机制有关,如结节病[15]、 结核病[16]、类风湿关节炎[17]、Crohn's 病[18] 和多发 性硬化[19] 等。那么,在支气管哮喘等 Th2 细胞免 疫疾病发病机制中,OPN 是否也发挥重要的作用 呢?众所周知,支气管哮喘是由多种细胞(如嗜 酸性细胞、肥大细胞、T 淋巴细胞、中性粒细胞和 气道上皮细胞等),以及细胞组分参与的气道慢 性炎症性疾病。近年来,相关临床和动物实验均 表明,OPN 在支气管上皮细胞、T 细胞、DC、嗜 酸性粒细胞中均有诱导性表达[20,21] ,可通过黏附 T 细胞、DC 和巨噬细胞来影响不同细胞因子的分泌。 此外,相比正常鼠,OPN 基因敲除(OPN-/-)分泌 高水平 IL-13 而低水平 IFN-γ[7,22,23]。又有研究表 明 OPN 还能够下调 IL-4 的水平 [8,24]。Xanthou 等[9] 发现 OPN 可以介导不同类型的 DC 细胞,在气道 炎症反应中发挥着双重作用。另外,Takahashi 等[2] 和 Puxeddu 等[3] 先后发现,OPN 表达水平与嗜酸 性粒细胞数目呈正相关,并且具有能够诱导嗜酸 性粒细胞迁移的效应。综上可见,OPN 能够影响 多种炎症细胞及其炎症因子的分泌,这些细胞因 子与炎症细胞相互作用相互影响构成复杂的网络, 进而影响气道炎症。而气道慢性炎症又是哮喘的 本质特点,这就提示 OPN 可能与哮喘的发病机制 存在某种关系。所以,研究 OPN 在不同程度哮喘 模型中的表达水平,对于明确 OPN 与哮喘气道炎 症的关系以及进一步研究哮喘的发病机制,都具 有重要的意义。
本研究以 OVA 致敏和激发建立不同程度急性 哮喘模型,并以 DXM 对哮喘小鼠进行干预。通过 3 次致敏、1 周或 2 周的激发,哮喘组小鼠出现呼 吸急促、鼻部瘙痒和口唇紫绀等哮喘症状,血清 中 OVA-sIgE 表达显著增加,病理切片 HE 染色显 示小鼠支气管上皮破坏、黏膜水肿、管腔缩窄、 大量炎性细胞浸润,说明哮喘模型建立成功。并 且激发 2 周组上述所有变化均较激发 1 周组明显, 说明在哮喘模型中,激发 2 周组的气道炎症比激 发 1 周组严重。研究结果显示,OPN 主要表达于 哮喘小鼠支气管上皮细胞及浸润的炎症细胞内, 哮喘组肺组织 OPN 及 OPN mRNA 表达水平明显高 于对照组,其中激发 2 周组显著高于激发 1 周组, 这表明 OPN 可能参与哮喘的发病并与气道炎症程 度密切相关,即气道炎症程度越重,OPN 表达水 平可能越高。根据本实验结果和既有的文献报道, 我们推测 OPN 可能是通过调节多种炎性细胞因子 来维持气道炎症进而参与哮喘发病。关于其具体 机制,尚需要进一步探究。
糖皮质激素作为哮喘治疗的一线用药,主要 是控制哮喘的免疫炎症反应,已获得极大的成效。 本研究动物模型中,DXM 组小鼠的哮喘症状、血 清中 OVA-sIgE 水平和病理学的相关变化都明显低 于哮喘组,这说明DXM治疗哮喘有效。本研究发现, DXM 组肺组织 OPN 蛋白及 mRNA 表达水平明显 低于哮喘组,表明 DXM 能够下调 OPN 的表达水平。 由此认为,DXM 抑制 OPN 的表达可能是其控制哮 喘炎症的机制之一。DXM 影响 OPN 表达的机制尚 不清楚,仍需我们进一步的努力探索。
总之,本研究首次评估了 OPN 与不同气道炎 症程度的相关性,并且分别从蛋白水平及转录水 平上,综合的评估 OPN 在哮喘及 DXM 模型中的 表达。研究者认为,本研究可能对拓展哮喘的发 病机制提供一个新的视角。
| [1] | MorimoTo J, Kon S, MaTsui Y, eT al. OsTeoponTin; as a TargeT molecule for The TreaTmenT of inflammaTory diseases[J]. Curr Drug TargeTs, 2010, 11(4): 494-505. |
| [2] | Takahashi A, Kurokawa M, Konno S, eT al. OsTeoponTin is involved in migraTion of eosinophils in asThma[J]. Clin Exp Allergy, 2009, 39(8): 1152-1159. |
| [3] | Puxeddu I, Berkman N, RibaTTi D, eT al. OsTeoponTin is expressed and funcTional in human eosinophils[J]. Allergy, 2010, 65(2): 168-174. |
| [4] | Kurokawa M, Konno S, MaTsukura S, eT al. EffecTs of corTicosTeroids on osTeoponTin expression in a murine model of allergic asThma[J]. InT Arch Allergy Immunol, 2009, 149 Suppl 1: 7-13. |
| [5] | Liu Y, Lu X, Yu HJ, eT al. The expression of osTeoponTin and iTs associaTion wiTh Clara cell 10 kDa proTein in allergic rhiniTis[J]. Clin Exp Allergy, 2010, 40(11): 1632-1641. |
| [6] | Ashkar S, Weber GF, PanouTsakopoulou V, eT al. ETa-1 (osTeoponTin): an early componenT of Type-1 (cell-mediaTed) immuniTy[J]. Science, 2000, 287(5454): 860-864. |
| [7] | Kurokawa M, Konno S, Takahashi A, eT al. RegulaTory role of DC-derived osTeoponTin in sysTemic allergen sensiTizaTion[J]. Eur J Immunol, 2009, 39(12): 3323-3330. |
| [8] | Seier AM, Renkl AC, Schulz G, eT al. AnTigen-specific inducTion of osTeoponTin conTribuTes To The chronificaTion of allergic conTacT dermaTiTis[J]. Am J PaThol, 2010, 176(1): 246-258. |
| [9] | XanThou G, Alissafi T, SemiTekolou M, eT al. OsTeoponTin has a crucial role in allergic airway disease Through regulaTion of dendriTic cell subseTs[J]. NaT Med, 2007, 13(5): 570-578. |
| [10] | Kariyawasam HH, Robinson DS. The role of eosinophils in airway Tissue remodelling in asThma[J]. Curr Opin Immunol, 2007, 19(6): 681-686. |
| [11] | Singh M, FosTer CR, Dalal S, eT al. OsTeoponTin: role in exTracellular maTrix deposiTion and myocardial remodeling posT-MI[J]. J Mol Cell Cardiol, 2010, 48(3): 538-543. |
| [12] | VeTrone SA, MonTecino-Rodriguez E, Kudryashova E, eT al. OsTeoponTin promoTes fibrosis in dysTrophic mouse muscle by modulaTing immune cell subseTs and inTramuscular TGF-beTa[J]. J Clin InvesT, 2009, 119(6): 1583-1594. |
| [13] | Kurokawa M, Kokubu F, MaTsukura S, eT al. EffecTs of corTicosTeroid on The expression of Thymus and acTivaTion-regulaTed chemokine in a murine model of allergic asThma[J]. InT Arch Allergy Immunol, 2005, 137 Suppl 1: 60-68. |
| [14] | Suzuki S, Kokubu F, Kawaguchi M, eT al. Expression of inTerleukin-17F in a mouse model of allergic asThma[J]. InT Arch Allergy Immunol, 2007, 143 Suppl 1: 89-94. |
| [15] | Koguchi Y, Kawakami K, Uezu K, eT al. High plasma osTeoponTin level and iTs relaTionship wiTh inTerleukin-12-mediaTed Type 1 T helper cell response in Tuberculosis[J]. Am J Respir CriT Care Med, 2003, 167(10): 1355-1359. |
| [16] | Xu G, Nie H, Li N, eT al. Role of osTeoponTin in amplificaTion and perpeTuaTion of rheumaToid synoviTis[J]. J Clin InvesT, 2005, 115(4): 1060-1067. |
| [17] | SaTo T, Nakai T, Tamura N, eT al. OsTeoponTin/ETa-1 upregulaTed in Crohn's disease regulaTes The Th1 immune response[J]. GuT, 2005, 54(9): 1254-1262. |
| [18] | Comabella M, PericoT I, GoerTsches R, eT al. Plasma osTeoponTin levels in mulTiple sclerosis[J]. J Neuroimmunol, 2005, 158(1-2): 231-239. |
| [19] | Weber GF, Zawaideh S, HikiTa S, eT al. PhosphorylaTion-dependenT inTeracTion of osTeoponTin wiTh iTs recepTors regulaTes macrophage migraTion and acTivaTion[J]. J Leukoc Biol, 2002, 72(4): 752-761. |
| [20] | Li X, O'Regan AW, Berman JS. IFN-gamma inducTion of osTeoponTin expression in human monocyToid cells[J]. J InTerferon CyTokine Res, 2003, 23(5): 259-265. |
| [21] | Konno S, Eckman JA, PlunkeTT B, eT al. InTerleukin-10 and Th2 cyTokines differenTially regulaTe osTeoponTin expression in human monocyTes and dendriTic cells[J]. J InTerferon CyTokine Res, 2006, 26(8): 562-567. |
| [22] | Delimpoura V, Bakakos P, Tseliou E, eT al. Increased levels of osTeoponTin in spuTum supernaTanT in severe refracTory asThma[J]. Thorax, 2010, 65(9): 782-786. |
| [23] | SamiTas K, Zervas E, ViTTorakis S, eT al. OsTeoponTin expression and relaTion To disease severiTy in human asThma[J]. Eur Respir J, 2011, 37(2): 331-341. |
| [24] | Hillas G, Loukides S, KosTikas K, eT al. Increased levels of osTeoponTin in spuTum supernaTanT of smoking asThmaTics[J]. CyTokine, 2013, 61(1): 251-255. |
 2014, Vol. 16
2014, Vol. 16


