星形胶质细胞(astrocyte,AS)始终伴随着神经元的整个发育过程,神经元与AS 之间的相互作用对于中枢神经系统的功能非常重要,因此,建立良好的AS 培养模型对研究神经系统疾病,特别是AS 在神经元发育、损伤和修复中的作用尤为重要。虽然获取AS 的方法较多,但一般研究偏重AS 的纯度而较少关注其生物学特性。本研究参照国内外培养分离胶质细胞的方法[1, 2, 3] 进行了改良,采取低密度种植、限制培养基成分并在长时期内不给予更换或补加培养液的方法,获得了一种纯度既高,又不改变其生物学特性,能反映其在脑中功能的AS 体外培养方法,为AS 生物学特性的深入研究提供了基本的实验模型。 1 材料与方法 1.1 实验动物
出生3 d 内健康清洁级Sprague-Dawley(SD)大鼠,由四川大学华西实验动物中心提供,许可证号2004A067,雌雄不限。 1.2 主要试剂与仪器
主要试剂:DMEM 基础培养液购自Gibco 公司,L-谷氨酰胺、胰蛋白酶、胎牛血清、多聚赖氨酸均为Sigma公司产品,兔抗大鼠胶质纤维酸性蛋白(Rabbit Anti-GFAP)购自Millipore公司,四甲基异硫氰酸罗丹明(Tetramethylrhodamine,TRITC)标记的荧光二抗为北京中杉公司产品。
主要仪器:超净工作台(Airtech,日本)、解剖显微镜(Olympus,日本)、CO2 培养箱(Thermo,美国)、恒温水浴箱(Memmert,美国)、三气培养箱(Thermo,美国),尼康全自动倒置镜像工作站(Nikon TiE,日本)。70 μm 筛网购自Mi11ipore公司。 1.3 大脑皮质AS 的原代培养
采用含10% 胎牛血清DMEM 培养基,通过限定细胞种植密度,同时限制培养基成分并减少换液次数的方法培养AS。具体方法如下:SD 大鼠(<p;3 d)显微镜下分离大脑皮质,放入预先冰浴的HBSS 液中洗涤后,加入0.125% 的胰蛋白酶,置37℃水浴箱震荡消化10~15 min 后,加入含10%胎牛血清的DMEM 培养基终止消化,吹打成细胞悬液,通过70 μm 筛网过滤后,调整细胞悬液的密度为1×105/mL,接种到培养瓶中,置37℃、5%CO2 培养箱中差速粘附处理60 min 后,换新培养瓶。 1.4 分组及传代培养
将上述细胞随机分为2 组,A 组:培养24 h后全量换液,以后不予更换培养液,培养14 d 后进行传代3 次。传代前用力振荡培养瓶,吸出培养基,PBS 清洗后加入0.125% 的胰蛋白酶消化3~5 min,加入含血清培养基终止消化,调整细胞密度为5×104/mL,取液每孔1 mL 加入含盖玻片的培养板,置37℃含5% CO2 培养箱,24 h 后换液,以后不再换液或补加任何培养液,待7 d 左右观察到细胞长出大量指状突起并相互连接形成AS 网络时,进行GFAP 染色鉴定。B 组:培养24 h 后全量换液,以后每2~3 d 更换一次营养液,培养14 d后进行GFAP 染色鉴定,分别计数十个视野范围内的纤维型星形胶质细胞(fibrous astrocyte,FAS)与原浆型星形胶质细胞(protoplasmic astrocyte,PAS)平均比率。 1.5 AS 的免疫荧光染色法鉴定
神经胶质原纤维酸性蛋白(Glial fibrillary acidic protein,GFAP) 是目前公认的AS 表达的特异性抗原,4',6- 二脒基-2- 苯基吲哚(4',6-Diamidino-2-phenyindole dilactate,DAPI) 是一种能够与DNA 强力结合的荧光染料,可将细胞核染为蓝色。采用GFAP/DAPI 免疫荧光细胞化学法对培养的细胞进行鉴定,同时,计数高倍视野下GFAP+DAPI+ 细胞数均占DAPI+ 细胞数的比例,具体方法见参考文献[4]。 1.6 统计学分析
采用SPSS 13.0 统计软件进行统计学分析,所有计量资料均以均数± 标准差(x±s)表示,多组间均数的比较采用单因素方差分析,P<0.05 示差异有统计学意义。 2 结果 2.1 AS 原代培养细胞的特点
大鼠大脑皮层细胞接种 4 h 后,部分细胞开始长出细长的突起,培养 24 h 后,多数细胞均已贴壁,光晕明显。培养3~4 d 后,大多数细胞形成明显的胞突。原代培养12~14 d,可见为胞体较大的贴壁细胞,呈星形或多角形,胞质丰富,形状不规则,胞突较多较长,胞核圆形或椭圆形,常偏于胞体一侧。 2.2 AS 传代培养细胞的特点
A 组中FAS 占(86.3±0.9)%,PAS <15%;而B 组中PAS 占(92.8±1.3)%,两组PAS 所占的比例差异有统计学意义(F=6.29,P=0.026)。A 组细胞传代后细胞生长更为活跃,培养5~7 d 细胞即可相互交织形成密集的 AS 网络。B 组中,培养7 d 左右可见细胞大量增殖,铺满整个盖玻片;培养14 d 左右可见纤维细型AS 胞体增大,突起增粗与回缩,网络样结构消失,而 PAS 明显增多。 2.3 GFAP/DAPI 免疫荧光染色结果
GFAP 是 AS 的骨架蛋白,分布于细胞胞浆和突起中,是目前公认的AS 的特异性标记物[5],故GAFP+DAPI+ 细胞为AS。在倒置荧光显微镜下,可见GFAP 在AS 胞浆和突起中均染为红色,细胞核被DAPI 染为蓝色( 图1~2)。GFAP/DAPI 免疫荧光染色结果示A 组与B 组中GFAP+DAPI+ 细胞数占DAPI+ 细胞数的比例均在98% 以上[A 组(99.6±1.2)%,B 组(99.6±1.0)%]。
 |
图 1 A 组体外传代培养的大鼠大脑皮层AS(×400) AS 基本均为纤维型,分化成熟,可见密集的AS 网络。 |
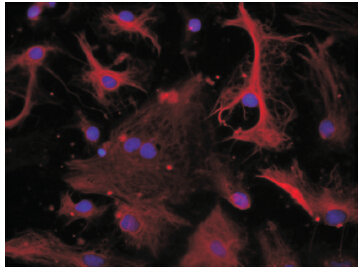 |
图 2 B 组体外传代培养的大鼠大脑皮层PAS(×400) AS 以原浆型为主,外观扁平似圆盘状,细胞体较大,突起宽而扁,分支少,均匀排列生长。 |
AS 是中枢神经系统的主要支持成分,具有调节脑内微环境和神经传递等重要功能,并为神经元提供营养物质和神经营养因子,对神经元生存、发育、再生和分化均有重要作用[6, 7, 8]。研究表明不同类型的AS 在形态结构和生物学功能上存在一定差异[9, 10, 11],能分泌不同的神经营养因子和细胞因子,从而对神经干细胞(nerve stem cell,NSC)分化起着一定的调控作用。AS 分为纤维型(FAS)和原浆型(PAS)两类。FAS 多分布在白质,细胞体较小,呈圆形、卵圆形或多角形,突起细长,分支较多,胞质内含大量胶质丝,组成胶质丝的蛋白质即GFAP;PAS 多分布在灰质,细胞体较大,外观扁平似圆盘状,突起宽而扁,分支较少,胞质内胶质较少,活体内的AS 以纤维型为主[12]。本实验在体外分离、培养、纯化和鉴定纤维型AS,为进一步的体外研究打下基础。
为获得纯度更高、更接近在体状态的FAS,本研究对以往的培养方法做了以下改进:(1)首先,与以往多选取胎鼠不同,本实验以出生后3 d 内的新生大鼠为材料,此时乳鼠大脑皮层的AS 处于分裂增殖高峰期,不但可以分离获得更多的AS,而且培养的AS 细胞容易成活。(2)选取大脑皮层而非整个大脑:中枢神经系统的灰质组织是AS 和神经元密切接触的主要场所,且AS 存在明显的脑区特异性[13],故从灰质组织获取AS 有利于全面认识其生物学作用。(3)尽可能地去除成纤维细胞:以往多采用选用出生不超过3 d 新生小鼠以减少脑中成纤维细胞比例及取材时尽可能完整剥除脑膜的方法去除成纤维细胞,本研究在以往的方法上进行了改进,将原代培养及经2 次传代后的AS 采取差速贴壁的方法,进一步去除成纤维细胞。(4)差速贴壁及反复传代预贴壁以提高细胞纯度:基于成纤维细胞及少突胶质细胞较AS 贴壁快,1 h 内主要是少突胶质细胞,因此,本研究在接种1 h 时更换培养瓶,以减少成纤维细胞及少突胶质细胞。少突胶质细胞增殖速度远小于AS,故随培养时间的延长,少突胶质细胞所占比例越来越少,传代后则更少。故反复传代预贴壁将大大提高细胞悬液中AS 比例,这也是本研究分组的目的之一。(5)采取较低密度接种的方法:原代培养时接种细胞的密度是一个与AS 纯化程度密切相关的问题。若接种密度过低,则一方面不利于AS 的存活,另一方面容易造成成纤维细胞的快速大量增殖;若接种密度过高,则不利于AS 分化成熟,经过反复试验,本研究采取原代培养以1×105/mL 密度接种,传代培养以5×104/mL 密度接种的方法取得了成功。(6)限制给予培养液以获得更接近在体状态的FAS:既往文献报道体外培养的AS 与在体脑内的AS 存在显著差异,活体内的AS 以纤维型为主,而培养的AS 通常为扁平多角,核周体丰富,仅有少量枝状突起的原浆型;普通培养条件下AS 常过度增殖分裂直至细胞铺满支持物,且随细胞培养时间的延长细胞间的异质性逐渐消失,而成年脑内AS 数量稳定,不同部位AS 有显著的异质性[13]。既往研究发现,非平衡生长环境是AS 体外发育出现有序的阶段性特征的重要原因[14, 15]。本研究发现,如果限定细胞种植密度及减少换液次数,得到的主要是FAS,如果采取高密度接种及勤换液的方法,PAS 的数目将大大增加。造成这种现象的原因尚不清楚,但AS 的增殖和形态发育受培养液中营养物质和代谢产物的调控[14]。而AS 是体内产生神经营养因子的主要细胞,AS 条件培养液中含胶质细胞源性神经营养因子等多种神经营养成分[16],这些营养成分可调节其周围AS 的活动[17],故推测高密度接种和反复更换培养液可能打破AS 的非平衡生长环境,造成培养的AS 在形态和异质性上与体内的AS 存在差异。本实验条件下细胞在含10%新生牛血清DMEM 培养液中,通过限定种植密度、限制培养基成分及减少换液次数,使得营养物质因生长增殖不断消耗,细胞代谢产物不断增加,细胞生长系统出现营养和代谢产物的浓度梯度,形成了非平衡的细胞生存环境,获得了更接近在体状态的FAS,同时,研究中发现AS 间可见网络样连接,为AS 之间物质、能量和信息交流的结构基础。
综上所述,本研究通过对以往的AS 的培养方法进行改进,获得了高产量的FAS,该方法的建立为进一步研究AS 的结构和功能提供了可靠的方法和实验材料。
| [1] | 黄柏胜, 刘发益, 曹莉, 等. 星形胶质细胞培养方法的改进[J]. 实用预防医学, 2007, 14(4): 981-983. |
| [2] | 张芸, 张志坚, 端礼荣, 等. 大鼠脑皮层星形胶质细胞培养与鉴定[J]. 江苏大学学报(医学版), 2006, 16 (6): 493-495. |
| [3] | He L, Zhang X, Wei X, et al. ProgesTerone aTTenuaTes aquaporin-4 expression in an asTrocyTe model of ischemia/reperfusion[J]. Neurochem Res, 2014, 39(11): 2251-2261. |
| [4] | 郭慧, 马娇, 童煜, 等. 三种方法建立神经元与星形胶质细胞共培养模型的对比研究[J]. 中国当代儿科杂志, 2010, 12(12): 984-987. |
| [5] | 徐慧君. 神经生物学[M]. 苏州:苏州大学出版社, 2004: 62-64. |
| [6] | Paixão S, Klein R. Neuron-asTrocyTe communicaTion and synapTic plasTiciTy[J]. Curr Opin Neurobiol, 2010, 20(4): 466-473. |
| [7] | AlbrechT J, Sidoryk-Wegrzynowicz M, Zielinska M, et al. Roles of gluTamine in neuroTransmission[J]. Neuron Glia Biol, 2011, 6(4): 263-276. |
| [8] | TakaTa N, Mishima T, HisaTsune C, et al. AsTrocyTe calcium signaling Transforms cholinergic modulaTion To corTical plasTiciTy in vivo[J]. J Neurosci, 2011, 31(49): 18155-18165. |
| [9] | Sosunov AA, Guilfoyle E, Wu X, et al. PhenoTypic conversions of "proToplasmic" To "reacTive" asTrocyTes in Alexander disease[J]. J Neurosci, 2013, 33(17): 7439-7450. |
| [10] | Liu Y, Wang L, Long Z, et al. ProToplasmic asTrocyTes enhance The abiliTy of neural sTem cells To differenTiaTe inTo neurons in viTro[J]. PLoS One, 2012; 7(5): e38243. |
| [11] | Liu Y, Liu RR, Wang L, et al.The effecTs of differenT phenoType asTrocyTes on neural sTem cells differenTiaTion in co-culTure[J]. Neurosci LeTT, 2012, 508(2): 61-66. |
| [12] | Jukkola P, Guerrero T, Gray V, et al. AsTrocyTes differenTially respond To inflammaTory auToimmune insulTs and imbalances of neural acTiviTy [J]. AcTa NeuropaThol Commun, 2013, 1(1): 70. |
| [13] | Oberheim NA, Goldman SA, Nedergaard M. HeTerogeneiTy of asTrocyTic form and funcTion [J]. MeThods Mol Biol, 2012, 814: 23-45. |
| [14] | 石军, 张可成, 蔡文琴. 大鼠脑皮质星形胶质细胞的限制性细胞培养 [J]. 中国组织化学与细胞化学杂志, 2000, 9(2): 206-209. |
| [15] | Nagayasu Y, MoriTa SY, Hayashi H, et al. Increasing cellular level of phosphaTidic acid enhances FGF-1 producTion in long Term-culTured raT asTrocyTes [J]. Brain Res, 2014, 1563: 31-40. |
| [16] | 严稽文, 黄其林. 星形胶质细胞条件培养液对缺氧损伤神经元的保护作用[J].神经解剖学杂志, 2007, 23(3): 277-282. |
| [17] | Henneberger C, Papouin T, OlieT SH, et al. Long-Term poTenTiaTion depends on release of D-serine from asTrocyTes [J]. NaTure, 2010, 463(7278): 232-236. |
 2014, Vol. 16
2014, Vol. 16

 , 俞丹, 周晖, 童煜
, 俞丹, 周晖, 童煜