神经母细胞瘤是儿童最常见的颅外实体瘤, 占所有儿童肿瘤的8%~10%,约8 000 个活产婴 儿中有1 例。在美国,15 岁以下儿童年发病率为 9.4/ 百万,据此推算我国每年新发病3 000 例左 右。本病中位发病年龄22 个月,80% 以上患者发 生于5 岁以内,男女发病率之比为1.2 : 1[1]。目前 临床上将神经母细胞瘤分为低危组、中危组和高 危组。低危组是指临床分期为1、2 期,MYCN 基 因为单拷贝者。中危组指临床4S 期(局限性原 发肿瘤1 或2 期,广泛转移仅限于肝脏、皮肤和 / 或骨髓)、MYCN 基因为单拷贝;或临床3 期, Shimada 良好型,MYCN 单拷贝;或临床4 期,年 龄1 岁以下,MYCN 单拷贝。高危组是指临床4 期,年龄>1 岁;或临床3 期,>1 岁,Shimada 预 后不良型,MYCN 基因扩增或者血清铁蛋白升高; 或临床3、4、4S 期, 任何年龄+ MYCN 扩增; 或临床1、2 期,年龄> 1 岁+ MYCN 扩增者。根 据上述分类,55% 神经母细胞瘤患者为低危或中 危,长期无病生存率> 90%;45% 患者具有高危 特征,长期无病生存率10% 以下。神经母细胞瘤 预后不良的因素主要有:临床3、4 期;年龄大于 1 岁;血清铁蛋白>150 mg/L,乳酸脱氢酶(LDH) >1 500 IU/L,MYCN 拷贝数>10, 神经元特异性 烯醇化酶(NSE)>100 UG/L,DNA 指数1,染色 体 1p 缺失或17q 获得等。治疗失败者多见于治疗 中病情进展(15%~20%)或临床完全缓解后复发 (35%~45%),疾病进展或复发的部位多见于原 发部位、骨和骨髓,除此还有10%~20% 的患者对 诱导治疗无效,属于先天耐药者,增加了治疗难度。
CCG(儿童癌症研究组)和POG(儿科肿瘤 研究组)曾通过增加化疗强度、联合自体造血干 细胞移植、加用顺式维甲酸维持治疗,结合手术和局部放疗使得疗效有了明显的提高[2]。COG(儿 童肿瘤研究组)总结全美多中心随机对照研究 (n=563,均为IV 期,高危组),采用马利兰加 马法兰作为自体造血干细胞移植前的预处理方案, 结果3 年总生存率和无病生存率分别达到60% 和 49%,而对照组,即以卡铂、足叶乙甙和马法兰为 预处理方案,分别为48% 和33%[2],两组疗效存 在明显差异,前者较好,这一进展被美国临床肿 瘤学会评为2011 年全美临床肿瘤领域十大进展之 一[3]。近年来随着转化医学研究的不断深入,免疫 治疗得到了重视并进行了大量的临床研究,并取 得了肯定的疗效,此外调节肿瘤细胞信号通路的 制剂在神经母细胞瘤的治疗也得到了广泛的研究, 如哺乳动物雷帕霉素靶蛋白(mTOn)信号通路抑 制剂等。本文就近几年国内外在神经母细胞瘤治 疗上取得的进展做一阐述。
一般使用COG ANBL09P1 方案,在确诊后开 始诱导治疗。
包括6 个疗程,每个疗程持续3 周。
(1) 环磷酰胺: 剂量为 400 mg/(m2·d) [ 体重≤ 12 kg 者13.3 mg/(kg·d)], 每次静脉滴注15~30 min,每天1 次,连用5 d, 用药当天水化。(2)拓普替康:剂量1.2 mg(/ m2·d), 静脉滴注30 min 以上,每天1 次,连用5 d。
同第1 疗程。第22 天开始, 需中性粒细胞绝对值(ANC)>0.75×109/L,血小 板>75×109/L。此疗程结束后,在血象恢复过程中 采集外周血干细胞。
化疗第2 疗程末采集外周血用于移植而非化 疗结束时采集外周血,是因为化疗强度大,骨髓 抑制明显,6 个疗程结束时外周血采集的干细胞数 量可能不足,移植后很难造血重建。神经母细胞 瘤是实体瘤,骨髓受累的程度比白血病轻且易清 除,外周血肿瘤细胞污染的机会少。
(1)顺铂:剂量50 mg/(m2·d) [ 体重≤ 12 kg 者:1.67 mg/(kg·d)], 静脉滴 注1 h 以上,连用4 d。(2)足叶乙甙:剂量为 200 mg/(m2·d) [ 体重≤ 12 kg 者:6.67 mg/(kg·d)],静脉滴注1~2 h,连用3 d。
由于顺铂可损伤肾小管,故在使用时用甘露 醇利尿加速其排泄,一般在顺铂使用前给予甘露 醇8 g/m2 静脉推注,顺铂使用后给予甘露醇7 g/m2 持续静脉滴注6 h;除此还要注意顺铂对听力和神 经系统的损害。
(1) 环磷酰胺: 每剂 2 100 mg/m2( 若体重≤ 12 kg 则70 mg/kg), 第 1、2 天用,静脉滴注>6 h。(2)长春新碱:每 剂0.67 mg/m2 , 若体重≤ 12 kg 则0.022 mg/kg, 静脉推注, 第1~3 天用。(3) 阿霉素: 每剂 25 mg/m2, 体重≤ 12 kg 者0.83 mg/kg, 静脉滴注 24 h 以上,第1~3 天用。
从过去使用的经验看,此方案对骨髓抑制明 显,外周血白细胞可降低至0.1~0.2×109/L,要注 意感染的发生。
第4 疗程后手术切除原发部位肿瘤[4]。经过 4 个疗程的化疗,大部分病人肿瘤组织块没有明显 的缩小,还不能完全切除肿瘤,即使这样也应该 尽可能地切除,即使是部分切除。
同疗程3。
推荐在131I-MIBG 后13 d 给予至少CD34+ 细胞 2×106/kg 以促进造血恢复。
为防辐射,服用碘化钾,第1 天为负荷量 6 mg/kg,在131I-MIBG 输入前8~12 h 给予,然后 1~7 d,每次1 mg/kg,Q4 h。131I-MIBG 治疗神经母 细胞瘤SFDA 没有批准,国内只有零星病例应用, 基本没有开展。从国外应用情况看,比较安全, 且疗效较好。国内从技术到设备开展此项治疗问 题不大,应积极向国家FDA 申报取得批准后开展。
预处理方案 采用马利兰和马法兰,具体如下。
-7 d,劳拉西泮或左乙拉西坦预防白消安静脉注射后引起的癫癎。左乙拉西坦每剂10 mg/kg, 每日2 次,口服 (最大剂量:1 000 mg)。 -7 d~ -2 d,给予劳拉西泮(0.02~0.05 mg/kg, 最大量2 mg/ 剂),白消安前30 min 给药,持续至 最后一剂白消安后24 h;
-6 d~ -3 d,白消安静脉注射,持续2 h 以上, Q6 h× 16 剂, 体重 < 10 kg 者0.8 mg/kg,> 10 kg 和 < 4 岁者 1 mg/kg;
-1 d,马法兰140 mg/m2,静脉注射,至少在 最后一剂白消安后24 h 给药; 0 d,回输自体造血干细胞,至少在白消安输 注后24 h 回输。
CCG 资料显示在神经母细胞瘤自体骨髓移植 与异基因骨髓移植其远期疗效是一致的。其原因 是自体移植复发率高但移植相关并发症少,异基 因移植复发率低但移植相关并发症多。目前采用 以马法兰为主的以单纯化疗为主的预处理方案, 不采用放疗,移植的毒副作用可以控制在一定程 度。
白消安联合环磷酰胺组成的BuCy 方案是典型 清髓性预处理方案,在白血病的治疗中应用多年, 比较安全。将白消安与马法兰联合应用作为预处 理方案化疗强度大,可有效杀灭体内残留的神经 母细胞瘤细胞,过去未见报道。由于两个药物均 为烷化剂,且剂量大,骨髓抑制比较明显,应用 时应格外小心,避免因严重感染导致的死亡。需 注意马法兰静脉注射剂SFDA 尚未批准上市,如果 换用片剂,由于剂量大,消化道反应严重,患儿 难以耐受。解决的方法是鼓励生产企业报批或建 议立法,允许患者境外购买药品用于自身治疗。 过去对自体造血干细胞移植是否进行移植物 净化有争议,最近COG 多中心随机对照研究证实 净化不能提高疗效,改善预后[6]。
在移植治疗血象恢复后进行 放疗。原发部位已经切除及依据影像学诊断的神 经母细胞瘤或术中发现的淋巴结转移已切除者剂 量:21.6 Gy;原发部位有残留病变未切除者剂量: 36 Gy;移植前即存在的转移灶:21.6 Gy。此方案 对放疗的使用比过去积极,除了原发部位,对转 移部位也采用放疗,以前只对原发部位进行放疗。
目前来我院治疗的患儿许多没有接受放疗, 原因主要是担心放疗对生长发育的影响,加之年龄小不太配合。笔者认为对放疗应正确看待,不 可过分夸大其副作用。IV 期神经母细胞瘤患儿最 常见的复发部位为骨髓及原发部位,过去已经证 明放疗对减少原发部位的复发有重要作用,只有 在将来通过化疗和免疫等治疗取得很好的疗效情 况下逐步减少放疗的使用。
采用顺式维甲酸治疗。研究 发现13- 顺式维甲酸在体外可以诱导神经细胞瘤细 胞增殖分化为成熟细胞,失去恶性细胞的特征; 临床研究也证实13- 顺式维甲酸确实可以提高患儿 长期生存率,因此应用维甲酸来治疗造血干细胞 移植后可能残留的神经母细胞瘤细胞。移植后 59 d 开始13- 顺式维甲酸160 mg/(m2·d) ,分2 次, 口服14 d,休息14 d,共6 个月。停药后定期观察。
维持治疗阶段,在应用13- 顺式维甲酸的基础 上联合应用ch14.18 单克隆抗体(一种抗肿瘤相关 二唾液酸神经节苷酯GD2 的单克隆抗体)加GMCSF 或白介素2 等取得了确定的疗效。ch14.18 单 克隆抗体是一种嵌合抗体,由鼠IgG3b 14-18 可变 区和人IgG1-k 恒定区嵌合构建而成,I 期临床试验 结果显示,10 例神经母细胞瘤患儿接受19 个疗程 的ch14.18 治疗, 剂量为每疗程10~200 mg/m2,9 例可以评价的病例中1 例获得部分缓解,4 例有不 同程度反应[7]。另一组有关ch14.18 的研究中每疗 程采用剂量为30~50 mg/(m2·d),用5 d,9 例中 2 例获得完全缓解,2 例获得部分缓解[8]。ch14.18 的生物作用被证实可以介导补体依赖的细胞毒及 抗体依赖性的细胞介导的细胞毒作用。其不良反 应为疼痛、心动过速、高血压或低血压,发热和 荨麻疹,其不良反应与剂量相关。由于GM-CSF 可 以增强ch14.18 的ADCC 作用,因此GM-CSF 被用 来增强ch14.18 的治疗作用。此外,IL-2 也可增强 ch14.18 的作用,也可以作为配体使用。GM-CSF 有 一定的免疫增强作用。诱导治疗和干细胞移植有效 的高危神经母细胞瘤病人226 例,以1 : 1 的比例被 随机分配接受标准治疗(6 个周期的异维a 酸)或 免疫治疗(6 个周期的异维a 酸和5 个伴随周期的 ch14.18,并交替联合使用GM-CSF 与白介素-2)。 随访时间中位数为2.1 年,在无事件生存率(2 年 时为66%±5% vs 46%±5%,P=0.01)和总生存率(2 年时为86%±4% vs 75%±5%,P=0.02,没有对中 期分析进行校正)方面,免疫治疗优于标准治疗[9]。
下面介绍维甲酸治疗期间联合应用单克隆抗 体和细胞因子的具体方案。6 个疗程13- 顺式维甲 酸治疗中,前5 个疗程同时给予免疫治疗,其中1、3、 5 疗程同时给予ch14.18 单克隆抗体和GM-CSF, 2、 4 疗程中给予ch14.18 单克隆抗体和IL-2。
(1)疗程1,共25 d。ch14.18:每次25 mg/m2, 静脉滴注10 h 以上,第3~6 天用。开始应缓慢滴注, 无反应后再适当加快速度。在GM-CSF 应用后1 h 开 始。GM-CSF:每次250 μg/m2,皮下或静脉注射2 h以上, 第0~13 天用。13- 顺式维甲酸:每次80 mg/m2,每 天两次;体重>12 kg 者每次2.67 mg/kg,每天两次。 第11~24 天用药。
(2)疗程2 和4:共32 d,疗程1 的第24 天 作为本疗程第0 天。IL-2 : 300 百万单位/(m2·d), 第0~3 天用,450 百万单位/(m2·d),第7~10 天用。 ch14.18:每次25 mg/m2,静脉滴注10 h 以上,第 7~10 天用。13- 顺式维甲酸:每次80 mg/m2,每天 两次( 体重>12 kg 者);每次2.67 mg/kg,每天 两次(≤ 12 kg 体重)。第14~27 天用药。ch14.18 与GM-CSF 或IL-2 应使用不同的静脉通道滴入, 不可共用通道滴入。
(3)疗程3 和5:均持续24 d。除13- 顺式 维甲酸用药时间为10~23 d 外,余同疗程1。
(4) 疗程6:28 d。13- 顺式维甲酸:体重 >12 kg 者每次80 mg/m2,每天两次;体重≤ 12 kg 者每次2.67 mg/kg,每天两次。第14~27 天用药。
难治及复发神经母细胞的治疗不能依靠无限 增加化疗剂量和延长疗程,必须寻找新的途径。 研究发现调控瘤细胞信号传导通路可以抑制神经 母细胞瘤的增殖与分化并取得临床疗效[10]。mTOn 通道在蛋白合成的调控中发挥重要作用,而它在 多种人类癌症中被激活,包括神经母细胞瘤。 mTOn 通路将从营养分子、能量状态以及生长因子 传来的信号整合在一起,调控一系列生命过程, 包括自我吞噬、核糖体的生物组合和代谢等。在 神经母细胞瘤应用的mTOn 信号通路抑制剂是替 西罗莫司(temsirolimus)。
任何年龄,病理诊断为神经母细胞瘤或节细 胞神经母细胞瘤,尿香草扁桃酸(VMA)升高; 经过包括烷化剂和铂类药物强烈化疗而复发,或 经过至少4 疗程强烈化疗而判断为原发耐药或难 治的患者;CT 或MRI 检查证实存在1 cm 以上的 病变或MIBG 检查发现至少有一个部位存在阳性摄 取;或有明显肿物但MIBG 摄取未增加而病理活检 有病变者。
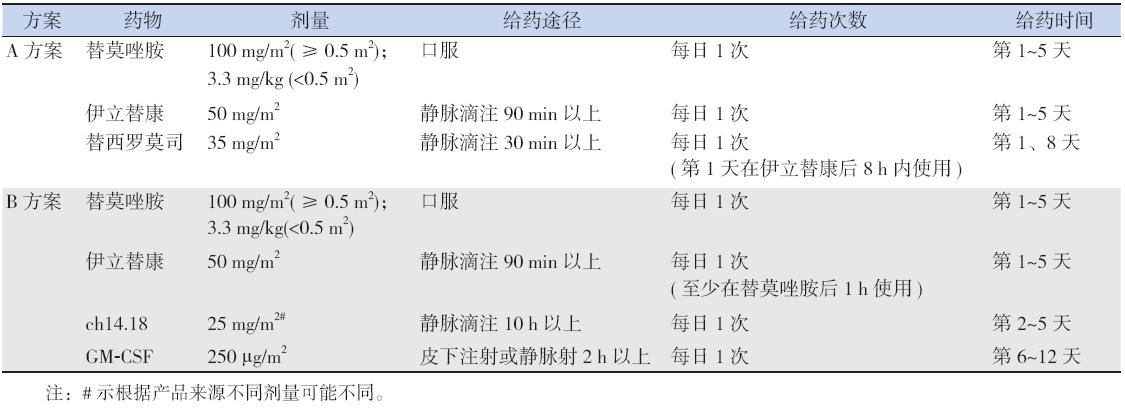
包括A 方案( 替莫唑胺+ 伊立替康+ 替 西罗莫司)和B 方案(替莫唑胺+ 伊立替康+ ch14.18+GM-CSF),见表1。21 d 为一疗程,最多 可用17 个疗程(1 年左右),疗程2、4、6 及以 后每4 个疗程评估一次治疗效果。 表1
| 表 1难治及复发高危神经母细胞瘤的治疗方案 |
酪氨 酸激酶受体存在于细胞膜,对细胞的正常增殖分 化发挥重要作用,当其过度表达或活化时细胞增 殖将不受正常调控。酪氨酸激酶介导的信号转导 与肿瘤的发生发展密切相关,抑制该受体活性可 以有效抑制肿瘤生长。间变性淋巴瘤激酶(ALK) 是酪氨酸激酶受体,有资料显示ALK 突变在遗传 性神经母细胞瘤和一些高危神经母细胞瘤的发病 中发挥重要作用,临床前研究证实了突变的ALK 在神经母细胞瘤中的致瘤作用及ALK RNA 抑制剂 作为靶向治疗的可靠性。PF-02341066 是一种小分 子ALK 抑制剂,临床前研究显示它可抑制多种瘤 细胞增殖或浸润,导致细胞凋亡,抑制血管生成。 它作为靶向治疗在成人已广泛应用,如索拉非尼 用于肾细胞癌,拉帕替尼用于晚期乳腺癌等。美 国COG 在2009 年9 月开始对难治性实体瘤进行 I/II 期临床试验,其中包括难治性或复发的神经母 细胞瘤,治疗方案为每日用药,连用28 d,取得 了一定疗效。
(1) Fenretinide:是一种新 的细胞毒性类维生素A 制剂,是人工合成的全反 式维甲酸衍生物,能引起神经母细胞瘤细胞凋亡 和坏死,在体外对神经母细胞瘤有高度毒性,包 括对维甲酸耐药的细胞系。(2) Safingol:为特异 性蛋白激酶C 抑制剂,体外实验表明,Safingol 对 神经母细胞瘤生长有一定抑制作用。(3)丁硫氨 酸亚砜胺( BSO ):可选择性抑制谷胱甘肽合成酶, 降低瘤细胞内谷胱甘肽浓度,增强烷化剂对细胞 的毒性。
| [1] | Mattano LA Jr, Moss TJ, Emerson SG. Sensitive detection of rare circulating neuroblastoma cells by the reverse transcriptasepolymerase chain reaction[J]. Cancer Res, 1992, 52(17): 4701-4705. |
| [2] | Stram DO, Matthay KK, O'Leary M, et al. Consolidation chemoradiotherapy and autologous bone marrow transplantation versus continued chemotherapy for metastatic neuroblastoma: a report of two concurrent Children's Cancer Group studies[J]. J Clin Oncol, 1996, 14(9): 2417-2426. |
| [3] | Vogelzang NJ, Benowitz SI, Adams S, et al. Clinical cancer advances 2011: Annual Report on Progress Against Cancer from the American Society of Clinical Oncology[J]. J Clin Oncol, 2012, 30(1): 88-109. |
| [4] | Castel V, Tovar JA, Costa E, et al. The role of surgery in stage IV neuroblastoma[J]. J Pediatr Surg, 2002, 37(11): 1574-1578. |
| [5] | Wilson JS, Gains JE, Moroz V, et al. A systematic review of 131I-meta iodobenzylguanidine molecular radiotherapy for neuroblastoma[J]. Eur J Cancer, 2013. doi: 10.1016/ j.ejca.2013.11.016.[Epub ahead of print]. |
| [6] | Kreissman SG, Seeger RC, Matthay KK, et al. Purged versus non-purged peripheral blood stem-cell transplantation for highrisk neuroblastoma (COG A3973): a randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(10): 999-1008. |
| [7] | Yu AL, Uttenreuther-Fischer MM, Huang CS, et al. Phase I trial of a human-mouse chimeric anti-disialoganglioside monoclonal antibody ch14.18 in patients with refractory neuroblastoma and osteosarcoma[J]. J Clin Oncol, 1998, 16(6): 2169-2180. |
| [8] | Handgretinger R, Anderson K, Lang P, et al. A phase I study of human/mouse chimeric antiganglioside GD2 antibody ch14.18 in patients withneuroblastoma[J]. Eur J Cancer, 1995, 31A(2): 261-267. |
| [9] | Yu AL, Gilman AL, Ozkaynak MF, et al. Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma[J]. N Engl J Med, 2010, 363(14): 1324-1334. |
| [10] | Morgenstern DA, Baruchel S, Irwin MS. Current and future strategies for relapsed neuroblastoma: challenges on the road to precision therapy[J]. J Pediatr Hematol Oncol, 2013, 35(5): 337-347. |
| [11] | Cohen LE, Gordon JH, Popovsky EY, et al. Late effects in children treated with intensive multimodal therapy for highrisk neuroblastoma: High incidence of endocrine and growth problems[J]. Bone Marrow Transplant, 2014. doi: 10.1038/ bmt.2013.218.[Epub ahead of print]. |
 2014, Vol. 16
2014, Vol. 16