肾母细胞瘤(Wilms' tumor,WT)是小儿最常 见的肾脏恶性肿瘤,占儿童恶性肿瘤的6%~7%, 大约75% 患儿发病年龄小于5 岁,平均发病年龄3.5 岁[1]。虽然通过手术、放疗及化疗的综合应用,患 儿预后已经有了极大的改观,但少数患儿由于复 发、转移及对化疗药物的不敏感导致死亡。肿瘤 的多药耐药是导致化疗失败的原因之一。因此如 何降低耐药性,提高化疗敏感性是目前亟待解决 的难题。苦参碱是一种传统中药成分,其抗肿瘤 作用越来越受到关注。研究发现苦参碱对儿童急 性淋巴细胞性白血病细胞、神经母细胞瘤LA-N-5 细胞、肝癌SMMC-7721 细胞、胃癌细胞、大肠癌 SW480 细胞、乳腺癌细胞等有抑制及杀伤作用, 且有明显的量效及时效关系[2, 3, 4, 5, 6]。程序性细胞死亡 4(programmed cell death 4,PDCD4)基因又称肿瘤 性转化抑制剂,是一种新的抑癌基因,可以促进 肿瘤细胞的凋亡,抑制肿瘤细胞的增生及侵袭, 并可增加肿瘤细胞对抗癌药物的敏感性。那么, 苦参碱对肿瘤的抑制作用是否与PDCD4 有关呢? 目前这方面的报道不多。因此本研究通过观察不 同浓度苦参碱与固定浓度顺铂对人肾母细胞瘤SKNEP- 1 细胞生长的影响,研究苦参碱抗肿瘤作用及 其剂量依赖性,并探讨其可能的作用机制。
人肾母细胞瘤SK-NEP-1 细胞购自中国科学 院细胞库;Hyclone 改良型RPMI-1640 培养基及 Hyclone 胎牛血清均购自赛默飞世尔生物化学制品 北京有限公司;苦参碱(粉末,纯度≥ 98%,中 鑫科技生物有限公司);顺铂(江苏豪森药业股 份有限公司);流式试剂盒(Annexin-V-FITC 试剂盒, 北京宝赛公司); 四甲基偶氮唑蓝(MTT)试剂 (Sigma 公司);二甲基亚砜(DMSO)(Sigma 公 司);TRIzol 液、TIANScript cDNA 第一链合成试 剂盒及2×Taq PCR Master Mix 均购自北京天根生 化科技有限公司;PDCD4 mRNA 的引物由上海捷 瑞生物工程有限公司设计及合成;β-actin 由艾博 思生物工程技术服务有限公司设计及合成。
人肾母细胞瘤SK-NEP-1 细胞置于含10%胎 牛血清和1%青霉素- 链霉素的RPMI-1640 培养液 中,于37℃、5% CO2、100%湿度的培养箱中孵育。 每3、4 d 换液,7 d 左右传代1 次,维持细胞处于 对数生长期。
(1)对照组:人肾母细胞瘤SK-NEP-1 细胞 不经任何处理。(2)顺铂组:细胞加入5 μg/mL 顺铂作用16 h。(3)0.5 mg/mL 苦参碱组:细胞 加入0.5 mg/mL 苦参碱处理24 h。(4)1.0 mg/mL 苦参碱组:细胞加入1.0 mg/mL 苦参碱处理24 h。 (5)1.5 mg/mL 苦参碱组:细胞加入1.5 mg/mL 苦 参碱处理24 h。(6)0.5 mg/mL 苦参碱联合顺铂 组:细胞加入0.5 mg/mL 苦参碱处理24 h 后,加 入5 μg/mL 顺铂作用16 h。(7)1.0 mg/mL 苦参碱 联合顺铂组:细胞加入1.0 mg/mL 苦参碱处理24 h 后,加入5 μg/mL 顺铂作用16 h。(8)1.5 mg/mL 苦参碱联合顺铂组:细胞加入1.5 mg/mL 苦参碱处 理24 h 后,加入5 μg/mL 顺铂作用16 h。(9)空 白组:无细胞只有相应培养液。
收集对数生长期SK-NEP-1 细胞, 制成 1×104/mL 细胞悬液,接种于96 孔板,每组设6 个复孔,取其平均数。按上述分组加药处理后,每 孔加MTT(5 mg/mL)20 μL,培养箱中孵育4 h, 吸去孔内培养上清液,每孔加150 μL DMSO,震 荡15 min,于1 h 内在酶标仪测其波长492 nm 的 吸光度(OD 值)。 各组同时进行MTT 检测,空 白组调零,结果取均值。各组细胞的相对存活率= ([ 实验组吸光度- 空白组吸光度)(/ 对照组吸光度- 空白组吸光度)]×100%。实验独立重复3 次。
收集对数生长期SK-NEP-1 细胞, 制成 1×104/mL 细胞悬液,接种于六孔板,按上述分组 加药,每组3 个样本,实验独立重复3 次。各实 验组同时进行流式细胞检测,细胞用4℃预冷的 PBS 洗两遍并离心(1 000 rpm/min、10 min)后, 加Binding Buffer 200 μL 悬浮细胞, 加Annexin V-FITC 10 μL, 避光室温反应15 min 后, 再加 Binding Buffer 300 μL 及 PI 5 μL 混匀,于1 h 内在 流式细胞仪上检测。
收集对数生长期SK-NEP-1 细胞, 制成1×104/mL 细胞悬液接种在50 mL 细胞培养瓶 中,按上述分组加药,每组3 个样本,实验独 立重复3 次。各实验组同时进行RT-PCR 检测。 TRIzol 液提取细胞总RNA,具体操作按说明书 进行,紫外分光光度计(A260/A280)检测RNA 纯度及完整性, 按说明书步骤逆转录mRNA 为cDNA。PDCD4 引物: 上游序列(5' → 3') AAAGGCGACTAAGGAAAAACTCATC; 下游序列 (5' → 3') GCCTATCCAGCAACCTTCCCT, 片段 长度为129 bp。β-actin 引物:上游序列为(5' → 3') CGAAACTACCTTCAACTCCATC ; 下游序列为 (5' → 3') AGTGATCTCCTTCTGCATCCT, 片段 长度为130 bp。反应条件:94 ℃ 预变性 3 min; 94℃变性 30 s,58℃(PDCD4)/56℃(β-actin) 退火30 s,72℃延伸1 min,共30 个循环;最后 72℃延伸5 min。扩增产物进行琼脂糖凝胶电泳。 利用电脑成像统计电泳后泳带密度,通过密度分 析测定目的基因产物与内参照基因产物的比率, 半定量分析目的基因的表达。
采用SPSS 16.0 统计软件对数据进行统计学分 析。计量资料以均数± 标准差(x±s)表示,多 组间比较应用单因素方差分析,组间两两比较采 用SNK-q 检验,P<0.05 为差异有统计学意义。
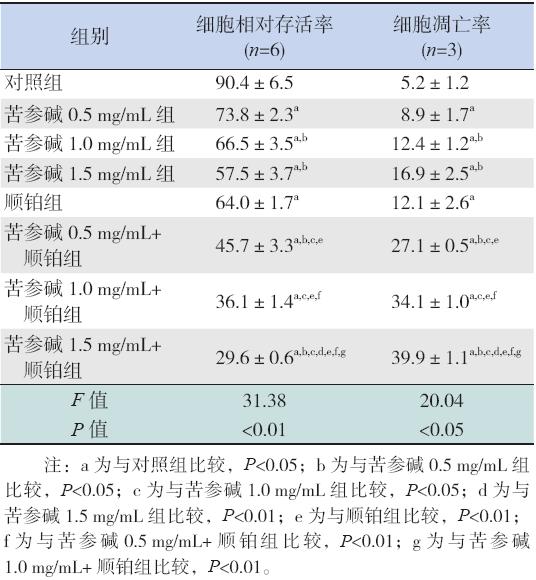
各实验组SK-NEP-1 细胞的存活率均低于对 照组(均P<0.05),苦参碱组随药物浓度增加, 存活率逐渐降低。苦参碱联合顺铂组与相同浓 度单药苦参碱组比较,存活率均明显降低(均 P<0.05)。苦参碱联合顺铂组与顺铂组比较,存活 率均明显降低(均P<0.01)。见表1。
| 表 1 各组细胞存活率及凋亡率 (x±s,%) |
各实验组SK-NEP-1 细胞的凋亡率均高于对 照组(均P<0.05),苦参碱组随药物浓度增加, 凋亡率逐渐增高。苦参碱联合顺铂组与相同浓 度单药苦参碱组比较,凋亡率均明显增高(均 P<0.01)。苦参碱联合顺铂组与顺铂组比较,凋亡 率均明显增高(均P<0.01)。见表1和<图1。
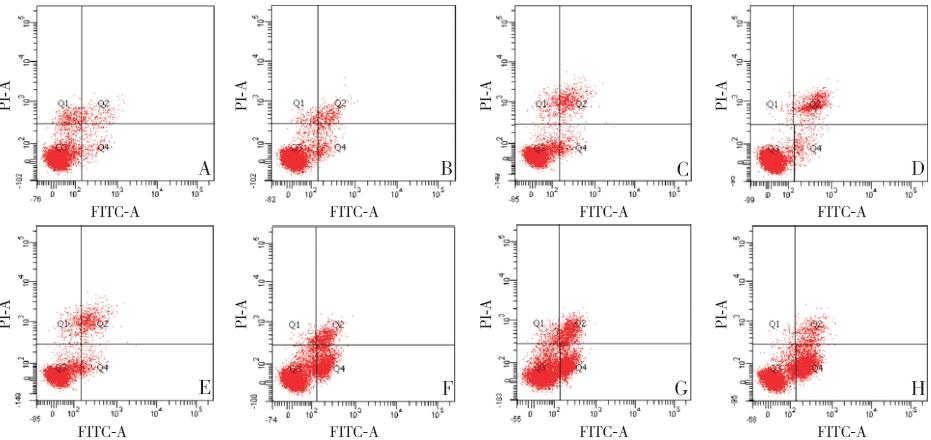 |
图 1 流式细胞仪检测SK-NEP-1 细胞的凋亡 A:对照组;B:苦参碱0.5 mg/mL 组;C:苦参碱1.0 mg/mL 组; D:苦参碱1.5 mg/mL 组;E:顺铂组;F:苦参碱0.5 mg/mL+ 顺铂组;G:苦参碱1.0 mg/mL+ 顺铂组;H:苦参碱1.5 mg/mL+ 顺铂组。图中左上象限表示机械损伤的细胞;右上象限表示晚期凋亡以及继发坏死的细胞;左下象限表示存活细胞;右下象 限表示早期凋亡细胞。 |
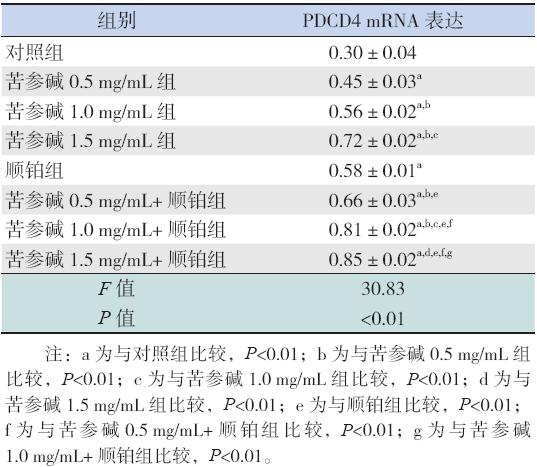
各实验组PDCD4 mRNA 的表达水平均高于对 照组(均P<0.01)。苦参碱组随药物浓度增加, PDCD4 mRNA 表达水平逐渐增加(P<0.01)。苦 参碱联合顺铂组与相同浓度单药苦参碱组比较, PDCD4 mRNA 表达均显著提高(均P<0.01)。联 合顺铂组与顺铂组比较,PDCD4 mRNA 表达水平 均明显升高(均P<0.01)。见表2和<图2。
| 表 2 各组细胞PDCD4 mRNA 表达 (n=3,x±s) |
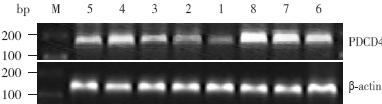 |
图 2 RT-PCR 检测SK-NEP-1 细胞中PDCD4 mRNA 表达 M:Marker;1: 对照组;2: 苦参碱0.5 mg/mL 组; 3:苦参碱1.0 mg/mL 组;4:苦参碱1.5 mg/mL 组;5:顺铂组; 6:苦参碱0.5 mg/mL+ 顺铂组;7:苦参碱1.0 mg/mL+ 顺铂组; 8:苦参碱1.5 mg/mL+ 顺铂组。 |
苦参碱化学名为苦参啶-15- 酮(Matddin-15- one),化学分子式为C15H24N20,是中药苦参的主 要活性成分之一,在体内外对多种肿瘤细胞有抑制 及杀伤作用,包括抑制肿瘤细胞增殖及诱导凋亡, 可逆转多药耐药,且有明显的量效和时效关系[7]。 虽然化疗仍是目前治疗肿瘤的主要手段之一,但传 统化疗药物毒副作用大,以及肿瘤的多药耐药,高 侵袭和转移的特征,是目前化疗成功的障碍。苦参 碱这种新型高效低毒抗肿瘤中药,对体外肿瘤细胞 除抑制及杀伤,诱导细胞分化与凋亡,抑制肿瘤转 移,调节肿瘤细胞宿主免疫等作用外[8],还能逆转 多药耐药,提高传统化疗药物敏感性,使临床抗肿 瘤治疗取得更好的疗效[9]。 但苦参碱联合顺铂抗 SK-NEP-1 细胞作用鲜有报道。
细胞增殖和凋亡是细胞生物学行为的两个 重要方面,两者间动态平衡是维持机体稳态的一 个重要方式,苦参碱调节肿瘤细胞中某些基因表 达水平可能是其抗肿瘤机制之一。有研究报道, MYCN 基因,为MYC 原癌基因家族成员之一,具 有很强致癌潜能[10],神经母细胞瘤LA-N-5 细胞高 表达MYCN 基因mRNA,苦参碱作用体外培养的 LA-N-5 细胞,抑制MYCN 基因mRNA,从而有效 抑制该细胞增殖,实现其抗肿瘤作用[4]。抑癌基因 也称为抗癌基因,在被激活情况下它们具有抑制 细胞增殖作用,但在一定情况下被抑制或丢失后 可减弱甚至消除抑癌作用的基因。肾母细胞瘤中 PDCD4 mRNA 及蛋白与癌旁正常对照组织相比明 显下调。肿瘤恶性程度越高,瘤组织中PDCD4 蛋 白表达下调越明显,PDCD4 mRNA 和蛋白可作为 评价肾母细胞瘤生物学行为的参考指标[11, 12]。
本研究显示,相对于对照组,苦参碱在一定 浓度范围(0.5~1.5 mg/mL)内能抑制SK-NEP-1 细 胞的增殖并诱导凋亡,具有剂量依赖性。因顺铂 毒副作用大,且易耐药。本研究通过不同浓度苦 参碱与固定浓度顺铂联合用药,发现随着苦参碱 浓度的增加,联合作用组抑制SK-NEP-1 细胞增殖 越明显。联合作用组存活率低于苦参碱、顺铂单 药组,而凋亡率增高。各实验组SK-NEP-1 细胞 的存活率均低于对照组,苦参碱组随药物浓度增 加,存活率逐渐降低,联合0.5 μg/mL 顺铂共同作 用SK-NEP-1 细胞后,与相同浓度单药苦参碱组及 顺铂组比较,存活率均明显降低。各实验组SKNEP- 1 细胞的凋亡率均高于对照组,苦参碱组随 药物浓度增加,凋亡率逐渐增高,联合0.5 μg/mL 顺铂共同作用SK-NEP-1 细胞后,与相同浓度单 药苦参碱组及顺铂组比较,凋亡率均明显增高。 说明苦参碱与顺铂有协同作用,能提高顺铂的化 疗敏感性。同时本研究发现随着苦参碱浓度的增 加,PDCD4 mRNA 的表达逐渐增高。与苦参碱、 顺铂单药组相比,联合作用组能明显提高PDCD4 mRNA 的表达,提示苦参碱联合顺铂可能通过提 高SK-NEP-1 细胞PDCD4 mRNA 的表达来发挥协 同作用,抑制细胞增殖诱导凋亡,提高苦参碱对 顺铂化疗敏感性,起到抗肿瘤作用。
综上,本研究证实苦参碱与顺铂联合应用, 通过上调PDCD4 mRNA 的表达,来抑制SK-NEP-1 细胞增殖,诱导凋亡。这可能为进一步研究苦参 碱通过其他途径与顺铂发挥协同抗肿瘤作用,奠 定了基础。
| [1] | Simon T, Langle A, Harnischmacher U, et al. Topotecan, cyclophosphamide, and etoposide (TCE) in the treatment of highrisk neuroblastoma. Results of a phase-Ⅱ trial[J]. J Cancer Res Clin Oncol, 2007, 133(9): 653-661. |
| [2] | Santana VM, Furman WL, Billups CA, et al. Improved response in high-risk neuroblastoma with protracted topotecan administration using apharmacokinetically guided dosing approach[J]. J Clin Oncol, 2005, 23(18): 4039-4047. |
| [3] | Brisse HJ, McCarvile MB, Granata C, et al. Guidelines for imaging and staging of neuroblastic tumors: consensus report from the International Neuroblastoma Risk Group Project[J]. Radiology, 2011, 261(1): 243-257. |
| [4] | Mueller S, Matthay KK. Neuroblastoma: biology and staging [J]. Curr Oncol Rep, 2009, 11(6): 431-438. |
| [5] | Berthold F, Hero B, Kremens B, et al. Long-term results and risk profiles of patients in five consecutive trials(1979-1997) with stage 4 neuroblastoma over 1 year of age[J]. Cancer Lett, 2003, 197(1-2): 11-17. |
| [6] | Broeur GM, Pritchard J, Berthold F, et al. Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment [J]. J Clin Oncol, 1993, 11(8): 1466-1477. |
| [7] | Kushner BH, Kramer K, Modak S, et al. Differential impact of high-dose cyclophosphamide, topotecan, and vincristine in clinical subsets of patients with chemoresistant neuroblastoma[J]. Cancer, 2010, 116(12): 3054-3060. |
| [8] | NCI. CTCAE[EB/OL].[May 17, 2010]. http://evs.nci.nih.gov/ftp1/ CTCAE/About. Html. |
| [9] | 雷琦, 唐锁勤, 王天有. 拓扑替康对HPB-AM 细胞MAGE 基因表达的影 响[J]. 中国当代儿科杂志, 2009, 11(8): 679-682. |
| [10] | Kaufmann SH, Peereboom D, Buckwalter CA, et al. Cytotoxic effects of topotecan combined with various anticancer agents in human cancer cell lines [J]. J Natl Cancer Inst, 1996, 88(11): 734-741. |
| [11] | Carol H, Houghton PJ, Morton CL, et al. Initial testing of topotecan by the pediatric preclinical testing program[J]. Pediatr Blood Cancer, 2010, 54(5): 707-715. |
| [12] | Kretschmar CS, Kletzel M, Murray K, et al. Response to paclitaxel, topotecan, and topotecan-cyclophosphamide in children with untreated disseminated neuroblastoma treated in an upfront phase Ⅱ investigational window: a pediatric oncology group study[J]. J Clin Oncol, 2004, 22(20): 4119-4126. |
| [13] | Simon T, Langler A, Berthold F, et al. Topotecan and etoposide in the treatment of relapsed high-risk neuroblastoma: results of a phase 2 trial[J]. J Pediatr Hematol Oncol, 2007, 29(2): 101- 106. |
| [14] | London WB, Frantz CN, Campbell LA, et al. Phase Ⅱ randomized comparison of topotecan plus cyclophosphamide versus topotecan alone in children with recurrent or refractory neuroblastoma: a Children's Oncology Group study [J]. J Clin Oncol, 2010, 28(24): 3808-3815. |
| [15] | De Ioris MA, Castellano A, Ⅱari I, et al. Short topotecan- based induction regimen in newly diagnosed high-risk neuroblastoma[J]. Eur J Cancer, 2011, 47(4): 572-578. |
| [16] | Thompsn J, George EO, Poquette CA, et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts[J]. Clin Cancer Res, 1999, 5(11): 3617-3631. |
| [17] | 朱琪琦, 刘英, 冯晨, 等. 神经母细胞瘤远期复发临床研究[J]. 中国当代儿科杂志, 2010, 12(12): 995-997. |
| [18] | Maris JM. Recent advances in neuroblastoma[J]. N Engl J Med, 2010, 363(23): 2202-2211. |
 2014, Vol. 16
2014, Vol. 16