儿童恶性实体瘤(malignant solid tumor) 具 有潜伏期短、生长迅速、转移广泛等特点,已成 为致儿童死亡的第二位原因,严重威胁儿童的生 命健康[1]。近年来,虽然将化疗、手术、放疗等 手段引入到儿童恶性实体瘤的治疗中提高了一定 的临床缓解率,但晚期患儿临床缓解率仍较低, 病死率居高不下[2]。有文献显示,强化疗结合自 体外周血干细胞移植(autologous peripheral blood stem cell transplantation,APBSCT) 可提高恶性实 体瘤肿瘤的缓解率[3, 4]。但国内相关研究表明, APBSCT 对晚期恶性实体瘤尤其是神经母细胞瘤 (nueroblastoma,NB)、原始神经外胚叶肿瘤(primitive neuroectodermal tumors,PNET)的疗效较国外仍有 一定的差距[5]。本文总结我院2005 年9 月至2011 年11 月收治的行APBCST 治疗的晚期恶性实体瘤 38 例临床诊疗经验,现报道如下。
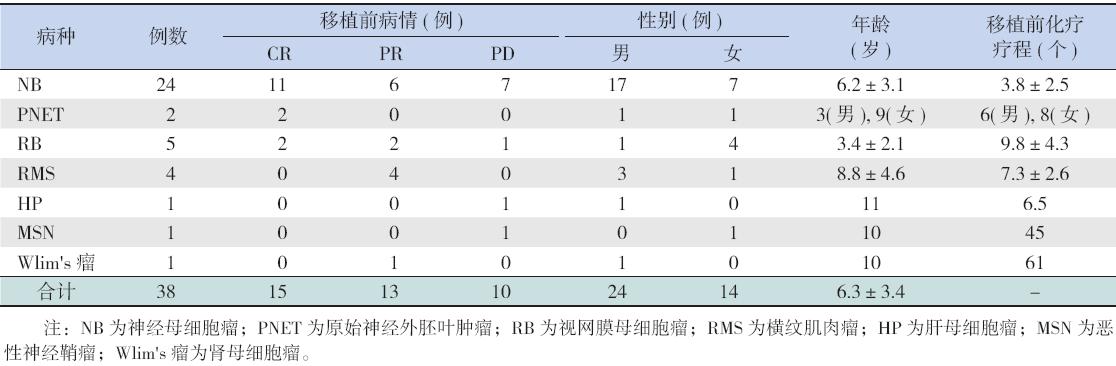
我院2005 年9 月至2011 年11 月行APBSCT 治疗的恶性实体瘤患儿38例,其中男24例,女14例, 平均年龄6.3±3.4 岁(范围1 岁1 个月至14 岁)。 38 例病例中包括IV 期NB 24 例,III 期头颈部RMS 4 例,晚期视网膜母细胞瘤(retinoblastoma,RB)5 例(2 例移植前眼球摘除,3 例带瘤移植),IV 期 进展肝母细胞瘤(hepatoblastoma,HP)1 例,IV 期 肾母细胞瘤(Wlim's 瘤)1 例,IV 期恶性神经鞘瘤 (malignant neurilemoma,MSN)1 例,PNET 2 例。 38 例患儿术前化疗6~61 个周期,各病种患儿移 植前平均化疗周期见表1。移植前病情按完全缓解 (CR)、部分缓解(PR)、病情进展(PD)分类, 各病种患儿移植前病情见表1。
| 表 1 38 例患儿临床资料 |
根据国际儿童恶性实体瘤协作组治疗原则[6] 采用手术、化疗、放疗以及APBSCT 治疗。本研 究中38 例患儿均给病理学检查确诊为恶性实体瘤, 且根据国际儿童实体瘤临床分期标准[7],临床分期 均为晚期(III 及IV 期),根据病情及病种选择预 处理方案化疗结合APBSCT 治疗。
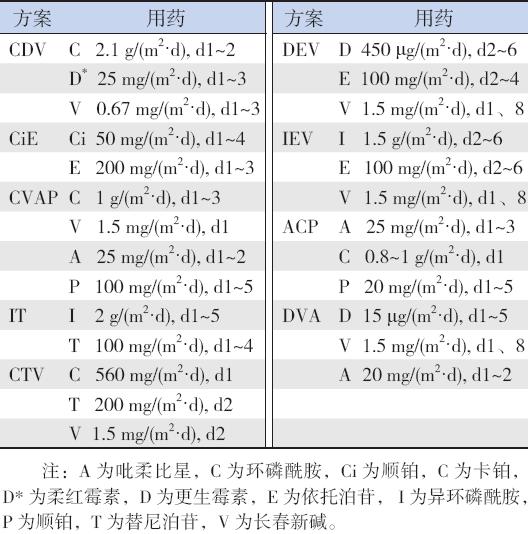
38 例患儿 均采用化疗结合重组人粒细胞集落刺激因子(rhGCSF) 作为动员剂。38例患儿动员方案及剂量见表2。 24 例NB 患儿中,17 例应用CDV 方案,3 例CiE 方案,3 例CVAP 方案,1 例IT 方案;5 例RB 患 儿均应用CTV 方案;4 例RMS 患儿中,1 例应用 DEV 方案,3 例IEV 方案;2 例PNET 及1 例MSN 患儿均应用CDV 方案;1 例HP 应用ACP 方案;1 例Wlim's 瘤应用DVA 方案。
| 表 2 38 例患儿外周血干细胞动员方案 |
当外周血WBC 计数降至≤ 2×109/L 时,开始 每天皮下注射rhG-CSF 至APBSC 采集结束前1 d。 rhG-CSF 给药剂量为每日5 μg/kg。当WBC 计数 恢复至5×109/L 以上时开始应用CS-3000-plus 血 细胞分离机采集APBSC。采集连日进行,每天上 午采集,当采集的单个核细胞(MNC)累计达到 5×108/kg 或/ 和CD34+ 细胞3×106/kg 以上时,即 达到采集标准时结束采集。采集的外周血于-196℃ 冻存,需用时取出立即置39℃水浴中迅速解冻, 经静脉快速回输。
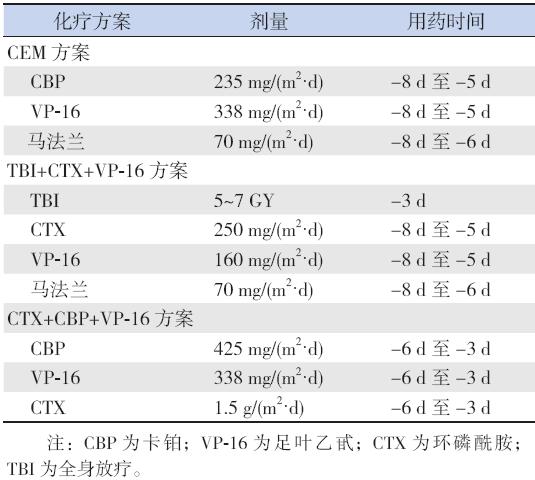
NB、PNET、RMS、HP、 MSN、Wlim's 瘤患儿共33 例预处理化疗均采用 CEM 方案[8],其中2 例进展期NB 采用全身放疗 (TBI)+ 环磷酰胺(CTX)+ 足叶乙甙(VP-16) 预处理;5 例RB 患儿预处理方案采用CTX+ 卡铂 (CBP)+VP-16 方案[9](表3)。预处理同时常规 应用还原型谷光甘肽、复合辅酶及果糖二磷酸钠、 奥美拉唑等护肝、营养心肌及保护胃肠黏膜。
| 表 3 38 例患儿预处理方案 |
骨髓空置标准为:WBC 计数(0~0.03)×109/L。 造血功能重建标准为:中性粒细胞绝对值(NEU) ≥ 0.5×109/L,PLT ≥ 20×109/L。
采用SPSS 17.0 统计软件进行统计学分析。计 量资料以均数± 标准差(x±s)表示,组间比较 采用t 检验;计数资料用例数表示,组间比较采 用卡方检验;采用Kaplan-Meier 法计算生存率。 P<0.05 表示差异有统计学意义。
38 例患儿中所采集的MNC 数平均(5.8±2.5) ×108/kg;CD34+ 数量平均(3.4±3.0)×106/kg。 干细胞计数符合移植要求31 例(82%),7 例进 展期患儿干细胞计数不达标。
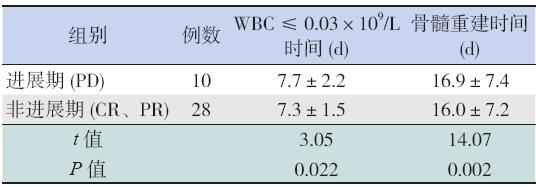
38 例患儿中,除1 例进展期NB 回输后+3 d 因多脏器功能衰竭死亡外,37 例均获得骨髓重 建,平均重建时间为16.8±7.5 d(11~37 d)。移 植前病情不同患儿间骨髓重建时间比较差异有统 计学意义(t=14.07,P=0.002),见表4。另外, CD34+ 计数与骨髓重建时间呈负相关(rs=-0.634, P=0.001)。
预处理及干细胞回输后WBC 计数 ≤ 0.03×109/L 持续时间(骨髓空置时间):移 植前为PD 者7.7±2.2 d; 移植前为CR 或PR 者 7.3±1.5 d。移植前病情不同患儿间WBC 缺乏持续 时间比较差异有统计学意义(t=3.05,P=0.022), 见表4。相关性分析显示外周血WBC 计数与骨髓 重建时间呈负相关(rs=-0.967,P=0.015)。
| 表 4 移植前进展期与非进展期患儿间骨髓重建时间及 WBC 缺乏持续时间的比较 (x±s) |
35 例患儿获完整随访(3 例于干细胞回输后 +30 d 内死亡),随访中位时间57 个月(11~96 个月) 时,总生存率为34%(12/35),见表5,其中1 年生存率66%,2 年生存率40%(14/35)。总生 存率95% 可信区间为38.96~70.83 个月。以干细胞 回输日(0 d)为观察起点,中位观察时间为13 个 月,Kaplan-Meier 分析提示5 年预计生存率为23% (图1)。
| 表 5 38 例儿患儿预后 |
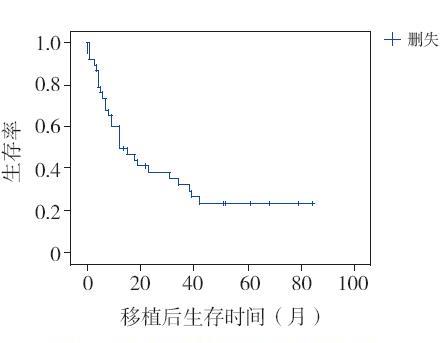 |
图 1 38 例患儿移植后生存分析 |
24 例IV 期NB 平均MNC 为(5.4±2.7)× 108/kg, 平均CD34+ 计数(3.3±2.2)×106/kg, 采集成功率达到100%。移植后随访中位时间为 57 个月,死亡19 例,存活5 例,中位生存时间 为30.8 个月,1 年生存率为64%,3 年生存率为 43%, 总生存率达到25%(6/24)。Kaplan-Meier生存曲线分析5 年预计生存率为12.4% 左右。24 例NB 与本研究其余13 例恶性肿瘤患儿(除1 例 回输后死亡未获骨髓重建)Kaplan-Meier 生存曲线 分析提示,NB 患儿移植后预后较其他晚期恶性实 体瘤儿童差,见图2。
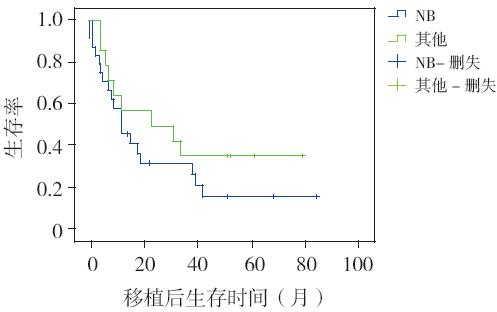 |
图 2 24 例NB 患儿与其他13 例恶性实体瘤患 儿生存分析对比 |
5 例患儿移植后骨髓重建时间为18.6±2.2 d (16~22 d)。1 例移植前广泛脑膜转移患儿(男, 6 岁)+30 d 复查头颅MRI 达到CR,但该患儿于 +90 d 复发后死亡,移植后生存时间为9 个月。 1 例(男,2 岁)眶尖侵犯常规治疗后达到PR 患 儿移植后12 个月复发,移植后总生存时间20 个月。 余3 例平均随访24.7 月(分别为15、24、35 个月) 达到CR,无瘤存活。
儿童恶性实体瘤起病隐匿,发病年龄小、病 因不明、进展快以及预后差是其主要特点。近年 来,由于化疗、放疗、手术治疗等治疗方式的应用, 部分恶性实体瘤(如淋巴瘤)的临床缓解率有了 较大提高。同时,恶性程度较高的NB、PNET 等 仍预后较差,尤其是晚期以及进展期病例预后更 差[11]。目前对于晚期恶性实体瘤达成的共识是: (1)手术、化疗以及放疗多学科治疗;(2)APBSC 治疗可改善预后[12]。但干细胞采集、预处理方案 的确定是决定APBSCT 能否顺利回输以及能否骨 髓重建的关键因素[13] 。本研究除RB 病例外选择 CEM 方案进行预处理治疗,除1 例进展期NB 于 +3 d 死亡外,余病例均获得骨髓重建,平均骨髓 重建时间16.8±7.5 d(11~37 d)。NB 患儿中位 骨髓重建时间 14 d,PNET 13.5 d,RMS 12 d,HP 26 d,肾母细胞瘤14 d,恶性神经鞘瘤11 d。同时 经预处理后白细胞计数最低达到0~0.03×109/L。 CEM 方案作为预处理方案应用于APBSCT 的治疗 即可达到使骨髓空置,同时给予粒细胞集落刺激 因子后均可获得骨髓重建,说明CEM 方案作为预 处理方案安全有效。另外,回输的CD34+ 数量与 骨髓重建时间呈负相关。采集的CD34 计数高将有 助于干细胞回输后的骨髓重建,说明CD34 计数是 决定骨髓重建的关键因素,与文献报道一致[14]。 因此,干细胞动员、采集对于是否可以顺利完成 APBSCT 治疗具有重要的临床意义。本研究中38 例患儿采集CD34 计数为(3.4±3.0)×106/kg, MNC 计数(5.8±2.4)×108/kg,因此,预行预处 理方案化疗结合APBSCT 治疗儿童晚期恶性实体 瘤,CD34 计数≥ 3.0×106/kg 有利于骨髓造血重建。
本研究应用预处理方案化疗结合APBSCT 治 疗进行疗效分析、随访, 病种涉及NB、HP、 PNET、RMS、RB 以及MSN 等。通过临床分析, 晚期NB 尤其进展期NB 以及PNET 经移植后病死 率仍较高,2 例PNET 结局均为复发后死亡,24 例 NB 也仅6 例存活。虽然本组病例中NB 移植后病 死率仍较高,但中位生存时间可达到30.8 个月, 说明对于晚期NB 尤其是进展期NB 预处理方案化 疗结合APBSCT 在延长生存期、改善生活质量具 有一定应用价值。本研究NB 经预处理方案化疗结 合APBSCT 治疗5 年生存率仅为12.4% 左右,与 国外文献报道有一定差距,可能与收集病例尚少, 且有7 例为进展期病例行移植治疗有关。国外研 究者报道,APBSCT 主要应用于缓解期NB 病例[15], 但本研究1 年及3 年生存率分析显示预处理化疗 结合APBSCT 治疗可提高进展期NB 的临床缓解率。
本组病例中1 例IV 期进展期HP 患儿行预处 理方案化疗结合APBSCT 取得了一定的疗效,移 植后原发病灶及转移灶明显好转,移植后生存期 达到9 个月。虽然本病例不符合预处理方案化疗 结合APBSCT 治疗的指征且未能最终改变预后, 但却在一定程度上缓解了病情。因此,APBSCT 对于晚期HP 的治疗具有一定的借鉴。对于经手 术、化疗后达到CR 或PR 的患儿行预处理方案 化疗结合APBSCT 可能是提高临床疗效及预后的 有效的方法之一。另外,本研究中3 例晚期RMS 患儿进行APBSCT,2 例达到长期无瘤存活,1 例 复发、转移后移植后生存期达到15 个月;5 例 RB 行APBSCT 后均达到缓解;1 例反复复发难 治性Wilm's 瘤经移植后无瘤存活近6 年。文献报 道伴有远处组织器官转移且复发说明预处理方案 化疗结合APBSCT 对于晚期难治性头颈部RMS、 RB 以及Wilm's 瘤均具有积极的临床意义[16, 17, 18]。 另外,对于晚期MSN 患儿行预处理方案化疗结合 APBSCT 治疗国内外报道较少,本组病例中1 例进 展期患儿行APBSCT 治疗后移植后生存期仅为4 个月。研究表明,进展期恶性髓细胞瘤预后极差, 预处理方案化疗结合APBSCT 疗效不显著。恶性 髓细胞瘤来源神经组织,原发部位常以后腹膜首 发,早期即可发生骨髓转移、肺转移,预后较差。 该病对化疗敏感,但一旦伴有远处组织器官转移 病死率较高。
综合本研究病例的临床资料发现,虽然经 APBSCT 后晚期恶性实体瘤预后仍较差(随访中位 时间57 个月总生存率为34%),但1 年生存率可 达到66%,2 年生存率40%。因此,预处理方案化 疗结合APBSCT 仍具有应用价值。虽国外文献报 道缓解期患儿为移植适应症,但本研究表明,进 展期患儿行移植治疗在延长生存期以及提高生活 质量方面也具有积极意义,为进展期儿童恶性实 体瘤的治疗提供了一定的临床思路。
| [1] | 史学, 田莉, 祝秀丹, 等. 中药联合化疗对146 例实体瘤患儿 生活质量的影响[J]. 中国结合医学杂志, 2011, 17(1): 31-34. |
| [2] | 诸福棠, 胡亚美, 江载芳. 实用儿科学[M]. 第7 版. 北京:人 民卫生出版社, 2002: 2184. |
| [3] | 高解春, 王耀平. 现代小儿肿瘤学[M]. 上海: 复旦大学出版社, 2006: 16. |
| [4] | Pui CH. Recent research advances in childhood acute lymphoblastic leukemia[J]. J Formos Med Assoc, 2010, 109(11): 777-787. |
| [5] | Li Y, Huang S, Wang X, et al. Rituximab combined with autologous peripheral blood stem cell transplantation improve therapeutic effects of chemotherapy in pediatric patients with Burkitt's lymphoma[J]. J Trop Pediatr, 2010, 56(5): 337-341. |
| [6] | 董蒨, 金先庆, 高解春. 小儿肿瘤外科学[M]. 北京: 人民卫生 出版社, 2009: 106-113. |
| [7] | Dallorso S, Manzitti C, Morreale G, et al. High dose thrapy and autologous hematopoietic stem cell transplantation in poor risk solid tumors of childhood[J]. Haematologica, 2000, 85(11 Suppl): 66-70. |
| [8] | Raquel V, Begona S, Fernando BA, et al. Tuberculosis in pediatric solid organ and hematopoietic stem cell transplant percipients[J]. Pediatr Infect Disease J, 2012, 31(7): 774-777. |
| [9] | Franca F, Eleonora B, Luana M, et al. High-dose thiotepa and etoposide in Children with poor-prognosis brain tumors[J]. Cancer, 2004, 100(10): 2215-2221. |
| [10] | Balwierz W, Wieczorek A, Klekawka T, et al. Treatment results of children with neuroblastoma: report of Polish Pediatric Solid Tumor Group[J]. Przegl Lek, 2010, 67(6): 387-392. |
| [11] | 施诚仁. 小儿实体肿瘤的外科治疗[J]. 儿童肿瘤, 2007, 6(2): 4-5. |
| [12] | Kwon SY, Won SC, Han JW, et al. Feasibility of sequential high-dose chemotherapy in advanced pediatric solid tumors[J]. Pediatr Hematol Oncol, 2010, 27(1): 1-12. |
| [13] | Malik PS, Bakhshi S. Renal impairment due to white-cell lysis after G-CSF and chemotherapy during pediatric autologous stem cell transplantation[J]. J Pediatr Hematol Oncol, 2010, 32(5): 416-417. |
| [14] | Sari T, Yuksel MK, Topcuoglu P, et al. The effect of CD34 count and clonogenic potential of hematopoietic stem cells on engraftment[J]. Transfus Apher Sci, 2010, 43(3): 315-320. |
| [15] | Matthay KK, Reynolds CP, Seeger RC, et al. Treatment of high-risk neuroblastoma with intensive chemptherapy, radiotherapy. Autologous bone marrow transplantation, and 13-cis-retinoic acid. Children's Cancer Group[J]. N EnglJ Med, 1999, 341(16): 1165-1173. |
| [16] | Zhu HH, Xu KL, Huang YH, et al. Observation of clinical effect of MA or MOED regimen combined with hematopoietic growth factor on mobilization of autologous peripheral blood stem cells[J]. Leukemia Lymphoma, 2002, 11(9): 349-352. |
| [17] | Tsuruta T, Aihara Y, Kanno H, et al. High-dose chemotherapy followed by autologous and allogeneic peripheral blood stem cell transplantation for recurrent disseminated trilateral retinoblastoma[J]. Child Nerv Syst, 2011, 27(6): 1019-1024. |
| [18] | Angela P, Theodore BM, Pamela K. Efficacy of high-dose chemotherapy and atuologous stem cell transplant for recurrent Wilm's tumor: a Meta-analysis[J]. J Pediatr Hematol Oncol, 2010, 32 (6): 454-461. |
 2014, Vol. 16
2014, Vol. 16

 , ZHANG Wei-Ling, HUANG Dong-Sheng, WANG Yi-Zhuo,HONG Liang,ZHU Xia,LIU Ai-Ping,ZHI Tian,HU hui-Ming
, ZHANG Wei-Ling, HUANG Dong-Sheng, WANG Yi-Zhuo,HONG Liang,ZHU Xia,LIU Ai-Ping,ZHI Tian,HU hui-Ming