热带病毒整合位点(ecotropic viral integration site,EVI1)基因定位于染色体3q26,编码一个相 对分子质量14.5 万道尔顿的锌指转录因子,此转 录因子是一个位点特异的DNA 结合蛋白,定位于 核,参与RNA 的转录调节。 EVI1 基因主要控制 胚胎的发育,对造血干细胞的增殖和存活起重要 作用[1]。在白血病的发病中,EVI1 也是一个重要 的转录因子[2]。文献报道10% 的髓细胞性白血病 可检测到EVI1 基因高表达,并且是预后不良的独 立因子[3]。虽然目前有关EVI1 预后价值的文献报 道不少,但少有报道EVI1 阳性的急性髓细胞性白 血病(AML)患者的临床特征究竟如何。因此, 本文将对我院初诊的241 例AML 患儿EVI1 的表 达及其免疫表型进行检测,同时监测微小残留白 血病(minimal residual disease,MRD), 并收集 EVI1 阳性患儿的临床资料以分析其临床特征。现 报道如下。
选取2009 年1 月至2013 年8 月于华中科技 大学同济医学院附属协和医院儿科血液病病区初 诊的AML 患儿241 例为研究对象,其中男114 例, 女127 例,中位年龄6.4 岁(0.4~13 岁),所有病 例均经骨髓细胞学和免疫分型检测,符合国际通 用FAB 诊断标准[4],且均未接受过化疗。同时选 取10 例非恶性疾病(缺铁性贫血等)患者作为对 照组,其中男6 例,女4 例,中位年龄8.2 岁(0.8~ 10 岁)。随访时间截止至2013 年8 月30 日,中 位随访时间为36 个月(1~50 个月)。
收集所有AML 患儿的临床资料,包括初诊外 周血白细胞计数、血红蛋白含量、血小板计数。 所有患儿根据儿童急性髓细胞性白血病诊疗建议 武汉协作组AML09 方案给予治疗。诱导治疗为 DA 方案(柔红霉素+ 阿糖胞苷)或DAE 方案(柔 红霉素+ 阿糖胞苷+ 依托泊甙)。M3 型患儿除外。
治疗前取肝素抗凝的骨髓液2 mL,分离单 个核细胞,提取RNA。采用RT-PCR 法检测包括 EVI1 基因在内的29 种融合基因[5]。 对初诊已确定EVI1 表达阳性的患儿,在以后 骨穿同时采集骨髓液标本2 mL 用于实时荧光定量 聚合酶链反应法(RQ-PCR,ABL 作为内参)测定 EVI1 的表达量[6]。EVI1 的表达量=2-δδCt,其中 δδCt=δCt 患者-δCt 正常人,δCt 正常人=Ct 正常人EVI1- Ct 正常人ABL,δCt 患者=Ct 患者EVI1-Ct 患者ABL;当2-δδCt ≤ 8 时,该患者EVI1 为阴性;当8 ≤ 2-δδCt ≤ 32 时,该患者EVI1 为阳性低表达;当2-δδCt ≥ 32 时, 该患者EVI1 为阳性高表达。
采用流式细胞术分析骨髓细胞的免疫表型。 向流式专用管中加入EDTA 抗凝的骨髓及4 色直 接标记荧光抗体。所用单克隆抗体包括草履虫叶 绿素蛋白(Percp)标记的CD45 和异硫氰酸荧光 素(FITC)、藻红蛋白(PE)或别藻青蛋白(APC) 标记的CD2、CD3、CD4、CD5、CD7、CD8、 CD10、CD11b、CD13、CD14、CD15、CD19、 CD20、CD22、CD33、CD34、CD38、CD56、 CD64、CD71、CD117、CD123、MPO、cCD79a、 HLA-DR、cCD3 和胞膜或胞内同型对照IgG 等, 均购自美国BD 公司。采用FACS CaliburTM 流式 细胞仪( 美国BD 公司)CellQuest 和PAINT-AGATE 软件获取并分析10 000 个细胞/ 管,通过 CD45/SSC 设门,分析计算各型白血病相关抗原的 阳性率。以幼稚细胞表面抗原≥ 20% 为阳性。采 用多参数流式细胞术(MFC)[7] 监测MRD,结果 判断以MRD<10-4 为阴性。
采集骨髓细胞标本,24 h 短期培养后制片, 收集有丝分裂中期细胞,热变性姬姆萨R 显带, 应用LeicaQ500 染色体自动分析仪,染色体核型分 析根据《人类细胞遗传学国际命名体制(ISCN) 1995》描述核型。
疗效标准参照文献[8]。治疗满2 周的患儿统 计缓解率,完全缓解(CR)定义为:临床无贫血、 出血等白血病细胞浸润的症状和体征;骨髓原始 幼稚细胞<5%,外周血未见幼稚细胞;外周血中 性粒细胞绝对值≥ 1.5×109/L,血红蛋白≥ 90 g/L, 血小板≥ 100×109/L。
采用SPSS 19.0 统计软件对数据进行统计学分 析,计量资料以均数± 标准差(x±s)表示,两 样本均数间的比较采用t 检验;计数资料以率(%) 表示,组间比较采用χ2 检验,当理论频数<1 时采 用Fisher 确切概率法。P<0.05 为差异有统计学意义。
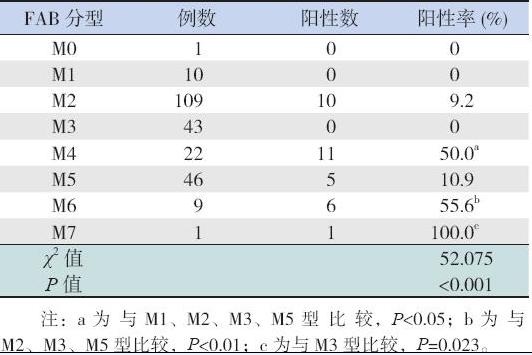
241 例AML 患儿中,33 例(13.7%)EVI1 基 因表达阳性,包括男10 例(30%),女23 例(70%); 其中 M2 型10 例,M4 型11 例,M5 型5 例,M6 型6 例,M7 型1 例; M0、M1、M3 型均无EVI1 基因阳性表达。10 例对照组均无EVI1 阳性表达。 AML 患儿各亚型的EVI1 基因阳性表达率差异有统 计学意义,见表1。
| 表 1EVI1 基因在不同分型AML 患儿中的表达 |
33 例EVI1 表达阳性的AML 患儿初诊时肝肿 大25 例(76%),脾肿大20 例(61%),淋巴结 肿大20 例(61%),肝功能异常7 例(21%), 凝血功能异常15 例(45%)。
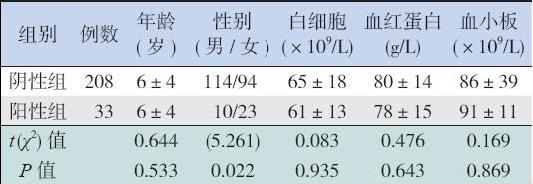
EVI1 表达阳性与阴性的AML 患儿相比,初诊 年龄、外周血白细胞计数、血红蛋白含量及血小板 计数差异均无统计学意义(均P>0.05),但EVI1 表达阳性组女性患儿比例增加(P<0.05),见表2。
| 表 2EVI1 表达阳性AML 患儿的临床特征 (x±s,例) |
截止随访日期,33 例初诊EVI1 基因表达阳 性患儿中, 15 例转阴(45%),转阴时间为1.5~ 19 个月。2 例确诊后放弃,31 例患儿进行了诱导 缓解治疗,诱导缓解治疗结束后31 例患儿EVI1 基因的中位表达值为12.05( 范围0~24.05)。 EVI1 表达改变与临床缓解不同步,部分患儿EVI1 转阴时间滞后于临床缓解,如:3 名患者第1 疗程 诱导后达CR,但EVI1 仍表达阳性,后期随访时 复查EVI1 转阴;1 名患者第2 疗程诱导后达CR, 但EVI1 始终阳性;1 名患者第2 疗程诱导后达 CR,但4 个月后EVI1 才转阴。还有部分患儿临床 未缓解,但EVI1 已转阴,如:1 名患者第1 疗程 诱导后即达CR,但4 个月后复发时检测EVI1 表 达呈阴性;2 名患者在第1、2 疗程诱导后均未达 CR,但在第1 疗程结束时,EVI1 表达已呈阴性。
33 例EVI1 表达阳性的AML 患儿中,12 例患 儿用MFC 法监测MRD。5 例患儿MRD 与EVI1 基 因表达同步转阴;2 例患儿MRD 转阴后,EVI1 基 因表达仍呈阳性,分别于1 个月和9 个月后EVI1 才转阴;5 例患儿监测MRD 呈阳性,其中4 例 EVI1 基因表达呈阳性,1 例EVI1 基因检测已转阴。
EVI1 常与其他融合基因共表达。33 例EVI1 表达阳性的AML 患儿中,有13 例(39%)共表 达其它融合基因。如dupMLL、AML1-ETO、MLLAF9 、AML1、MDS1、MLL/AF10。
33 例EVI1 表达阳性的AML 患儿高表达 CD33(100%)、CD38(88%)、HLADR(76%), 其次CD13(73%)、CD117(73%)、CD123(67%)、 CD64(64%)、MPO(61%)、CD11b(58%)、 CD15(55%)也有不同程度地表达。
33 例EVI1 表达阳性的AML 患儿中,30 例患 儿进行了染色体检查。15 例染色体核型分析正常 (50%);15 例患者发现染色体结构或数目异常 (50%),其中3 例患者有3q 位点异常,2 例患 者存在7 号染色单体,5 例患者存在11 号染色体 重排,见表3。
| 表 3EVI1 阳性AML 患儿的异常染色体 |
33 例EVI1 表达阳性的AML 患儿中,2 例确 诊后放弃治疗,31 例患儿进行了诱导缓解治疗, 1 个疗程后, 7 例达CR,2 例死亡,CR 率为23% (7/31);随后29 例完成第1 疗程诱导治疗的患 儿中,又有3 例放弃治疗,26 例进入第2 疗程化 疗,疗程结束后新增6 例达CR,2 例死亡,CR 率 为23%(6/26)。208 例EVI1 表达阴性的AML 患 儿中,23 例确诊后放弃治疗,1 个疗程后,118 例达CR,CR 率为64%(118/185), 明显高于 EVI1 表达阳性患儿第1 疗程CR 率(χ2=19.035,P<0.001);随后185 例完成第1 疗程诱导治疗 的患儿中,又有15 例放弃治疗,170 例进入第2 疗程化疗,疗程结束后新增26 例达CR,CR 率 为15%(26/170), 与EVI1 表达阳性患儿第2 疗程CR 率比较差异无统计学意义(χ2=0.399, P=0.528)。2 个疗程EVI1 阳性患者的总CR 率 42%(13/31),明显低于EVI1 阴性患者的总CR 率(78%,144/185) (χ2=17.238,P<0.01)。
尽管EVI1 基因早在1988 年就已经被发现[9], 然而目前人们对其本质了解并不多。EVI1 基因一 直作为一个髓系肿瘤的癌基因被研究,但阳性表 达的患者临床特征如何?其在髓系肿瘤发生中究 竟起什么作用?虽然有关EVI1 的报道很多,却并 没有解决这些问题。本研究拟通过对EVI1 阳性 AML 患儿的临床分析,对此进行初步探讨。
本资料中AML 患儿阳性表达率为13.7%,与 文献报道基本一致[3]。M2、M4、M5、M6、M7 亚 型均有EVI1 阳性表达,M0、M1、M3 型患儿未见 EVI1 基因阳性表达,而 Lugthart 等[3] 报道成人所 有AML 亚型均可见EVI1 阳性表达。Ho 等[10] 临床 试验发现几乎所有M7 患儿都有EVI1 高表达。是 否儿童患者有不同的表达谱,或者因为样本数较 少,还需进一步扩大样本数来明确。
EVI1 阳性与阴性的AML 患儿相比,初诊时 年龄、外周血白细胞计数、血红蛋白含量、血小 板计数等临床特征并无明显差异,但女性患儿比 例增加,其原因尚不明确。
在大多数情况下,白血病细胞学检测往往落 后于基因检测,即基因检测阳性时,细胞学检测 可能还是阴性。本研究结果提示: EVI1 表达改变 与临床缓解不同步。部分患儿EVI1 转阴滞后于临 床缓解,而部分患儿临床未缓解,EVI1 已转阴。 其原因尚未见文献报道。是否EVI1 的表达与AML 的进展不同步?考虑临床观察的结果,认为EVI1 基因检测暂不宜作为MRD 的指标。MFC 法监测 MRD 阴性时,EVI1 基因表达检测仍可呈阳性。 MFC 法监测MRD 阳性时,EVI1 基因也可转阴。 因为MFC 监测MRD 分析的是细胞表面或胞浆抗 原,MFC 监测MRD 阴性而PCR 法却检测EVI1 基 因表达阳性,提示部分EVI1 阳性的AML 细胞表 面或胞浆没有可检测到的抗原变化。Konantz 等[11] 研究发现在体外培养淋巴细胞性白血病细胞,阻 抑其EVI1 的表达并不能改变细胞表面抗原的表达。 因此,临床监测MRD 需结合流式细胞术和PCR 基因分析法。
EVI1 常与其它融合基因共表达,本研究结 果提示有39% 的患儿共表达其它融合基因。如 dupMLL、AML1-ETO、MLL-AF9、AML1、MDS1、 MLL/AF10。研究报道MLL 通过染色体重排或其它 不明机制可导致EVI1 转录活化,导致人类AML 发生。大约一半有11q23 重排的AML 患者有EVI1 高表达[12]。另外文献报道还有一些与EVI1 基因相 互作用的基因[13, 14, 15, 16],但其相互作用的机制仍不明确。
染色体分析发现15 例AML 患儿染色体核型 分析正常(50%),15 例有染色体结构或数目异 常(50%)。目前 3q26 重排是研究明确的可导致 EVI1 过表达的机制,如t(3;3)(q21;q26), inv(3), t(3;21)等[17, 18]。Ho 等[10] 的临床试 验报道儿童AML 没有检测到3q26 的重排。而其 它文献报道儿童AML 可检测到3q26 的重排[19] 。 本研究中3 例患儿有3q26 位点异常,3q 异常占染 色体异常的20%(3/15)。然而据报道9%~20% 没有3q 异常的AML 也有EVI1 过表达,并且与不 良预后相关[20]。7 号染色单体是导致EVI1 活化的 另一个因素[12]。本研究中2 例患者存在 7 号染色 单体13%(2/15)。另外正常核型也可有EVI1 高 表达,本研究中15 例染色体核型分析正常(50%)。 Vazquez 等[21] 研究发现EVI1 高表达的发生率在不 同的细胞遗传学组明显不同,且在高危AML 进展 中,有不同剪接形式的EVI1 高表达。因本研究样 本例数不多,没有进一步分组,但可以发现EVI1 阳性的AML 有各种形式的核型改变,也有正常核 型。是否核型与EVI1 阳性表达有相关性,还需大 样本的研究进一步明确。
EVI1 的预后价值也是一个有争论的问题。 Langabeer 等[22] 报道在AML 患者中,EVI1 表达异 常很常见,与预后无关。多数文献报道EVI1 异 常表达与不良预后相关[23, 24],EVI1 异常表达是预 后不良的独立因素[3],本研究证实EVI1 表达阳性 AML 患儿第1 疗程CR 率明显降低,近期预后差。 而目前尽管有很多文献报道EVI1 异常表达与不良 预后相关,但人们还不清楚其生物学本质,不像 一些已经明确的与预后相关的基因如BCR/ABL、 FLT3 有明确的致白血病机制,因此也还没有文献 报道将EVI1 基因作为一个危险分层的因子[25]。本 课题组还在进一步随访以评估远期预后,而对于 EVI1 阳性的患儿暂不考虑应用更强的化疗方案。
另外,为什么临床观察到EVI1 基因阳性的 AML 患儿近期预后差,而其基因表达改变却与临 床缓解并不同步呢?我们认为EVI1 基因具有广泛 的生物学作用,通过多种机制参与白血病的发生 发展,并调节信号通路,作用于下游的靶基因而 发挥致白血病作用。其中可能存在许多当前未知 基因的改变[26]。而且本研究中也观察到 EVI1 基因 和一些融合基因共表达,由此可见EVI1 基因的活 化在AML 的病程中不是孤立的,而是与其它基因 相互作用或染色体异常的结果,其活化机制及功 能还需进一步研究。文献报道在鼠模型上,EVI1 过表达可诱导骨髓异常增生综合征发生,但不进 展为AML,提示在进展为AML 中还需要其它基因 的协同作用[21]。鼠模型逆转录病毒插入突变提示 EVI1 在髓系白血病的发生中与其它基因有协同作 用[27]。因此,寻找与EVI1 基因相互作用的上游或 下游基因将是今后进一步研究的方向。
| [1] | Long J, Parkin B, Ouillette P, et al. Multiple distinct molecular mechanisms influence sensitivity and resistance to MDM2 inhibitors in adult acute myelogenous leukemia[J]. Blood, 2010, 116(1): 71-80. |
| [2] | Sung KW, Choi J, Hwang YK, et al. Overexpression of apollon, an antiapoptotic protein, is associated with poor prognosis in childhood de novo acute myeloid leukemia[J]. Clin Cancer Res, 2007, 13(17): 5109-5114. |
| [3] | 张伟, 戴碧涛, 汪明宇, 等. 川芎嗪对白血病细胞黏附运动 和侵袭的影响[J]. 重庆医科大学学报, 2008, 33(4): 403-406. |
| [4] | Srinivasula SM, Ashwell JD. IAPs: what's in a Name?[J]. Mol Cell, 2008, 30(2): 123-135. |
| [5] | Bartke T, Pohl C, Pvrowolakis G, et al. Dual role of BRUCE as an antiapoptotic IAP and a chemeric E2/E3 ubiquitin Ligase[J]. Mol Cell, 2004, 14(6): 801-811. |
| [6] | Smolewski P, Robak T. Inhibitors of apoptosis proteins (IAPs) as potential molecular targets for therapy of hematological malignancies[J]. Curr Mol Med, 2011, 11(8): 633-649. |
| [7] | Ismail EA, Mahmoud HM, Tawfik LM, et al. BIRC6/Apollon gene expression in childhood acute leukemia: impact on therapeutic response and prognosis[J]. Eur J Haematol, 2012, 88(2): 118-127. |
| [8] | 陈建发, 李宇华, 陈引香, 等. Apollon siRNA 提高肝癌细胞 化疗敏感性的实验研究[J]. 南方医科大学学报, 2011, 31(10): 1701-1704. |
| [9] | Amundson SA, Myers TG, Scudiero DS, et al. An informatics approach identifying markers of chemosensitivity in human cancer cell lines[J]. Cancer Res, 2000, 60(21): 6101-6110. |
| [10] | 杨岚, 杨平地, 梁蓉, 等. 川芎嗪联合环胞霉素A 逆转白血 病多药耐药的研究[J]. 癌症, 2000, 19(4): 304-306. |
| [11] | 李乃农, 陈元仲, 吕联皇, 等. 白血病细胞端粒酶活性的研 究[J]. 白血病淋巴瘤, 2002, 11(5): 21-28. |
| [12] | 吴涛, 瞿桂芳. 川芎嗪对白血病K562 细胞增殖和凋亡的影 响[J]. 中国冶金工业医学杂志, 2010, 27(1): 5-7. |
| [13] | Pennati M, Millo E, Gandellini P, et al. RNA interferencemediated validation of survivin and Apollon/BRUCE as new therapeutic targets for cancer therapy[J]. Curr Top Med Chem, 2012, 12(2): 69-78. |
 2014, Vol. 16
2014, Vol. 16

 , 孝飞飞, 李建厂
, 孝飞飞, 李建厂