急性淋巴细胞白血病(acute lymphoblastic leukemia ALL)患儿化疗期间发生感染是患儿治疗 失败、死亡的主要原因之一[1]。由于疾病自身的特 点和化疗药及免疫抑制剂的应用使得ALL 患儿免 疫功能低下,极容易发生继发感染。因此寻找提 高化疗后ALL 患儿免疫力的辅助药物,对控制感 染的发生具有重要意义。黄宗宣等[2] 研究表明, 黄芪作为一种常用的扶正中药,在化疗同时加用 黄芪注射液后可增加血小板及红细胞计数,同时 增强细胞免疫功能。黄芪注射液是否影响粒细胞 计数等感染相关因素目前尚未见相关研究,本研 究主要探讨黄芪注射液能增强细胞免疫的同时, 是否对ALL 患儿化疗后的感染因素有所影响及影 响机制如何,具体报道如下。
2009 年3 月至2013 年3 月在新疆医科大学 第一附属医院小儿内一科住院治疗的ALL 患儿91 例,其中男43 例,女48 例,年龄2 个月~14 岁, 所有病例均符合2006 年全国小儿血液病学术会议 制定的《儿童急性淋巴细胞白血病诊疗建议(第 三次修订草案)》中的诊断标准[3]。采用随机双盲 法将91 例ALL 患儿分为治疗组和对照组,治疗组 47 例,其中男23 例,女24 例,年龄3~14 岁,平 均年龄7.0±1.8 岁,标危组15 例,中危组15 例, 高危组17 例;对照组44 例,其中男20 例,女24 例, 年龄5~14 岁,平均年龄7.5±2.0 岁,标危组20 例, 中危组12 例,高危组12 例。根据患儿的临床表现、 血像及骨髓像检查结果等,结合国际通用的MIC 分型标准[4] 以及儿童急性白血病诊疗建议(第三 次修订草案)[3] 对临床危险度进行分型。治疗组与 对照组患儿在民族、年龄、性别等方面比较差异 均无统计学意义(均P>0.05)。
根据2003 年卫生部印发的《医院感染诊断 标准》,具体如下:(1)发热,体温>38℃,持 续4 h 以上或伴有寒战,并除外输液、输血反应 等其他原因者和ALL 患儿化疗后骨髓抑制期体温 >38.5℃,即考虑有感染[5]。(2)有感染定位临床 表现,即可临床诊断。(3)出现感染临床症状后, 给予病原学培养,病原学培养有阳性结果,或B 超、 X 线等检查有阳性结果,可确定诊断。
两组同种类型疾病化疗方案相同,诱导缓解 治疗方案依据2006 年全国小儿血液病学术会议制 定的《儿童急性淋巴细胞白血病诊疗建议(第三 次修订草案)》[3]。治疗组在化疗第1天同时给予 静脉滴注黄芪注射液(成都地奥九泓制药厂,国 药准字Z51021776,10 mL/ 支,相当于黄芪2 g) 0.5 mL/(kg·d),连用35 d;对照组用氯化钠替 代黄芪注射液进行输注(两组均用黑色瓶罩及棕 色输液器,且由我院静配中心人员配制完成后送 至我科)。如出现黄芪过敏反应,则立即停用黄 芪注射液,同时给予抗过敏治疗待病情平稳后退 出该实验。本实验治疗期间有1 例标危组及3 例 高危组患儿由于出现黄芪过敏反应(出现药疹)退 出实验。所有患儿在外周血WBC<1×109/L 时,均 给予粒细胞集落刺激因子至白细胞计数>1×109/L, 其他支持治疗相同。
逐个记录纳入研究的ALL 患儿的感染日期、 感染症状、感染部位、抗生素使用情况,化疗前 后血、尿、粪常规,各种病原学及影像学检查结 果,经管医生填报感染登记表等,并进行汇总分 析,主要分析在诱导缓解化疗过程中发生感染患 儿的感染类型、感染部位、感染菌种、黄芪注射 液及抗生素使用情况以及应用辅助治疗情况等, 并通过标准化法[6] 计算两组患儿的标准化感染率。 标准化法[6] 是采用统一的标准构成,以消除年龄、 性别、病情轻重及病程长短等因素构成不同对研 究结果的影响,使算得的标准化率具有可比性。 计算方法为:选择两组人数合并作为标准组,按 式P'= Σ Nipi/N(P' 为标准化率,Nipi 为各临床分 型的预期感染人数,是指用被标化组的分组感染 率去预测在标准人口Ni 中可能有多少人会发生感 染),计算治疗组及对照组的标准化感染率。
应用SPSS 17.0 统计软件对数据进行统计学分 析,计量资料以均数± 标准差(x±s)表示,两 组间比较采用t 检验或配对t 检验;计数资料以率 (%)表示,组间比较采用χ2 检验,P<0.05 为差 异有统计学意义。
43 例治疗组患儿中,共有19 例患儿经化疗后 发生感染,感染率为44%;44 例对照组患儿中, 有31 例患儿发生感染,感染率为70%,明显高于 治疗组(χ2= 6.14,P<0.05)。但每组不同临床危 险度分型患儿的感染率比较差异均无统计学意义 (均P>0.05),见表1。
| 表 1两组ALL 患儿化疗后感染发生率的比较 |
将治疗组和对照组病例总数作为标准人 数,分别计算出治疗组标准化感染率为27%,明 显低于对照组标准化感染率(58%,χ2= 6.14, P<0.05)。治疗组标危患儿标准化感染率为18%, 对照组为32%;治疗组中危患儿标准化感染率为 23%,对照组为33%;治疗组高危患儿标准化感染 率为25%,对照组为41%,对照组不同临床危险 度分型患儿的标准化感染率均高于治疗组(分别 χ2=5.22、3.88、5.78,均P<0.05)。
治疗组与对照组不同临床危险度分型患儿化 疗前白细胞总数及中性粒细胞计数比较差异均无 统计学意义(均P>0.05,表2);两组不同临床危 险度分型患儿化疗后白细胞总数比较差异亦均无 统计学意义(均P>0.05),但治疗组中性粒细胞 计数均高于对照组(均P<0.05),见表3。
| 表 2两组化疗前白细胞及中性粒细胞水平比较 (x±s,×109/L) |
| 表 3两组化疗后白细胞及中性粒细胞水平比较 (x±s,×109/L) |
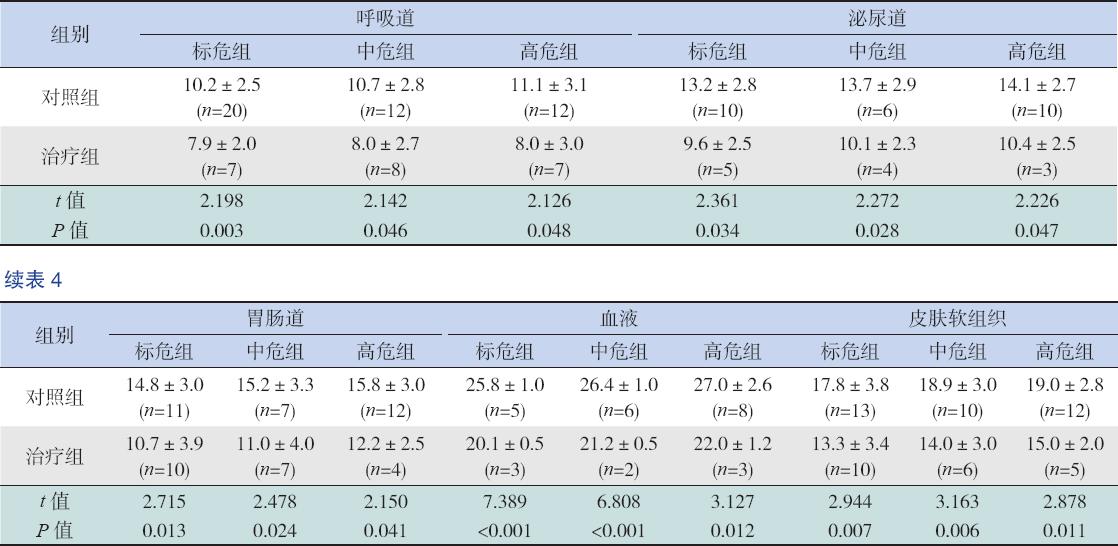
ALL 患儿全身多个部位均会发生感染,其中 以菌血症持续时间最长;治疗组不同临床危险度 分型患儿不同感染部位感染持续时间均短于对照 组(均P<0.05)。见表4。
| 表 4两组化疗期间不同感染部位感染持续时间比较 (x±s,d) |
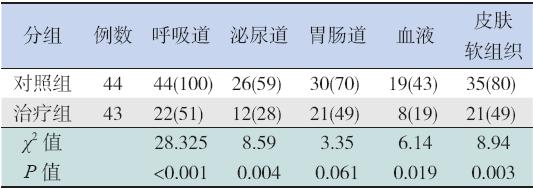
ALL 患儿在诱导缓解化疗期间发生感染以 呼吸道感染、胃肠道感染及皮肤软组织感染较为 常见;且治疗组呼吸道感染、泌尿道感染、血液 感染及皮肤软组织感染发生率均低于对照组(均 P<0.05),而在胃肠道感染方面两组差异无统计学 意义(P>0.05)。见表5。
| 表 5两组化疗期间感染部位的发生率比较 [ 例(%)] |
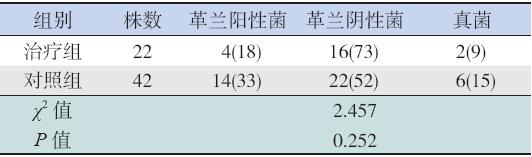
87 例ALL 患儿的分泌物中共培养出64 株病 原菌,其中革兰阳性菌18 株(28%),革兰阴 性菌38 株(59%),真菌8 株(12%),革兰阴 性菌感染率高于革兰阳性菌及真菌(χ2=9.1428, P<0.005),但革兰阳性菌、革兰阴性菌和真菌 分布在两组之间比较差异均无统计学意义(均 P>0.05)(表6)。治疗组共送检43 份分泌物, 有16 份培养呈阳性(37%),而对照组共送检44 份分泌物,有30 份培养呈阳性(68%),两组分 泌物培养阳性率比较差异有统计学意义(χ2=8.37, P<0.05)。
| 表 6治疗组与对照组不同感染病原菌分布构成比 [ 例(%)] |
治疗组有4 例患儿在静脉滴注棕色输液瓶中 液体时(即黄芪注射液时)出现过敏反应,其中 高危组3 例,均表现为全身皮肤瘙痒难忍,随后出 现针头样红色皮疹,颜面部及前胸部大面积密集成 片,呈四肢对称散在分布,伴有头晕、头胀感等; 标危组1 例,仅出现四肢散在分布皮疹,伴有瘙痒、 头晕感。上述4 例患儿均立即停止静脉滴注该液体, 同时给予葡萄糖酸钙、维生素C、口服扑尔敏片等 积极抗过敏治疗,局部给予炉甘石洗剂涂抹,数小 时后皮疹逐渐消退,同时退出实验。
近年来,由于化疗方法的不断改进,儿童 ALL 的生存率不断提高,免疫抑制剂的应用及化 疗后骨髓抑制,导致医院感染机会加大,由感染 导致的死亡是ALL 患儿死亡的主要原因之一[7, 8]。 黄芪可作为一种常用的扶正中药, 在急性白血病 患儿化疗期间益气养元,扶正祛邪,养心通脉, 促进造血功能的恢复,但黄芪能否减少患儿化疗 期间感染的发生有待于进一步研究。本研究选择 2~14 岁的ALL 患儿作为研究对象,探讨黄芪注射 液对ALL患儿诱导缓解化疗期间感染因素的影响。
本研究结果显示:化疗后治疗组感染发生率 明显低于对照组,提示ALL 患儿在诱导缓解期化 疗同时加用黄芪注射液可以降低化疗期间感染的 发生率;化疗后治疗组各部位感染持续时间低于 对照组,粒细胞水平高于对照组,说明黄芪注射 液可能减轻化疗对骨髓粒系的抑制作用,也可能 刺激骨髓粒细胞增生,持续增加ALL 患儿的粒细 胞数目,或促进集落刺激因子等造血因子刺激骨 髓造血,提升粒细胞水平,使得患儿抗感染能力 增强,缩短ALL 患儿感染持续时间;ALL 患儿诱 导缓解期以呼吸道感染、胃肠道感染及皮肤软组 织感染较为常见,研究也表明治疗组发生呼吸道 感染的ALL 患儿少于对照组,提示黄芪注射液作 为一种扶正固本的中药可能对治疗小儿呼吸道感 染有良好的疗效[9, 10];ALL 患儿感染的病原菌以革 兰阴性菌为主,治疗组分泌物培养阳性率低于对 照组,表明治疗组感染患儿临床表现较对照组轻, 感染较容易控制。上述研究均表明ALL 患儿在诱 导缓解化疗期间医院感染较为多见,与高红英等[11] 的研究结果相同,应用黄芪治疗35 d 后,感染发 生率较对照组明显降低,治疗组感染控制效果优 于对照组。
近年来一些研究还证明黄芪注射液相应的也 会产生其不良反应,如:药疹、急性荨麻疹、迟 发性严重性静脉炎、过敏性休克、胃肠道反应、 肌痛症、溶血性贫血、少尿等[12],故在使用前应 详细询问患儿过敏史,一旦出现上述不良反应, 立即停止使用黄芪注射液,同时积极给予抗过敏 治疗,避免加重病情,本研究过程有1 例标危组 及3 例高危组患儿出现全身皮肤瘙痒难忍,随后 出现针头样红色皮疹,颜面部及前胸部大面积密 集成片,四肢对称散在分布,伴有头晕、头胀感等, 立即给予抗过敏治疗后,停止使用黄芪注射液。 另有文献表明大剂量黄芪可能还具有免疫治疗作 用[13, 14]。黄芪含有三萜皂甙类衍生物、黄酮化合 物、多种氨基酸、微量元素和维生素等多种物质, 共同起到调节机体免疫功能作用,可能存在以下 调节机制:(1)通过调节细胞免疫系统而发挥作 用;(2)可能增加网状内皮系统的吞噬功能,促 进抗体的生成;(3)黄芪总甙可能调节T 细胞亚 群[15] 的比例,促进肿瘤细胞的凋亡。故黄芪作为 一种双向免疫调节剂,其抗肿瘤作用已经得到公 认,因此本研究把这种辅助药物加入急性白血病 诱导缓解期化疗的过程中起到了其正性作用。ALL 患儿在正规化疗过程中必然会经历骨髓抑制期, 此时粒细胞减少最容易导致感染[16],结合黄芪作 为辅助治疗药物可减少感染的发生率,黄芪提高 粒细胞水平的机制需进一步研究。总之,白血病 的治疗比较复杂,策略性强,化疗同时加用中药 治疗可能提高化疗效果,减少或减轻感染,为提 高化疗的成功率开辟了新的思路。
| [1] | 周晖. 儿童急性白血病患者发生医院感染的易感因素研究[J]. 中国当代医药, 2011, 5(18): 32-33. |
| [2] | 黄宗宣, 严媚, 李捷, 等. 黄芪注射液对急性白血病化疗患 儿造血和免疫功能的影响[J]. 中华实用诊断与治疗杂志, 2011, 25(11): 1070-1072. |
| [3] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员 会. 儿童急性淋巴细胞白血病诊疗建议:第三次修订草案[J]. 中华儿科杂志, 2006, 44(5): 392-395. |
| [4] | 谭静, 张耀东, 谭利娜, 等. 儿童急性白血病医院感染因素 的Meta 分析[J]. 现代医药卫生, 2012, 28(2): 181-182. |
| [5] | 贾月萍, 刘桂兰, 张乐萍, 等. 急性白血病儿童医院感染71 例[J]. 实用儿科临床杂志, 2007, 22(22): 1707-1708. |
| [6] | 李晓松, 郝元涛, 张菊英, 等. 医学统计学[M]. 第2 版. 北京: 高等教育出版社, 2010: 67-69. |
| [7] | 胡红兵, 刘翎, 罗德娟, 等. 儿童医院葡萄球菌感染现状及 耐药性调查[J]. 中华医院感染学杂志, 2005, 15(2): 197-199. |
| [8] | 马燕, 米弘英. 儿童急性白血病强化疗期间感染防治措施[J]. 中国当代儿科杂志, 2001, 3(6): 666. |
| [9] | 邓希佳. 黄芪注射液治疗小儿呼吸道感染疗效观察[J]. 中国 初级卫生保健, 2004, 18(5): 38. |
| [10] | 陈慧. 黄芪注射液穴位注射防治小儿反复呼吸道感染临床观 察[J]. 中国中医急症, 2005, 14(5): 444. |
| [11] | 高红英, 陈娟娟, 陈光福. 儿童急性淋巴细胞白血病医院感 染临床分析[J]. 临床医药实践, 2010, 19(8A): 566-567. |
| [12] | 邓芳. 黄芪注射液的不良反应[J]. 中国药业, 2006, 15(3): 79-80. |
| [13] | Sasada M. Pathophysiological aspects of neutrophils—dual action of neutrophils[J]. Rinsho Ketsueki, 2003, 44(6): 351-357. |
| [14] | 石鹏, 林为民, 傅忠国. 大剂量黄芪注射液治疗肾病综合征 临床研究[J]. 中国新医药, 2003, 2(12): 30-31. |
| [15] | 余向东, 严发敏. 黄芪注射液配合化疗对急性白血病患者T 淋巴细胞亚群的影响[J]. 时珍国医国药, 2003, 14(12): 755. |
| [16] | 刘晓艳, 党西强, 万伍卿, 等. 小儿急性白血病医院感染危 险因素的非条件Logistic 回归分析[J]. 中国当代儿科杂志, 2001, 3(3): 257-259. |
 2014, Vol. 16
2014, Vol. 16