引用本文

何永艳, 王玥, 李淼,等.急性淋巴细胞白血病患儿诱导缓解期合并毛霉菌感染2例[J]. 中国当代儿科杂志, 2014, 16(2): 152-154.

HE Yong-Yan, WANG Yue, LI Miao,et al. Concurrent mucormycosis in children with acute lymphoblastic leukemia at induced remission stage:two case report[J]. CJCP, 2014, 16(2): 152-154.

收稿日期:2013-7-16,修改日期:2013-12-10
作者简介:何永艳,女,硕士研究生。
Concurrent mucormycosis in children with acute lymphoblastic leukemia at induced remission stage:two case report
病例1:女,34 个月,因间断发热、咳嗽伴
面色苍白半月余入院。否认结核病史及接触史。
体查:重度贫血貌,全身未见出血点。颈部及右
侧腹股沟可触及1.2 cm×1.0 cm 大小淋巴结,质韧,
活动度可,无触痛。咽充血,双肺听诊呼吸音粗。
腹软,肝肋下约6.0 cm,脾肋下约4.5 cm,质韧、
边缘钝。入院查血常规:WBC 26.8×109/L,NE
0.09×109/L,RBC 1.98×1012/L,HB 59 g/L,PLT
60×109/L;骨髓象:急性淋巴细胞白血病(ALL)
骨髓象;免疫分型:异常B 系淋巴细胞;染色体
正常;融合基因阴性。临床诊断:ALL(B 细胞型)。
给予儿童ALL 2006 方案化疗,泼尼松试验反应良
好。第19 天复查骨髓象为完全缓解。第21 天,
患儿出现发热(38.0℃左右),偶咳,颜面、躯干
出现皮肤包块,伴疼痛感。体查:颜面及躯干共
可见3 个红色包块,直径约0.5~0.8 cm,位置表浅,
触痛明显,皮温不高。血常规:WBC 0.5×109/L,
NE 0.09×109/L,RBC 2.37×1012/L,HB 70 g/L,
PLT 49×109/L。考虑皮肤感染多由葡萄球菌所致,
给予抽血行血培养、暂停化疗处理,泼尼松在
1 周内减停,加强支持疗法,并加用万古霉素与头
孢吡肟经验性抗感染治疗3 d,患儿皮肤感染未见
好转,调整为美罗培南、万古霉素及伏立康唑联
合抗感染治疗,然而皮肤仍有新发包块出现,且
原有包块逐渐增大,其中最大达2.5 cm×1.5 cm,
表面红肿、破溃。两次血培养未见细菌和真菌生长;
真菌D- 葡聚糖检测阳性。行颜面包块切开引流,
做脓汁培养可见毛霉菌生长;右侧臀部皮肤包块
活检病理回报为变性坏死的皮肤及皮下组织内可
见真菌菌丝(图1),符合毛霉菌感染改变。因
毛霉菌感染常可侵袭多脏器,故行全身影像学检
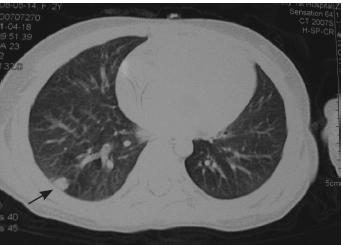
查。头颅及腹部CT 扫描未见异常,肺部CT 平扫
示右肺下叶胸膜下区见一结节样高密度影,大小
约0.7 cm×0.5 cm(图2),符合肺部毛霉菌感染
的影像学改变。结合患儿强力抗细菌治疗无好转
且继续进展及病理改变,临床确诊为毛霉菌感染。
换用两性霉素 B 脂质体(每日0.1 mg/kg)
静脉滴注,1 周后逐渐加量至 5 mg/kg 维持用
药。同时停用万古霉素,用药期间监测肝肾功
能、血离子。治疗 2 d 后,原有包块缩小,触痛
减轻,无新发包块,患儿皮肤感染得到控制。
治疗2 周后复查肺部CT 示高密度影较前吸
收,3 周后除颜面残余一处皮肤包块外,其余均消
退,共用药 4 周。停药 1 个月后,再次复查肺部
CT 示病灶已吸收。
病例2:男,4 岁,因间断发热半月余,皮肤
出血点2 d 入院,否认结核病史及接触史。体查:
中度贫血貌,皮肤可见散在出血点。颈部及双侧腹
股沟可触及1.0 cm×1.0 cm 大小淋巴结,质韧、活
动度可、无触痛。双肺听诊呼吸音略粗。腹软,肝
肋下约6.0 cm,脾肋下未触及。入院血常规:WBC
52.6×109/L,NE 0.10×109/L,RBC 2.68×1012/L,
HB 69 g/L,PLT 19×109/L;骨髓象:ALL 骨髓象;
免疫分型:异常B 系淋巴细胞;染色体正常;融
合基因阴性。临床诊断:ALL(B 细胞型)。给予
儿童ALL 2006 方案化疗。泼尼松试验反应良好。
化疗第17 天,患儿开始出现颜面部水肿,鼻塞及
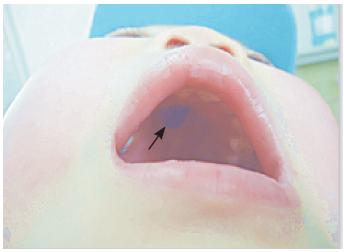
流涕,无发热。体查:颜面部水肿,右侧鼻腔黏
膜水肿,可见黄绿色分泌物,口腔硬腭处可见黏
膜坏死区,双肺呼吸音清,未闻及罗音,神经系统无异常。血常规:WBC 0.50×109/L,NE 0.02×109/
L,RBC 3.38×1012/L,HB 102 g/L,PLT 21×109/L。
真菌涂片(鼻拭子):未查到真菌菌丝及孢子。
一般细菌涂片(鼻拭子):可见革兰阴性球菌和
革兰阳性球菌。G 试验为阴性。多次血培养及分泌
物培养结果均为阴性。鼻窦CT 平扫:双侧上颌窦、
筛窦、蝶窦炎症;双侧下鼻甲、鼻中隔黏膜增厚,
考虑炎性所致;右侧颌面、鼻根及鼻前庭软组织
改变,无骨质破坏。同时行鼻黏膜坏死组织活检。
治疗上暂停化疗,加用粒细胞集落刺激因子,给
予舒普深、万古霉素及伏立康唑经验性联合抗感
染治疗,患儿症状无改善,颜面部水肿较前加重。
病理结果回报(图3):大部分为变性组织及炎性
渗出物,表面附真菌,伴变性,菌丝略粗,偶见
近直角分支,排列杂乱,但孢子较多,考虑为毛
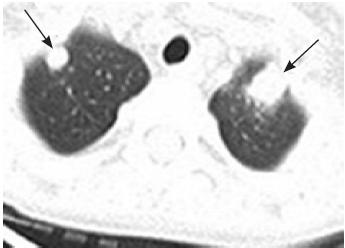
霉菌感染。肺部CT 扫描(图4):双肺各叶炎症,
考虑真菌感染可能性大。故临床确诊为毛霉菌感
染。换用两性霉素B 脂质体治疗(用法同病例1),
监测肝肾功能、血离子。用药第2 天患儿颜面部
水肿减轻,仍有鼻塞及流涕症状,硬腭坏死区面
积未扩大。治疗2 个月,病情明显好转,复查肺
部CT 提示病灶逐渐吸收,但被毛霉菌感染的组织
出现坏死和脱落,形成瘘道(图5)。
讨论:毛霉菌病临床少见,病死率高
[1],多
发生于糖尿病、白血病、恶性肿瘤、器官移植、
粒细胞缺乏症(>10 d)、长期应用免疫抑制剂及
糖皮质激素患者,临床分鼻脑型、肺型、皮肤型、
胃肠型及播散型5 种类型,其中肺型毛霉菌感染
在血液系统恶性疾病患儿中最常见
[2, 3]。本文2 例
患儿均为ALL 诱导化疗、骨髓抑制、粒细胞缺乏
期感染,出现发热、皮肤包块及鼻塞、流涕、颜
面水肿,鼻腔黏膜感染及骨质破坏。经病理活检
诊断为毛霉菌病,为播散型,累及部位为皮肤、
肺部及鼻窦。毛霉菌病症状不典型,体征无特异性,
G 试验或GM 试验检查为阴性,影像学表现与曲霉
菌相似,临床诊断困难,依靠组织活检及真菌培
养方可确诊。本文2 例患儿在怀疑真菌感染的初
期均多次行涂片镜检、病原体培养及血清学检测,
确诊毛霉菌感染的依据不足,其中病例1 患儿G
试验结果为阳性,考虑可能治疗过程中药物影响
而出现假阳性结果,后来行组织活检及分泌物真
菌培养确诊。
毛霉菌病的治疗有3 个方面:一是早期诊断,
逆转或减少潜在的危险因素;二是抗真菌治疗;
三是外科清创术[4]。逆转或减少潜在危险因素的手
段包括暂停化疗,纠正粒细胞减少及缺乏,尽量
避免糖皮质激素的应用。目前抗毛霉菌病药物首
选两性霉素B 脱氧胆酸盐和两性霉素B 脂质体,
但其副作用大,可出现肾毒性及顽固性低钾血症,
用药期间需监测肾功能及血离子。其他常用药物
中,只有泊沙康唑对毛霉菌感染有效,用于毛霉
菌感染的二线治疗及挽救治疗;有个案报道伊曲
康唑对毛霉菌感染有效[5],其有效性需进一步评
估;伏立康唑对毛霉菌不敏感,部分报道认为其
可增加毛霉菌患病风险。本文2 例患儿早期用伏
立康唑治疗后症状无改变,病情未得到控制,但
后期均使用伏立康唑口服继续治疗,并未出现感
染加重及反复。其他治疗方案:铁螯合剂、G-CSF/
GM-CSF、高压氧治疗等均被证实具有抗真菌作用,
与两性霉素B 联合应用可提高治疗效果[6, 7, 8],可作
为辅助支持手段。外科清创:应作为鼻脑型与皮
肤及浅表组织感染的基础治疗手段,然而白血病
患儿往往因血常规处于骨髓抑制期及不能配合等
原因,外科清创困难。抗毛霉菌治疗的疗程目前
尚无明确标准,应根据临床症状及实验室检查等
结果综合判断,建议对持续免疫抑制治疗的患儿
长期采取相关预防措施[9]。


 2014, Vol. 16
2014, Vol. 16
