左旋门冬酰胺酶(L-asparaginase,L-asp) 自 1978 年问世,获得FDA 批准应用于治疗急性淋巴 细胞白血病(ALL)之后,已成为治疗儿童ALL 联合化疗的重要组成,并明显改善了儿童ALL 的 远期疗效。早在1999 年与未加入L-asp 的化疗方 案比较,含有L-asp 的化疗方案治疗可明显提高儿 童ALL 的5 年以上长期无事件生存率(LTEFS)[1]。 此后该数据统计结果也显示,L-asp 可使儿童 ALL 治疗的完全缓解率(CR)和LTEFS 分别达 到95% 和75% 以上[2]。然而,L-asp 作为一种异 种蛋白,临床不良反应率较高,如过敏反应、凝 血功能异常、肝功能损害、低蛋白血症、急性胰 腺炎等[3, 4]。近年来,新一代门冬酰胺酶制剂— 培门冬酶(pegaspargase,PEG-asp)已研制成功, 并应用于临床。PEG-asp 是聚乙二醇(PEG) 与 L-asp 的共价结合物,其抗肿瘤机制与L-asp 相 同,理论上不但保留L-asp 的活性、降低L-asp 的 免疫原性,而且半衰期较L-asp 的延长5 倍[5], 然而目前PEG-asp 治疗儿童ALL 相关研究与报道 尚为有限。为提高对PEG-asp 的认识,本文通过 复习与归纳PEG-asp 治疗儿童ALL 的研究进展, 以及与L-asp 的初步对比结果等内容进行综述。
早在1961 年有人发现门冬酰胺(或称天门 冬酰胺asparagine,Asn)是瘤细胞延续细胞周期 的必需物质,并证明了L-asp 的抗肿瘤活性[6]。 于1964 年,有人从大肠杆菌培养体系中成功提取 L-asp(E.coli L-asp),为L-asp 批量生产建立基础。 并于1967 年首次证实,L-asp 具有治疗人类白血 病的功效。
因其无明显骨髓抑制,与其他化疗药物无 交叉耐药性,于1978 年获FDA 批准应用于治疗 ALL,至今已有30 余年历史[7]。
E.coli L-asp 结构为一个四聚体,总分子量为 138 000~141 000 Da,每个单体分子量为32 kDa 左 右。各国学者先后研究并绘制出其二、三级分子 结构和空间结构图,并发现了影响E.coli L-asp 特 性的基团—组氨酰残基。欧文氏菌L-asp 的分子 结构与E.coli L-asp 类似,每个单体分子量约为 40 kDa,总分子量为138 kDa。
L-asp 同样具有谷氨酰胺酶(glutaminase, Glu)的活性,该酶可水解谷氨酰胺(glutamine, Gln),其活性仅占整个L-asp 活性的3%~9%。但 L-asp 具有高底物特异性,米氏常数为6~15 μM, Glu 的米氏常数值是L-asp 的100 倍,故高浓度的 ASP 及氨不会限制L-asp 水解Gln[10]。但当血浆中 Asn 在L-asp 作用下被迅速清除后,Gln 就成为L-asp 充裕的底物,被大量水解。研究证实,L-asp 水解 Gln 作用与L-asp 引起肝功能损伤、白蛋白、凝血 因子合成降低、高血糖和血栓形成等不良反应密 切相关[11]。
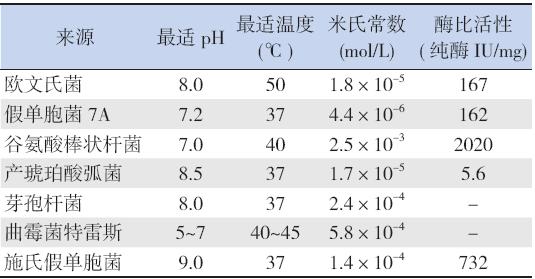
L-asp 存在于各种生物体内,不同来源的L-asp 的性质差异较大(表1)[12]。E.coli L-asp 及欧文氏 菌L-asp 被证明毒性最低[13],被选择应用于临床。
| 表 1不同生物体来源的L-asp 的性质比较 |
L-asp 的抗ALL 作用可根据血浆L-asp 活性和 Asn 水平来评估,但Asn 较难准确检测,且抗ALL 的Asn 的有效临界值尚未确立,因此目前常以L-asp 活性来评估。一般认为血浆L-asp 活性>100 IU/L 能有效清除血液中的Asn 而达到治疗作用。L-asp 治疗儿童ALL 和非霍奇金淋巴瘤(NHL)的疗效 已得到充分肯定,并被纳入国内外标准化疗方案 的重要组成,无需赘述。有关目前两种比较常用 的广泛应用L-asp 的疗效对比相关研究显示,E.coli L-asp 似优于欧文氏菌L-asp,如Otten 等[18] 观察 300 例ALL,E.coli L-asp 和欧文氏菌L-asp 治疗的 4 年无事件生存率(EFS)分别为75% 和62%,差 异无统计学意义。但Pacquement 等[19] 发现E.coli L-asp 组的5 年EFS 明显高于欧文氏菌L-asp 组 (100% vs 74%)。
L-asp 酶作为一种来自于细菌的异体蛋白,其 高免疫原性导致下列不利后果:(1)迅速被内生 蛋白酶灭活,或被网状内皮系统清除;(2)外源 性蛋白对宿主产生过敏反应及毒副作用;(3)非 初次用药的患儿体内抗L-asp 抗体产生率达58%。
| 表 2儿童L-asp 化疗期间的饮食控制原则 |
国外学者将L-asp 导致临床应用失败的原因归 纳为:高过敏反应发生率(3%~78%)和易产生抗体, 并寻找可代替L-asp 或减轻其不良反应的复合物 , 但均未达到预期要求。而理论上聚乙二醇复合物 具有以下优点:降低肾脏清除率而提高半衰期; 提高药物代谢位阻作用,以保护酶不被网状内皮 系统所清除;增加水溶性,特别是抗癌药物的溶 解度;阻止异种蛋白免疫反应的发生;选择性在 肿瘤高积累[31]。事实证明PEG-asp 较L-asp 在稳定 性、溶解度、生物活性及免疫原性等方面均得到 改善,于1994 年获得FDA 批准应用于对L-asp 过 敏的患者,并于2006 年作为ALL 患者联合化疗方 案的重要药物组成。
PEG-asp 是E.coli L-asp 共价连接单甲基基团 后的产物,该基团仅5 000 Da,分子量较L-asp 少 量增加,但明显改变其免疫学及药代动力学。
聚乙二醇化在不影响化合物活性的情况下使 其自身抵抗蛋白水解能力增强,免疫原性和抗原 性减少,从而增加耐受性;故PEG-asp 的作用机 制同L-asp,即前述消耗白血病细胞赖以生存的 Asn 及诱导细胞凋亡。
酶的化学性质由其来源决定,故PEG-asp 的 化学性质与E.coli L-asp 相同[32]。但PEG-asp 的抗 L-asp 高滴度抗体发生率明显低于E.coli L-asp(2% vs 26%,P=0.001),提示E.coli L-asp 较PEG-asp 易产生抗体并可能影响预后。
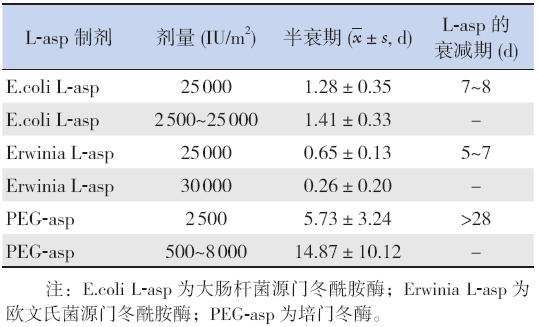
有文献通过比较3 种不同来源 L-asp 的药代动力学水平发现,药物半衰期受酶的 来源影响,而与剂量或是否重复使用无关(表3)[10], 但由于PEG-asp 使用数据未做更新,未进一步验证。 而且PEG-asp 较E.coli L-asp 的半衰期增加18 倍, 曲线下面积增加26 倍,药物清除率下降17 倍[32]。 但对E.coli L-asp 过敏的患者,再次使用E.coli L-asp 或者PEG-asp 时的半衰期均明显降低。
| 表 3不同种类的L-asp 治疗儿童ALL 的的药物动力学 参数 |
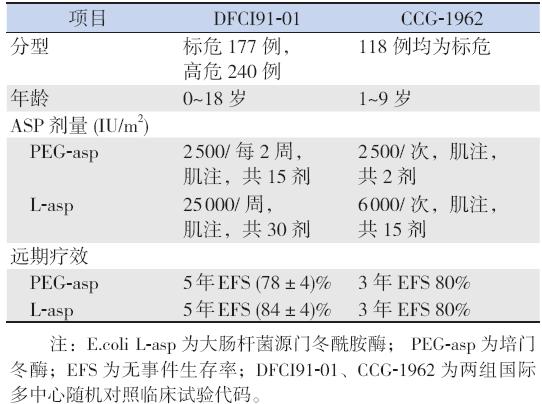
曾有PEG-asp 与L-asp 治疗儿童ALL 的国际 多中心随机对照研究显示,PEG-asp 与L-asp 疗效 相似[34, 35, 36](表4),但近年未见类似报道。
| 表 4PEG-asp 与L-asp 治疗儿童ALL 的国际多中心的 随机对照研究 |
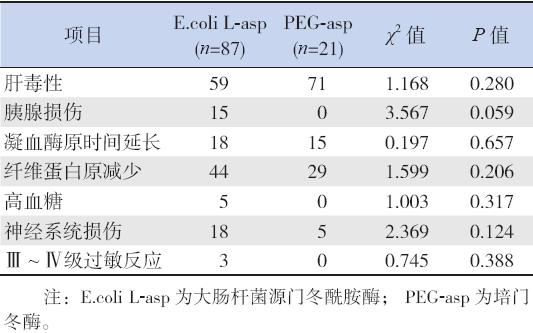
文献报道PEG-asp 的优势在于过敏反应少, 使用L-asp 发生超敏反应的病例,采用PEG-asp 替 代过敏反应的发生率仅为10%,而换用其他Asn 酶制剂超敏反应的发生率高达32%。PEG-asp 除过 敏反应少之外,其他不良反应可能仍与Asn 酶相 似[35],也可导致胰腺损伤、高血糖、高胆固醇血症、 血栓形成及出血等。有学者通过一个开放、多中 心的研究试验对PEG-asp 与L-asp 治疗ALL 的不 良反应发生率进行对比(表5)[37],发现PEG-asp 的不良反应发生率与L-asp 类似。但由于PEG-asp 在体内作用持续时间长,抑制蛋白质合成作用更 强,可能使化疗后骨髓抑制和血凝功能低下的恢 复时间延长,故应更加注意临床用药的时机,并 加强护理,防范其严重并发症的发生[38]。最近一 篇文献报道,在使用E.coli L-asp 过敏以及不能继 续PEG-asp 治疗者可以选用欧文氏菌L-asp 治疗, 且可以维持新诊断的儿童白血病的长期无事件生 存率,并通过随机多中心实验证明欧文氏菌L-asp 可以很好耐受以上常见不良反应[39]。
| 表 5PEG-asp 与L-asp 治疗ALL 不良反应的比较 (%) |
综上所述,虽然目前的资料显示L-asp 及 PEG-asp 的疗效及不良反应相似,但PEG-asp 注射 液具有应用前免作皮试、使用次数少和使用方便 等优点。由于PEG-asp 应用于临床的时间不长, 且研究报道的样本数量也比较有限,故有待于今 后进一步开展多中心研究,通过扩大临床观察样 本量和延长观察时间,以阐明PEG-asp 在不良反 应发生率、严重程度、远期疗效,以及治疗经济 学等方面与同L-asp 的确切差异。
| [1] | Amylon MD, Shuster J, Pullen J, et al. Intensive high-dose l-asparaginase improves survival for pediatric patients with T-cell acute lymphoblastic leukemia and advanced stage lymphoblastic lymphoma: a Pediatric Oncology Group study[J]. Leukemia, 1999, 13(3): 335-342. |
| [2] | 刘英. 儿童急性淋巴细胞白血病的预后评估[J]. 中国实验血 液学杂志, 2007, 15(1): 202-206. |
| [3] | 崔兰英, 房倩, 张东风. 左旋门冬酰胺酶治疗小儿急性淋巴 细胞白血病的护理[J]. 护理实践与研究, 2010, 7(14): 69-70. |
| [4] | Masetti R, Pession A. First-line treatment of acute lymphoblastic leukemia with pegasparaginase[J]. Biologics, 2009, 3: 359-368. |
| [5] | Graham ML. Pegaspargase: a review of clinical studies[J]. Adv Drug Deliv Rev, 2003, 55(10): 1293-1302. |
| [6] | Broome JD. Evidence that the L-asparaginase of guinea pig serum is respnsible for its antilymhpoma effects and properties of the L-asparaginase of guinea pig serum in relation to those of the antilymphoma substance[J]. Exp Med, 1963, 118(1): 99-120. |
| [7] | Hann I, Vora A, Richards S, et al. Benefit of intensified treatment for all children with acute lymphoblastic leukaemia: results from MRC UKALL XI and MRC ALL97 randomised trials. UK Medical Research Council's Working Party on Childhood Leukaemia[J]. Leukemia, 2000, 14(3): 356-363. |
| [8] | Lee MB, Bridges JM. L-asparaginase activity in human and animal sera[J]. Nature (London), 1968, 217(5130): 758-759. |
| [9] | 庄倩, 郝良纯, 张继红. L-asp 杀伤 MOLT-4 细胞的机制研究[J]. 中国肿瘤临床, 2012, 39(8): 421-424. |
| [10] | Narta UK, Kanwar SS, Azmi W. Pharmacological and clinical evaluation of L-asparaginase in the treatment of leukemia[J]. Crit Rev Oncol Hematol, 2007, 61(3): 208-221. |
| [11] | Mitchell L, Hoogendoorn H, Giles AR, et al. Increased endogenous thrombin generation in children with acute lymphoblastic leukemia: risk of thrombotic complications in L-asparaginase induced antithrombin Ⅲ deficiency[J]. Blood, 1994, 83(2): 386-391. |
| [12] | Savitri, Asthana N, Azmi W. Microbial l-asparaginase: a potent antitumor enzyme[J]. Indian Biotechnol, 2003, 2(2): 184-194. |
| [13] | Duval M, Suciu S, Ferster A, et al. Comparison of Escherichia coli-asparaginase with Erwinia-asparaginase in the treatment of childhood lymphoid malignancies: results of a randomized European Organisation for Research and Treatment of Cancer-Children's Leukemia Group phase 3 trial[J]. Blood, 2002, 99(8): 2734-2739. |
| [14] | Ho DH, Yap HY, Brown N, et al. Clinical pharmacology of intramuscularly administered l-asparginase[J]. Clin Pharmacol, 1981, 21(2):72-78. |
| [15] | Brueck M, Koerholz D, Nuernberger W, et al. Elimination of L-asparaginase in children treated for acute lymphoblastic leukemia[J]. Dev Pharmacol Ther, 1989, 12(4): 200-204. |
| [16] | Broome JD. Factors which may influence the effectiveness of L-asparaginases as tumor inhibitors[J]. Cancer, 1968, 22(3): 595-602. |
| [17] | Woo MH, Hak LJ, Storm MC, et al. Hypersensitivity or development of antibodies to asparaginase does not impact treatment outcome of childhood acute lymphoblastic leukemia[J]. Clin Oncol, 2000, 18(7): 1525-1532. |
| [18] | Otten J, Suciu S, Lutz P, et al. The importance of L-asparaginase (A'ase) in the treatment of acute lymphoblastic leukemia (ALL) in children: results of the EORTC 58881 randomized phase Ⅲ trial showing greater efficiency of E. coli (E. coli) as compared to Erwinia (Erw) A'ase[J]. Blood, 1996, 88(10): 2663-2663. |
| [19] | Pacquement H, Philippe N, Mechinaud F, et al. Importance of L-asparaginase (ASP), detrimental effects of additional cytosinearabinoside (ARA-C) and of iv 6-mercaptopurine (6-MP) in the treatment of lymphoblastic non-Hodgkin lymphoma (LB-NHL): results of the EORTC 58881 randomized trial[J]. SIOP XXIX, 1997, 160: 429. |
| [20] | Oettgen HF, Stephenson PA, Schwartz MR, et al. Toxicity of E. Coli l-asparaginase in man[J]. Cancer, 1970, 25(2): 253-278. |
| [21] | Fabry U, Ktirholz D, Jfirgens H, et al. Anaphylaxis to L-asparaginase during treatment for acute lymphoblastic leukaemia in children-evidence of a complement mediated mechanism[J]. Pediatr Res, 1985, 19(4): 400-408. |
| [22] | Edman P, Nylen U, Sjoholm I. Dialysis membranes containing asparaginase entrapped in microparticles[J]. Methods Enzymol, 1988, 137: 491-496. |
| [23] | Lee JH, Kim SW, Sung KJ. Sagittal sinus thrombosis associated with transient free protein S deficiency after L-asparaginase treatment: case report and review of the literature[J]. Clin Neurol Neurosurg, 2000, 102(1): 33-36. |
| [24] | Knoderer HM, Robarge J, Floc khart DA. Predicting asparaginaseassociated pancr eatitis[J]. Pediatr Blood Cancer, 2007, 49(5): 634-639. |
| [25] | Vrooman LM, Supko JG, Neuberg DS, et al. Erwin ia asparaginase after allergy to E. coli asparaginase in children with acute lymphoblastic leuemia[J]. Pediatr Blood Cancer, 2010, 54(2): 199-205. |
| [26] | Lowas SR, Marks D, Malempati S. Prevalence of transient hyperglycemia during induction chemotherapy for pediatric acute lymphoblastic leukemia[J]. Pediatr Blood Cancer, 2009, 52(7): 814-818. |
| [27] | 翁依妹. 左旋门冬酰胺酶不良反应的临床观察与护理[J]. 齐 鲁护理杂志, 2008, 14(2): 6-7. |
| [28] | 霍世英. 应用左旋门冬酰胺酶化疗期间患儿的饮食管理[J]. 护理学杂志, 2003, 18(6): 444-445. |
| [29] | Aljabri K, Sirrs S, Nantel S. Hypertriglyceridemia and hypercholesterolemia induced by L-asparaginase[J]. Ann Saudi Med, 2003, 23(3-4): 173-174. |
| [30] | He YF, Wei W, Sun ZM, et al. Fatal lactic acidosis and hypoglycemia in a patient with relapsed natural killer/T-cell lymphoma[J]. Adv Ther, 2007, 24(3): 505-509. |
| [31] | Pasut G, Sergi M, Veronese FM. Anti-cancer PEG-enzymes: 30 years old, but still a current approach[J]. Adv Drug Deliv Rev, 2008, 60(1): 69-78. |
| [32] | Holle LM. Pegaspargase: an alternative?[J]. Ann Pharmacother, 1997, 31(5): 616-624. |
| [33] | Yamaoka T, Tabata Y, Ikada Y. Distribution and tissue uptake of poly(ethylene glycol) with different molecular `weights after intravenous administration to mice[J]. J Pharm Sci, 1994, 83(4): 601-606. |
| [34] | Silverman LB, Gelber RD, Dalton VK, et al. Improved outcome for children with acute lymphoblastic leukemia: results of Dana-Farber Consortium Protocol 91-01[J]. Blood, 2001, 97(5): 1211-1218. |
| [35] | Avramis VI, Sencer S, Periclou AP, et al. A randomized comparison of native Escherichia coli asparaginase and polyethylene glycol conjugated asparaginase for treatment of children with newly diagnosed standard-risk acute lymphoblastic leukemia: a Children's Cancer Group study[J]. Blood, 2002, 99(6): 1986-1994. |
| [36] | Kurre HA, Ettinger AG, Veenstra DL, et al. Pharmacoeconomic analysis of pegaspargase versus native Escherichia coli L-asparaginase for the treatment of children with standard-risk, acute lymphoblastic leukemia: the Children's Cancer Group study (CCG-1962)[J]. Pediatr Hematol Oncol, 2002, 24(3):175-181. |
| [37] | Ettinger LJ, Kurtzberg J, Voute PA, et al. An open-label, multicenter study of polyethylene glycol-L-asparaginase for the treatment of acute lymphoblastic leukemia[J]. Cancer, 1995, 75(5): 1176-1181. |
| [38] | Silverman LB, Supko JG, Stevenson KE, et al. Intravenous PEG-asparaginase during remission induction in children and adolescents with newly diagnosed acute lymphoblastic leukemia[J]. Blood, 2010, 115(7): 1351-1353. |
| [39] | Keating GM. Asparaginase Erwinia chrysanthemi (Erwinaze®): a guide to its use in acute lymphoblastic leukemia in the USA[J]. BioDrugs, 2013, 27(4): 413-418. |
 2014, Vol. 16
2014, Vol. 16