支气管哮喘(简称哮喘)是儿童时期常见的 呼吸道疾病之一,其临床症状、严重程度、发作 频率、治疗效果及转归均与气道炎症有着密切的 关系。近些年来作为评估气道炎症的无创性标志 物—呼出气一氧化氮(FeNO)在临床工作中越来 越受到重视,其可以无创、安全地直接反映气道 炎症水平,对于处于临床缓解期的哮喘患儿病情 监测有着重要的意义[1]。而由于受到过敏性体质 的影响,临床上大部分哮喘患儿同时合并过敏性 鼻炎,已有研究证明,急性变应原暴露可能会影 响FeNO 水平,故在进行FeNO 测定时,对可疑受 试者需考虑过敏性鼻炎的可能[2, 3]。那么处于临床 缓解期的过敏性鼻炎,是否会影响FeNO 的水平? 目前尚未见该方面的研究报道。为此本研究对临 床缓解期的哮喘及哮喘合并鼻炎患儿进行FeNO 检 测,并与目前公认的临床缓解期哮喘评估的“金 标准”—支气管激发试验检测结果相比较,以评 估FeNO 检测在临床缓解期哮喘合并鼻炎儿童病情 评估中的临床价值。
依据中华医学会儿科分会呼吸学组《中华儿 科杂志》编辑委员会2008 年修订的《儿童支气管 哮喘诊断与防治指南》诊断标准[4],选取2012 年 12 月至2013 年5 月于我院哮喘中心确诊的214 例 处于临床缓解期哮喘儿童。
纳入标准:(1)年龄在5~18 岁之间,性别不限; (2)既往明确诊断为支气管哮喘,目前症状、体 征消失,肺功能检测一秒用力呼气容积(FEV1) 及 最大呼气流速峰值(PEF)≥ 80% 预计值,并维 持4 周以上;(3)依从性好,能配合进行FeNO 及支气管激发试验的检测。
排除标准:(1)4 周内有全身使用糖皮质激 素或者有过敏性鼻炎发作;(2)2 周内有上呼吸 道感染史;(3)检查前6 h 内使用短效支气管舒 张剂;(4)当天服用抗过敏药物;(5)检查前 2 h 内饮用咖啡、浓茶、可乐等刺激性饮料,食用 菠菜、莴苣、动物内脏等富含氮的食物或者有剧 烈运动。
纳入214 例患儿中,男140 例,女74 例; <12 岁187 例,≥ 12 岁27 例。依据是否使用吸入 性糖皮质激素(ICS),214 例患儿分为治疗组和 非治疗组,治疗组患儿严格按照GINA 要求规范性 使用ICS 治疗,治疗周期在6 个月以上,未使用 其他哮喘相关药物。依据两组患儿是否合并过敏 性鼻炎,进一步分为未合并过敏性鼻炎的哮喘治 疗组(AS 治疗组)、合并过敏性鼻炎的哮喘治疗组(AR+AS 治疗组)、哮喘未治疗组(AS 未治疗组)、 合并过敏性鼻炎的哮喘未治疗组(AR+AS 未治疗 组)。各组患儿的年龄、性别分布差异均无统计 学意义,见表1。
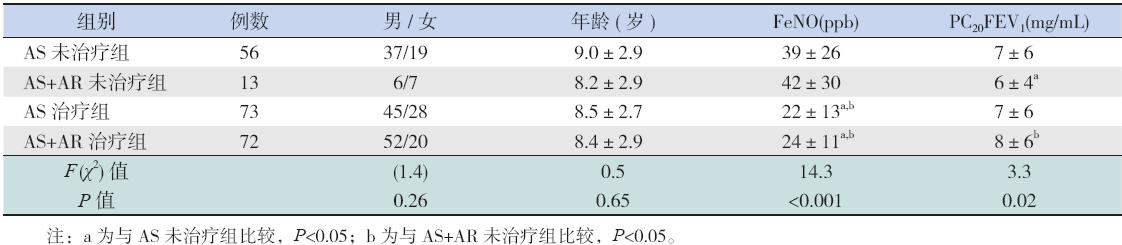
| 表 1 各组患儿FeNO 及PC20FEV1 比较 (x±s,例) |
采用瑞典Aerocrine 公司生 产的NIOX FeNO 测定系统(化学发光法台式机) 进行FeNO 检测。严格按照测试指南[5] 的要求, 测试对象吸入不含NO 的气体达肺总量,然后匀速 呼出肺内气体,呼气时维持流速为50 mL/s(基于 FeNO 的流速依赖性),时间为6 ~10 s。每一位患 儿检测两次以上,取两个相近数值计算平均值作 为检测结果。
肺功能检测采用德国Jaeger 公司生产的MasterScreen Pediatric 肺功能测定系 统。以乙酰甲胆碱为激发剂,浓度依次为0.03、0.06、 0.125、0.25、0.5、1、2、4、8、16 mg/mL,采用 潮气呼吸法吸入激发剂,使用射流雾化机和雾化 杯,用鼻夹夹住受试者鼻子,指导受试者口含雾 化杯的接口器,平静放松呼吸。调整雾化气流为 7~8 L/min,雾化时间为2 min,60 s 后测定肺功能, 间隔5 min 后吸入下一浓度。当FEV1 下降≥ 20% 时停止试验,为激发试验阳性。以引起FEV1 下降 20% 时的激发剂累计浓度(PC20FEV1)为定量指 标。如吸入16 mg/mL 激发剂后FEV1 下降仍未达 到20%,即PC20FEV1 ≥ 32 mg/mL 时,则为激发试 验阴性。
采用SPSS 17.0 软件进行资料分析。计量资料 以均数± 标准差(x±s)表示,组间比较采用方 差分析,进一步两两比较采用LSD 法;计数资料 采用卡方检验。P<0.05 为差异有统计学意义。
AS 治疗组FeNO 明显低于AS 未治疗组及 AS+AR 未治疗组;PC20FEV1 与AS 未治疗组及 AS+AR 未治疗组比较差异无统计学意义。AS+AR 治疗组FeNO 明显低于AS 未治疗组和AS+AR 未 治疗组;PC20FEV1 明显高于AS+AR 未治疗组,与 AS 未治疗组比较差异无统计学意义。AS 未治疗组 与AS+AR 未治疗组比较,PC20FEV1 明显升高,而 FeNO 无明显差别。见表1。
哮喘患者FeNO 浓度明显升高,是由于气道 上皮细胞、巨噬细胞、肥大细胞和淋巴细胞中诱 生型左旋精氨酸经NO 合酶(iNOS)增加所致[6]。 FeNO 浓度与哮喘严重程度和发作与否有关,肾上 腺皮质激素等抗炎药物的治疗可以降低哮喘患者 FeNO 水平[7],故FeNO 作为气道炎症的标志物, 与患者临床病情及治疗关系密切。
支气管激发试验和舒张试验是目前临床上诊 断哮喘的主要手段。对于处于临床缓解期的哮喘 患者,则主要依靠支气管激发试验,但其只能间 接反映气道炎症水平,且存在操作复杂、费时费 力等缺点,还有诱发支气管痉挛的风险,限制了 其临床应用。哮喘是一种复杂的临床综合征,很 难说哪一个指标是诊断哮喘的“金标准”,但是 由于支气管激发试验在临床上应用多年,其对哮 喘的诊断价值已得到公认,因此本研究和国内外 大多数研究一样,也选用激发试验作为诊断哮喘 的“金标准”以作为FeNO 诊断价值的参照。
本研究结果显示未合并过敏性鼻炎的哮喘患 儿治疗组与非治疗组仅FeNO 数值有显著差别, PC20FEV1 数值则无明显差别。国外有研究对缓解 期哮喘患者进行气道黏膜活检,发现其中嗜酸性 粒细胞、T 淋巴细胞、肥大细胞和IL-5 等均显著 高于对照组,证实了缓解期哮喘气道炎症的存在[8]。 殷菊等[9] 研究发现临床缓解时间≤ 12 个月与缓解 时间>12 个月的哮喘患儿支气管激发试验阳性率 差异无统计学意义。说明治疗达到一定阶段以后 支气管激发试验的检测结果会出现平台期,变化 不明显。本研究结果显示AS 治疗组FeNO 明显低 于AS 未治疗组,但是两组PC20FEV1 差异无统计 学意义,提示在缓解期继续规范化治疗6 个月以 上后气道炎症有明显的改善,而气道反应性则未 出现明显的降低,说明气道炎症改善的敏感度要 高于气道反应性。故对未合并过敏性鼻炎的缓解 期哮喘患儿进行病情评估时,FeNO 更加敏感。近 年来多名学者认为,通过监测FeNO 值对比使用症 状和肺功能为参考指标来调整吸入激素的治疗量, 前者可使患者吸入激素的剂量减少,病情得到更 好的控制[10]。因此,在哮喘治疗和管理过程中, 引入FeNO 作为气道炎症及病情的监测指标,可以 使哮喘患者得到更理想的管理和临床控制。
同时本研究对合并过敏性鼻炎的哮喘患儿 治疗组与非治疗组进行比较,发现FeNO 数值及 PC20FEV1 数值均出现明显差别,说明合并鼻炎会 导致哮喘患儿气道反应性的明显升高,因此在对 哮喘患儿进行病情评估的时候需考虑到过敏性鼻 炎的影响。
过敏性鼻炎与支气管哮喘息息相关这一现象 已得到广泛的认同,由于受到过敏性体质的影响, 临床上有一大部分哮喘患儿同时合并过敏性鼻炎。 目前也有多项研究认为特应质与FeNO 存在正相 关。Malmberg 等[11] 报道FeNO 升高与特应质相关 (OR=9.0,P<0.001),其中与变应性鼻炎、特应 性皮炎显著相关。国外亦有多项研究证实,鼻炎、 结膜炎、花粉症等,甚至暴露于过敏原后患者的 FeNO 值均会升高[12, 13, 14]。故在进行FeNO 测定时, 对受试者需考虑有无过敏性鼻炎的可能。那么处 于临床缓解期的鼻炎对哮喘患儿的病情评估是否 会有影响?为此本研究对未经过规范化治疗的哮 喘患儿与合并过敏性鼻炎的哮喘患儿进行比较, 结果显示未合并鼻炎的哮喘组PC20FEV1 数值高于 哮喘合并鼻炎组,FeNO 数值差别无统计学意义, 均处于较高水平。说明临床缓解期的鼻炎能够提 高患儿的气道敏感度,而对气道炎症水平的影响 较为微弱,不足以引起FeNO 数值的显著性变化。 因此本研究的结果提示对怀疑有处于临床缓解期鼻炎的哮喘患儿进行病情评估时,FeNO 检测方法 优于支气管激发试验。
综上所述,本研究表明,FeNO 可作为临床缓 解期哮喘患儿非特异性气道炎症控制水平的可靠 指标。在对哮喘患儿进行病情评估的时候需考虑 到过敏性鼻炎的影响。另对怀疑合并有处于临床 缓解期过敏性鼻炎的哮喘患儿进行病情评估时, FeNO 检测方法优于支气管激发试验。
| [1] | Zietkowaki Z, Bodzenta LA, Tomasiak MM. Comparison of exhaled nitric oxide measurement with conveational tests in steroie-naive asthma patients[J]. J Investing Allergol Clin Immunol, 2006, 16(4): 239-246. |
| [2] | Henriksen AH, Sue-Chu M, Holmen TL, et al. Exhaled and nasal NO levels in allergic rhinitis: relation to sensitization, pollen season and bronchial hyper responsiveness[J]. Eur Respir J, 1999, 13(2): 301-306. |
| [3] | Khalili B, Boggs PB, Shi R, et al. Discrepancy between clinical asthma control assessment tools and fractional exhaled nitric oxide[J]. Ann Allergy Asthma Immunol, 2008, 101(2): 124-129 |
| [4] | 中华医学会儿科学分会呼吸学组《中华儿科杂志》编辑委 员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [5] | American Thoraciz Society; European Respiratory Souety. ATS/ ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal oxide, 2005[J]. Am J Respir Grit Care Med, 2005, 171(8): 912-930. |
| [6] | Hamid Q, Springall DR, Riveros-Moreno V, et al. Induction of nitric oxide synthese in asthma[J]. Lancet, 1993, 342(8886-8887): 1510-1513. |
| [7] | Barnes PJ, Liew FY. Nitric oxide and asthmatic inflammation[J]. Immunol Today, 1995, 16(3): 128-130. |
| [8] | Van den Toorn LM, Overbeek S E, de Jongste JC, et al. Airway inflammation is present during clinical remission of atopic asthma[J]. Am J Repir Crit Care Med, 2001, 164(11): 2107-2113. |
| [9] | 殷菊, 申昆玲, 刘世英, 等. 缓解期哮喘患儿的支气管反应 性与小气道功能的关系[J]. 中华儿科杂志, 2004, 42(2): 87-89. |
| [10] | Smith AD, Cowan JO, Brassett KP, et al. Use of exhaled nitric oxide measurement to guide treatment in chronic asthma[J]. N Engl J Med, 2005, 352(21): 2163-2173. |
| [11] | Malmberg LP, Petays T, Haahtela T, et al. Exhaled nitric oxide in healthy nonatopic school-age children: determinants and heightadjusted reference values[J]. Pediatric Pulmonol, 2006, 41(7): 635-642. |
| [12] | Sandrini A, Ferreira IM, Jardim JR, et al. Effect of nasal triamcinolone acetonide on lower airway inflammatory markers in patients with allergic rhinitis[J]. J Allergy Clin Immunol, 2003, 111(2): 313-320. |
| [13] | Duong M, Gauvreau G, Watson R, et al. The effects of inhaled budesonide and formoterol in combination and alone when given directly after allergen challenge[J]. J Allergy Clin Immunol, 2007, 119(2): 322-327. |
| [14] | Prieto L, Gutierrz V, Torres V, et al. Effect of salmeterol on seasonal changes in airway responsiveness and exhaled nitric oxide in pollen-sensitive asthmatic subjects[J]. Chest, 2002, 122(3): 798-805. |
 2014, Vol. 16
2014, Vol. 16


 , 符州
, 符州