2. 河北省儿童医院神经内科, 河北 石家庄 050031;
3. 北京军区总医院附属八一儿童医院内科, 北京 100700
热性惊厥(febrile seizure,FS)是儿童期由急 性发热(排除中枢神经系统感染或损伤)诱发的 惊厥发作。大部分患儿预后良好,2%~10% 患儿 可能发展为无热惊厥或癫癎 。尽管全面性癫癎 伴FS 附加症已有明确的遗传基因,但这些突变 不包含一定谱系之外的大多数病人,因此,寻找某一特定的因素早期预警 FS 患儿的发病及其转 归引起很多学者的兴趣。目前研究发现 FS 与遗 传、免疫、神经递质等多种因素有关,而免疫反 应在 FS 的病理生理过程中起重要作用,特别是发 热前炎症因子在周围或中枢系统的释放,例如: 炎症因子IL-1β 表达的增加和释放增加了惊厥的 易感性,其基因单核苷酸多态性(single nucleotide polymorphism,SNP)与 FS 的发生有关[1]。越来越 多的研究表明,虽然炎症因子基因具有多态性, 但不同的等位基因产生细胞因子的能力不同,且 目前关于 IL-1β 的 SNP 在 FS 的发病中的作用仍 然存在争议[2]。因此,本研究进一步探讨患儿单纯 性FS 发病与 IL-1β 的 SNP 的关联性。
病例组来自2010 年12 月至2011 年12 月河 北省儿童医院神经内科门诊和北京军区总医院附 属八一儿童医院内科病房的141 例汉族FS 患儿, 按照FS 诊断标准[3] 入组,且智能运动发育正常。 141 例患儿中,男94 例,女47 例,年龄6 个月 至 5 岁,其中有FS 家族史患儿78 例,首次出现 FS <1 岁者 33 例,首次惊厥体温<38.5℃者 18 例。 排除标准:患儿脑电图有癫癎 样放电或影像学异 常,惊厥持续时间 >15 min 以上,存在中枢神经 系统感染证据,为局灶型发作形式。对照组为130 例年龄、出生地域与病例组相同的汉族北方健康 儿童,男78 例,女52 例。
经家属同意并签署知情同意 书后,取患儿肘静脉血 2 mL,采用DNA 提取试剂 盒(天根生化科技)提取DNA,并 -20℃ 保存。
本研究以目前有争议的 IL- 1β-511T 的多态性位点rs16944 为研究靶点,利用 SNaPshot SNP 分型技术(美国应用生物公司ABI) 对 IL-1β-511T 基因 rs16944 位点分型。
根据SNP 位点序列信 息,采用Primer 5 软件设计并合成IL-1β-511T 扩增引物和延伸引物(5' → 3'),扩增引物序 列为: 上游 TGGCATTGATCTGGTTCATC,下游 GTTTAGGAATCTTCCCACTT;延伸引物序列为: ttttttttttttttttttCCTTGGGTGCTGTTCTCTGCCT。经过 预扩增、预扩增产物纯化、延伸反应、延伸产物 纯化,最后3730 XL 测序仪检测,将检测得到的 原始数据导入分析软件中进行分析。
采用 Excel 2007 建立数据表,SPSS 16.0 统 计学软件进行数据统计学分析。采用拟合优度 χ2 检验SNP 位点基因型分布频率是否符合 Hardy- Weinberg 平衡。各组等位基因频率和基因型采用 频数和率进行统计描述,各组间等位基因频率和 基因型的分布差异采用 χ2 检验进行比较,logistic 回归分析多态性位点和 FS 之间的相关性,风险度 采用比值比(OR)及其95% 置信区间(CI)表示; P<0.05 为差异有统计学意义。
病例组与对照组的 rs16944 多态性基因型频 率分布符合 Hardy-Weinberg 平衡(P>0.05)。对 rs16944 位点进行 χ2 检验显示,A/A、A/G、G/G 基因型和A、G 等位基因频率在病例组和对照组间 差异无统计学意义(均P>0.05) ,见表1。
| 表 1病例组及对照组的IL-1β-511T 基因型及等位基因情况 [ 例(%)] |
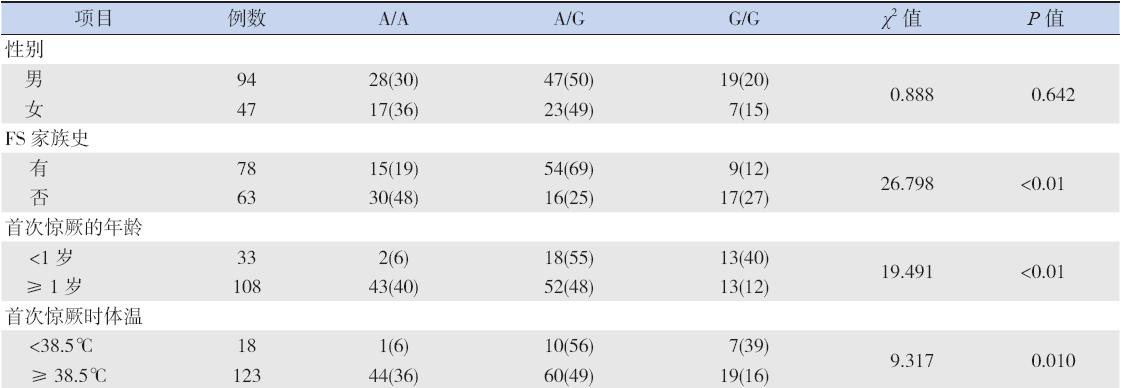
对病例组 141 例患儿分别进行 logistic 回归 分析多态性位点rs16944 和临床资料之间的相关 性发现,男女儿童的基因型差异无统计学意义 (χ2= 0.888,P>0.05),对是否有FS 家族史(χ2= 26.798,P<0.01、首次惊厥发作年龄是否 < 1 岁(χ2= 19.491,P<0.01)、首次发作时的体温(χ2=9.317, P<0.05)3 种情况进行基因型分析,差异均具有统 计学意义,见表2。
| 表 2病例组不同临床特征患儿的IL-1β-511T 基因分型情况 [ 例(%)] |
FS 是由发热引起并只发生在儿童期的惊厥形 式,施旭来等[3] 对温州地区的 FS 发病研究显示, 首次发病年龄多在 6 个月至 3 岁,患病率 3.67%。 单纯性 FS 通常被认为是一良性过程。早在1990 年 Helminen 等[4] 首次提出发热患儿的前炎症因 子 IL-1β 反应增强可能对惊厥发生起重要作用, 发热过程中,IL-1β 这一诱导发热的内源性致热 源是血脑屏障通透性破坏的重要扳机点,成为惊 厥发病机制中重要的辅助因素。动物研究发现在 惊厥发生前 IL-1β 血浆中浓度明显升高,并与海 马及其他区域的神经元表达的IL-1R 结合,提高 了神经元兴奋性和降低了惊厥的阈值,从而诱导 惊厥发生[5],而在FS 患儿海马和下丘脑处 IL-1β 明显升高[1],提示 FS 可能起源于海马。而 IL-1β 的 SNP 与脂多糖处理后的单核细胞产生更多的 IL- 1β 有关,研究认为,其 SNP 参与了 FS 的发生[1], 特别是发现 IL-1β-511T 这个能促进细胞因子表达 的变异体与儿童 FS 有关,一直以来由于研究方法、 人群的不同,对于 IL-1β 是否能真正作为 FS 预警 标记依然存在着争议[2, 6, 7, 8, 9]。特别是在上世纪60 年 代发现难治性颞叶癫癎患儿中大约 50%~70% 的病 人儿童期都有 FS 病史[1],因此,患儿是否发生 FS 或其最终能否转化为癫癎的决定因素成为研究的 热点。目前研究普遍认为遗传因素、免疫反应、 神经递质可能共同参与了 FS 的病理生理过程,多 个基因的 SNP 可能是其发病的基因学基础。
SNP 是人类可遗传的变异中最常见的一种, 占所有已知多态性的 90% 以上,关联研究是目前 研究复杂性多基因疾病的主要方法。本研究应用 关联研究的方法,针对具有争议的IL-1β-511T rs16944 位点采用 SNaPshot 技术确定中国北方 FS 儿童样本基因型,结果显示位点 rs16944 的A/A、 A/G、G/G 基因型和 A、G 等位基因频率在病例组 和对照组间差异无统计意义,说明SNP16944 与北 方汉族FS 患儿的惊厥发作无关联。而本研究 FS 组中首次FS 的年龄是否< 1 岁、首次惊厥时的体 温是否< 38.5℃及是否有FS 家族史的患儿其 IL- 1β-511T 的SNP 的基因型存在显著差别,表现为 年龄< 1 岁、首次惊厥体温< 38.5℃和有FS 家族 史的患儿基因型以 A/G 为主,因此,推测IL-1β- 511T 的 SNP 虽不能作为提示 FS 发病的标记基因, 但其基因型的不同可能与患儿FS 的发生及预后有 关。
由于 IL-1β-511T 的 SNP 与 FS 关联研究的 结论存在不一致[10, 11, 12],其原因可能与FS 是由多个 SNP 位点通过连锁作用对氨基酸的编码剪切、基因的表达以及蛋白质结构等各个环节发生影响,进 而调节基因功能有关,研究单个基因的单一 SNP 可能会割裂多基因多 SNP 相互之间对 FS 的共同影 响[13];其次,散发的单纯性 FS 遗传倾向分析较为 复杂,尚不能够通过精细的基因型和基因频率的 差异对 FS 表型分类的风险性进行解释说明,而家 系、种群、表型等误差也可能造成假阴性的结果。 因此,研究单个 SNP 与多基因疾病的关系需要选 择更多的样本包括更大的家系,其准确性有待于 进一步扩大样本求证,而人类全基因组SNP 关联 研究的实现,也许才能真正了解FS 的基因学特点。
总之,早期检测患儿的 IL-1β-511T 基因型对 FS 的发生及转归有一定的预警作用,推测有家族 史、起病早、较低体温出现惊厥发作的患儿,发 展成癫癎的可能性较大。
| [1] | Heida JG, Moshe SL, Pittman QJ. The role of interleukin-1beta in febrile seizures[J]. Brain Dev, 2009, 31(5): 388-393. |
| [2] | Nakayama J. Progress in searching for the febrile seizure susceptibility genes[J]. Brain Dev, 2009, 31(5): 359-365. |
| [3] | 施旭来, 林忠东, 叶秀云, 等. 温州地区小学生热性惊厥流 行病学调查[J]. 中国当代儿科杂志, 2012, 14(2): 128-130. |
| [4] | Helminen M, Vesikari T. Increased interleukin-1 (IL-1) production from LPS-stimulated peripheral blood monocytes in children with febrile convulsions[J]. Acta Paediatr Scand, 1990, 79(8-9): 810-816. |
| [5] | Dube CM, Brewster AL, Baram TZ. Febrile seizures: mechanisms and relationship to epilepsy[J]. Brain Dev, 2009, 31(5): 366-371. |
| [6] | Virta M, Hurme M, Helminen M. Increased frequency of interleukin-1 beta (-511) allele 2 in febrile seizures[J]. Pediatr Neurol, 2002, 26(3): 192-195. |
| [7] | Nur BG, Sahinturk D, Coskun M, et al. Single nucleotide polymorphism and production of IL-1β and IL-10 cytokines in febrile seizures[J]. Neuropediatrics, 2012, 43(4): 194-200. |
| [8] | Chou IC, Lin WD, Wang CH, et al. Interleukin (IL)-1beta, IL-1 receptor antagonist, IL-6, IL-8, IL-10, and tumor necrosis factor alpha gene polymorphisms in patients with febrile seizures[J]. J Clin Lab Anal, 2010, 24(3): 154-159. |
| [9] | Kira R, Torisu H, Takemoto M, et al. Genetic susceptibility to simple febrile seizures: interleukin-1beta promoter polymorphisms are associated with sporadic cases[J]. Neurosci Lett, 2005, 384(3): 239-244. |
| [10] | Wu ZQ, Sun L, Sun YH, et al. Interleukin 1 beta-511 C/T gene polymorphism and susceptibility to febrile seizures: a metaanalysis[J]. Mol Biol Rep, 2012, 39(5): 5401-5407. |
| [11] | Tsai FJ, Hsieh YY, Chang CC, et al. Polymorphisms for interleukin 1 beta exon 5 and interleukin 1 receptor antagonist in Taiwanese children with febrile convulsions[J]. Arch Pediatr Adolesc Med, 2002, 156(6): 545-548. |
| [12] | Matsuo M, Sasaki K, Ichimaru T, et al. Increased IL-1beta production from dsRNA-stimulated leukocytes in febrile seizures[J]. Pediatr Neurol, 2006, 35(2): 102-106. |
| [13] | Chabris CF, Hebert BM, Benjamin DJ, et al. Most reported genetic associations with general intelligence are probably false positives[J]. Psychol Sci, 2012, 23(11): 1314-1323. |
 2014, Vol. 16
2014, Vol. 16