支气管哮喘(bronchial asthma),简称哮喘, 是儿童时期最常见的慢性呼吸道疾病,反复喘息 严重威胁儿童的身心健康,因此研究哮喘的发病 机制尤为重要。信号转导和转录激活因子(signal transduction and activator of transcription,STAT) 是 与靶基因调控区DNA 结合的新型转录因子家族。 在介导多种细胞因子及趋化因子的信号转导中发 挥着重要作用。STAT6 是STAT 家族成员之一,近 年来发现STAT6 在哮喘的发生发展中起到重要作 用;血清类黏蛋白1 样蛋白3(orosomucoid 1-like 3,ORMDL3)基因是与儿童哮喘的发生有密切关 系的哮喘易感基因[1],其编码位于内质网上由153 个氨基酸组成的跨膜蛋白,目前ORMDL3 与气道 重塑的关系仍不明了;本研究探讨哮喘小鼠气道 重塑中STAT6 和ORMDL3 表达情况和布地奈德 (budesonide,BUD)的干预作用,为临床治疗提供 依据。
SPF 级4~6 周龄BALB/c 雌性小鼠30 只,体 重20~25 g,购于河南省动物实验中心,遵照随机 数字法分为对照组、哮喘组、BUD 干预组,每组 各10 只。
鸡卵清蛋白(ovalbumin,OVA) 购于美国 Sigma 公司,BUD 混悬液购于阿斯利康公司, ELISA 试剂盒购于北京博奥森生物技术有限公司, TRIzol、反转录试剂盒及PCR 试剂盒均购于法国 Transgene 公司。
参照Yang 等[2] 报道的制备哮喘小鼠模型的 方法并略加改进,哮喘组和BUD 组小鼠分别于 第1、8、15 天腹腔内注射OVA- 氢氧化铝混悬液 0.2 mL(其中OVA 20 μg,氢氧化铝2 mg)致敏各 1 次,对照组应用生理盐水0.2 mL 替代致敏液行 腹腔注射。从第22 天开始激发,哮喘组和BUD 组 应用1%OVA 5 mL 雾化吸入,每次30 min,每天1 次,共14 d;BUD 组在每次激发前30 min 应用生 理盐水溶解的BUD 雾化液5 mL(含BUD 1 mg) 进行雾化治疗[3];对照组应用生理盐水5 mL 替代 1%OVA 进行雾化吸入。抗原激发后小鼠出现打喷 嚏、烦躁不安、呼吸加快、抓耳挠腮、竖毛等表 现提示哮喘模型成功。
参照文献[4],各组小鼠分别在末次激发后 24 h 内,乙醚麻醉,开胸结扎左肺门,取左肺至 于液氮中保存,用于RT-PCR 及ELISA 检测,经 右心室插管至肺动脉,应用生理盐水对右肺进行 匀速灌注、冲洗至肺组织变为白色,然后应用4% 甲醛进行内固定,取右肺中叶浸入4% 的甲醛中行 外固定24 h,石蜡包埋,3 μm 切片,行苏木精- 伊红(HE)染色和Masson 染色,于400 倍光镜下 观察气道壁病理学改变。
称取各组小鼠肺组织,加入适量生理盐水冰 浴下用匀浆器制成匀浆,4 000 r/min 离心10 min, 取上清。考马斯亮蓝法(Bradford)检测肺组织匀 浆中总蛋白含量。采用ELISA 法检测肺组织匀浆 中IL-13 含量,操作过程按ELISA 试剂盒说明进行。 所测IL-13 含量用肺组织匀浆的总蛋白含量校正。
采用TRIzol 提取各组小鼠肺组织总RNA,用 反转录试剂盒反转录为cDNA,设计引物并扩增目 的基因片段。STAT6 上游引物:5'-ACGGCTCTATGTTGACTTTC- 3',下游引物:5'-AGATGCTGTTTCCCTTCC- 3',片段长度:185 bp;ORMDL3 上游引物: 5'-TGTTGGCTTGTTTACCCTC-3',下游引物:5'-CCCTTGCTCAGAACTCCC- 3',片段长度:327 bp;以 GAPDH 作为内参, 上游引物:5'-CCACTTGAAGGGTGGAGC- 3',下游引物:5'-TGAAGTCGCAGGAGACAA- 3', 片段长度:530 bp。反应体系为 50 μL, 其中cDNA 2 μL、上下游引物各1 μL、 缓冲液( 含Mg2+) 5 μL、dNTPs 4 μL、DNA 聚 合酶1 μL、ddH2O 36 μL。反应条件:94 ℃ 预 变性3 min;94 ℃ 变性30 s,57 ℃(STAT6)/ 55 ℃(ORMDL3、GAPDH) 退火30 s,72 ℃ 延 伸1 min,共35 个循环;72℃延伸10 min。扩增 后产物在1.5% 琼脂糖凝胶上进行电泳,采用凝 胶电泳成像系统分别测定STAT6、ORMDL3 和内 参GAPDH 的灰度值, 并以STAT6、ORMDL3 与 GAPDH 的比值作为其mRNA 的表达水平。
采用SPSS 17.0 统计软件包对数据进行统计学 分析,计量资料用均数± 标准差(x±s)表示, 多组间均数的比较采用单因素方差分析,组间两 两比较采用LSD-t 法;两个因素之间相关性采用 Pearson 相关分析,P<0.05 为差异有统计学意义。
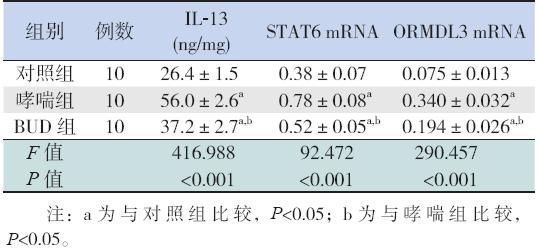
对照组小鼠气道壁结构完整,厚度正常,上 皮细胞排列正常,可见少量胶原纤维。哮喘组气 道结构紊乱,表现为明显的支气管壁增厚、杯状 细胞化生、黏液分泌增多、胶原纤维增生,可见 大量炎性细胞浸润。BUD 组气道结构紊乱情况较 哮喘组减轻,炎性细胞较哮喘组减少。见图 1。
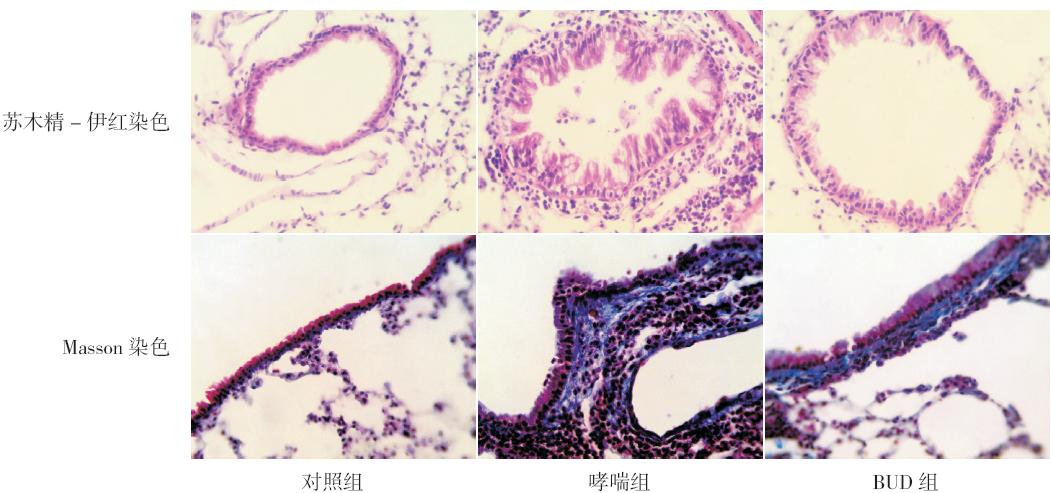 |
图 1 各组小鼠气道组织病理学变化 (×400) 苏木精- 伊红染色结果示:对照组气道壁厚度正常,可见散在 炎症细胞;哮喘组气道壁增厚,可见大量炎性细胞浸润;BUD 组气道壁厚度较哮喘组减轻,炎性细胞较哮喘组减少。Masson 染色结果示:对照组上皮细胞下可见少量胶原纤维;哮喘组上皮细胞下可见较多胶原纤维;BUD 组胶原纤维较哮喘组明显减少, 图中胶原纤维显蓝色。 |
哮喘组小鼠肺组织中IL-13 水平及STAT6 和 ORMDL3 mRNA 的表达均明显高于BUD 组及对照 组(均P<0.05),同时BUD 组肺组织中IL-13 水 平及STAT6 和ORMDL3 mRNA 的表达亦均明显高 于对照组(均P<0.05),见表1,图 2~3。
| 表 1各组小鼠肺组织中IL-13 水平以及STAT6 和 ORMDL3 mRNA 表达比较 (x±s) |
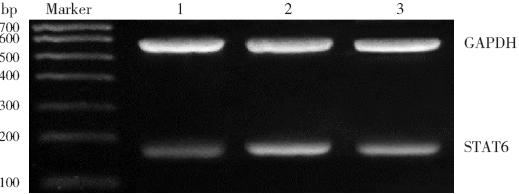 |
图 2RT-PCR 检测各组小鼠肺组织STAT6 mRNA 的 表达变化 1:对照组;2:哮喘组;3:BUD 组。 |
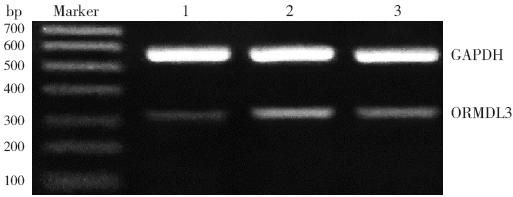 |
图 3 RT-PCR 检测各组小鼠肺组织ORMDL3 mRNA 的表达变化 1:对照组;2:哮喘组;3:BUD 组。 |
哮喘组STAT6 mRNA 及ORMDL3 mRNA 的表 达水平呈正相关(r=0.676,P=0.032)。
支气管哮喘以气道高反应、气道炎症及气道 重塑为主要表现。气道重塑主要病理特征包括气 管平滑肌增厚、上皮下纤维化、粘液腺的增生、 新生血管的形成等。既往认为气道重塑发生于重 度哮喘或哮喘病程晚期,有研究显示在轻度患者 及儿童哮喘的早期就存在气道重塑[5]。气道重塑是 不可逆的气道结构改变,因此如何早期控制气道 重塑是目前研究的重点。本实验应用OVA 连续激 发14 d 制备哮喘模型,哮喘组病理学改变可见气 道壁厚度增加、炎症细胞增多、气道上皮下胶原 纤维沉积,提示成功建立气道重塑模型。
STAT 是一种能与靶基因调控区DNA 结合 的新型转录因子家族。多种细胞因子通过JAK/ STAT6 途径而诱导目的基因表达,发挥其生物学 作用。STAT6 是Th2 型淋巴细胞特异性转录因子, 可被IL-4、IL-13 等激活后促使Th2 细胞的增殖、 分化,同时促进释放IL-4、IL-5、IL-13 等多种Th2 型细胞因子,导致Th2 细胞功能亢进,而Th1/Th2 细胞亚群功能失衡是引起哮喘发病的主要原因[6]。 Blease 等[7] 证明与野生型小鼠(STAT6+/+)相比, 基因敲除小鼠(STAT6-/-)产生Th2 型细胞因子的 功能降低,同时气道高反应性明显减轻。本研究 中哮喘组IL-13 水平及STAT6 mRNA 的表达较对 照组增高。推断经过过敏原反复刺激后小鼠体内 IL-13 分泌增加,进而激活JAK/STAT6 途径,上调STAT6 的表达,促进粘液分泌、平滑肌细胞增生、 胶原的生成,参与气道重塑。
ORMDL3 基因是2007 年定义的与儿童哮喘的 发生有密切关系的易感基因,定位于17 号染色体 长臂21 号位(17q21)上,其编码位于内质网膜 的跨膜蛋白,但是其功能及参与哮喘的机制目前 还尚不清楚。已有研究证明ORMDL3 在炎症性肠 病[8]、I 型糖尿病[9] 等发病机制中起到重要作用, 表明ORMDL3 可能参与了免疫系统失调。应用过 敏原和细胞因子(IL-4 或IL-13)刺激气道上皮细 胞后ORMDL3 mRNA 的表达增加[10]。ORMDL3 的 表达产物可以抑制内质网的Ca2+ATP 酶(SERCA) 活性并导致内质网中Ca2+ 浓度减少,同时增加非 折叠蛋白反应(unfolded protein response,UPR)[11, 12]。 研究显示内质网中钙泵调节异常可能是平滑肌过 度释放与气道重塑有关细胞因子的基础[13];UPR 为一种内源性炎症途径,可激活NF-κB 信号通 路,而受NF-κB 调控的基因产物囊括了大多数参 与哮喘气道炎症及重塑的主要细胞因子和炎症介 质[14]。本研究结果显示哮喘组IL-13 水平及 ORMDL3 mRNA 较对照组增高,推断IL-13 可能通 过激活气道上皮细胞的内质网系统,导致ORMDL3 及其表达产物增加,释放细胞因子及炎症介质参 与气道重塑。Miller 等[10] 发现ORMDL3 表达高 度依赖STAT6 水平,Qiu 等[15] 证明STAT6 调控 ORMDL3 的表达,也可能通过激活JAK/STAT6 信 号通路上调ORMDL3 的表达。
本实验结合病理学哮喘组气道结构改变, RT-PCR 结果显示STAT6 和ORMDL3 mRNA 表达 较对照组升高,且二者呈正相关,推断STAT6 和 ORMDL3可能共同参与了哮喘小鼠气道重塑过程, 且二者起协同作用。BUD 为吸入性糖皮质激素, 是目前治疗哮喘的有效药物,副作用较全身应用 糖皮质激素少。BUD 组STAT6 及ORMDL3 mRNA 表达较哮喘组降低,BUD 可能通过下调STAT6 及 ORMDL3 的表达减轻气道重塑。可能的原因有: (1)BUD 可能通过抑制IL-13 的表达,直接下调 STAT6、ORMDL3 表达。(2)BUD 可能通过抑 制IL-13 的分泌,间接抑制JAK/STAT6 通路,下 调STAT6、ORMDL3 的表达。(3)BUD 在体内对 STAT6 及ORMDL3 的表达有直接调控作用。
| [1] | Moffatt MF, Kabesch M, Liang L, et al. Genetic variants regulating ORMDL3 expression contribute to the risk of childhood asthma[J]. Nature, 2007, 448(7152): 470-473. |
| [2] | Yang G, Volk A, Petley T, et al. Anti-IL-13 monoclonal antibody inhibits airway hyperresponsiveness, inflammation and airway remodeling[J].Cytokine, 2004, 28(6): 224-232. |
| [3] | 卞芳芳, 王军, 路名明, 等. RORrt 在支气管哮喘小鼠肺组 织中的表达及BUD 对其抑制作用[J]. 中国当代儿科杂志, 2012, 14(8): 628-631. |
| [4] | 栾斌, 王亚哲, 张艳丽, 等. 1, 25-(OH)2D3 对哮喘小鼠肺内 TIM-4 表达的影响[J]. 中国当代儿科杂志, 2013, 15(1): 67-70. |
| [5] | Malmstrom K, Pelkonen AS, Malmberg LP, et al. Lung function, airway remodeling and inflammation in symptomatic inflants:outcome at 3 years[J]. Thorax, 2011, 66(2): 157-162. |
| [6] | Goleva E, Hauk PJ, Boguniewicz J, et al. Airway remodeling and lack of bronchodilator response in steroid-resistant asthma[J]. J Allergy Clin Immunol, 2007, 120(5): 1065-1072. |
| [7] | Blease K, Schuh JM, Jakubzick C, et al. Stat6-deficient mice develop airway hyperresponsiveness and peribronchial fibrosis during chronic fungal asthma[J]. Am J Pathol, 2002, 160(2): 481-490. |
| [8] | Barrett JC, Hansoul S, Nicolae DL, et al. Genome-wide association defines more than 30 distinct susceptibility loci for Crohn's disease[J]. Nat Genet, 2008, 9(8): 955-962. |
| [9] | Barrett JC, Clayton DG, Concannon P, et al. Genome-wide association study and meta-analysis find that over 40 loci affect risk of type 1 diabetes[J]. Nat Genet, 2009, 9(6): 703-707. |
| [10] | Miller M, Tam AB, Cho JY, et al. ORMDL3 is an inducible lung epithelial gene regulating metalloproteases, chemokines, OAS, and ATF6[J]. Proc Natl Acad Sci U S A, 2012, 109(41): 16648-16653. |
| [11] | Cantero-Recasens G, Fandos C, Rubio-Moscardo F, et al. The asthma-associated ORMDL3 gene product regulates endoplasmic reticulum-mediated calcium signaling and cellular stress[J]. Hum Mol Genet, 2010, 19(1): 111-121. |
| [12] | McGovern DP, Gardet A, Torkvist L, et al. Genome-wide association identifies multiple ulcerative colitis susceptibility loci[J]. Nat Genet, 2010, 9(4): 332-337. |
| [13] | Mahn K, Hirst SJ, Ying S, et al. Diminished sarco/endoplasmic reticulum Ca2+ ATPase (SERCA) expression contributes to airway remodelling in bronchial asthma[J]. Proc Natl Acad Sci U S A, 2009, 106(26): 10775-10780. |
| [14] | 陶莉, 等. 内质网应激在酒精性肝病中的作用[J]. 临床肝胆 病杂志, 2013, 29(7): 547-549. |
| [15] | Qiu R, Yang Y, Zhao H, et al. Signal transducer and activator of transcription 6 directly regulates human ORMDL3 expression[J]. FEBS J, 2013, 280(9): 2014-2026. |
 2014, Vol. 16
2014, Vol. 16