哺乳动物的神经细胞在有氧代谢的过程中 不断产生过氧化物,其中间降解产物为过氧化 氢(H2O2),属活性氧族(ROS)。生理浓度的 H2O2 对于细胞信号的传导是必要的[1],然而高浓 度的H2O2 通过产生氧自由基诱导氧化应激,如不 及时清除,将导致神经细胞的损伤和死亡[2]。胰岛 素样生长因子-1(IGF-1)是一种多肽类神经营养 因子,它对哺乳动物神经系统的发育至关重要[3]。 IGF-1 及其受体的表达在神经分化过程中达到顶 峰,IGF-1 通过激活其受体,促进神经细胞生存、 分化、增殖、突触外伸以及髓鞘形成[4],IGF 系统 对活体动物神经细胞的生存和增殖十分重要[5]。 本实验室前期的研究证明,ROS 可诱导神经细胞 产生IGF-1 抵抗,从而使IGF-1 对神经细胞的保护 作用大打折扣[6]。那么,本实验中将进一步探讨 IGF-1 对氧化应激后神经细胞保护作用是否存在时 间窗。
IGF-1 购自澳大利亚Gropep 公司;LDH 试剂 盒购自美国Promega 公司;H2O2、血小板衍生生 长因子、胰酶抑制剂、B27、DMSO、胎牛血清、 DNA 酶I、多聚赖氨酸、TEMED、过硫酸胺、 吐温-20 和MTT 试剂均购自美国Sigma 公司;NeuN 单克隆 抗体购自美国Millipore 公司;P-Akt(Ser473)、 Akt、GFAP 单克隆抗体均购自美国Cell Signaling Technology 公司;APC(cc-1) 单克隆抗体购自 美国Calbiochem 公司;0.25% 胰酶、0.05% 胰 酶-EDTA、DMEM 培养基、Neurobasal A 培养基、 碱性成纤维细胞生长因子(bFGF)和谷氨酰胺购 自美国Invitrogen 公司。
新生大鼠皮层神经元细胞、少突胶质细胞、 星型胶质细胞原代培养技术按本实验室建立的 方法[7] 操作。NeuN 是神经元细胞中的标志性蛋 白,APC(cc-1)是少突胶质细胞的标志性蛋白, GFAP 是星型胶质细胞的标志性蛋白,采用免疫细 胞化学SP 法分别对各标志性蛋白表达进行检测(工 作液浓度为1 : 200),以鉴定不同细胞。
吸弃接种于48 孔细胞培养皿中的上清,用 高糖DMEM 清洗细胞1 遍,更换培养液为高糖 DMEM,分别给予细胞不同浓度(0、40、60 μM) H2O2 处理24 h,每个浓度处理组设4 个复孔,采用 LDH 检测试剂盒对细胞的损伤程度进行检测,操作 步骤严格按照试剂盒说明书进行。实验重复3 次。
用PBS 配制终浓度为10 μg/μL 的MTT 液,调 pH 值为7.4,注意避光。吸弃接种于48 孔细胞培 养皿中的上清,用高糖DMEM 清洗细胞1 遍,更 换培养液为高糖DMEM,分别给予细胞不同浓度 (0、40、60 μM)H2O2 处理24 h,每个浓度处理 组设4 个复孔,避光条件下每孔加入10 μg/μL 的 MTT 5 μL,37℃孵育4 h,吸弃培养上清液,每孔 加入250 μL DMSO,摇晃5 min,充分溶解,酶联 免疫检测仪,570 nm 处读取吸光度(OD)值。实 验重复3 次。
待经鉴定后的原代新生大鼠皮层神经元细胞 生长至亚融合状态(约第6~7 天)时,吸弃细胞 培养皿中的上清,用高糖DMEM 清洗细胞1 遍, 更换培养液为高糖DMEM,分别给予细胞0~80 μM 浓度的H2O2 处理不同时间,再次更换培养液为新 鲜高糖DMEM 后,随机分为对照组和IGF-1 干预组, 向IGF-1 干预组中加入25 ng/mL 的IGF-1,对照组 不做任何处理,两组于45 min 后提取蛋白检测相 应各指标变化,整个过程不再更换培养液。每个不 同浓度亚组平行提取3 个蛋白样本,实验重复3 次。 参考文献[6] 裂解细胞提取蛋白,按每泳道 加总蛋白20 μg 进行SDS-PAGE 凝胶电泳,湿式 电转移至硝酸纤维素滤膜上,室温封闭30 min, 加入相应的P-Akt(Ser473) 或Akt 单克隆抗体 (1 : 1 000)4℃孵育过夜,TBST 洗膜3 次,加入 相应的辣根过氧化物酶标记的二抗(1 : 2 000), ECL 增强化学发光显色系统(Thermo Scientific) 显色5 s~5 min。应用GDS-8000 型凝胶成像分析系 统(UVP,England)扫描并进行半定量分析。
采用SPSS 15.0 统计软件对数据进行统计学分 析,计量资料以均数± 标准差(x±s)表示,多 组均数间的比较采用方差分析,组间两两比较采 用LSD-t 检验。P<0.05 为差异有统计学意义。
与未经H2O2 处理组相比,H2O2(40、 60 μM)处理细胞24 h 后,大脑皮层神经元、少突 胶质细胞及星形胶质细胞上清液中LDH 活性均有 升高;但神经元细胞上清液中LDH 活性升高更为 显著,与少突胶质细胞和星形胶质细胞相比,差 异有统计学意义(均P<0.01)见图 1。
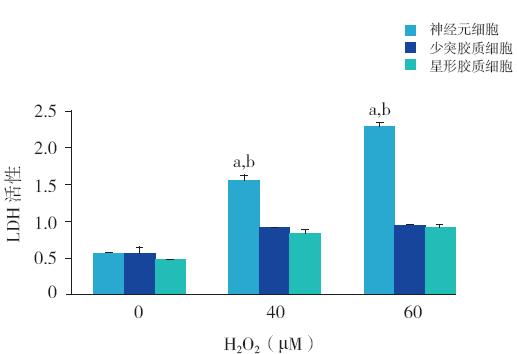 |
图 1 LDH 法检测不同浓度H2O2 对新生大鼠神经元、 少突胶质细胞及星形胶质细胞损伤程度的影响 注:a 为 与未经H2O2 处理组比较,P<0.05;b 为与同浓度H2O2 处理的少突 胶质细胞或星形胶质细胞比较,P<0.01(n=4)。 |
与未经H2O2 处理组相比,H2O2(40、 60 μM)处理细胞24 h 后,大脑皮层神经元、少 突胶质细胞及星形胶质细胞活力均有下降;但神 经元细胞活力下降更为显著,与少突胶质细胞 和星形胶质细胞相比,差异有统计学意义(均 P<0.01)见图2。
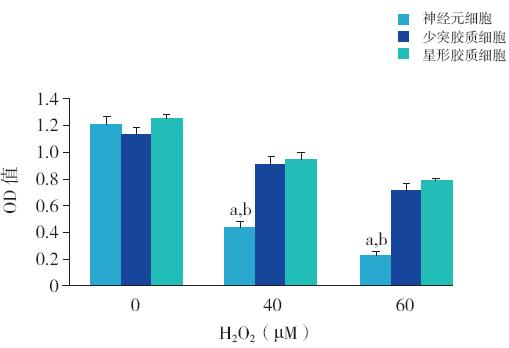 |
图 2 MTT 法检测不同浓度H2O2 对新生大鼠神经元、 少突胶质细胞及星形胶质细胞活力的影响 注:a 为与未 经H2O2 处理组比较,P<0.05;b 为与同浓度H2O2 处理的少突胶质 细胞或星形胶质细胞比较,P<0.01(n=4)。 |
在新生大鼠皮层神经元中施加不同浓度的 H2O2 处理5 min,相比于未经H2O2 处理组,可见 Akt(Ser473)磷酸化水平呈H2O2 浓度依赖性降低 (均P<0.01);而经不同浓度的H2O2 处理1 h 后, Akt(Ser473)磷酸化活性全部恢复至未经H2O2 处 理组水平(均P>0.05)。见图3。
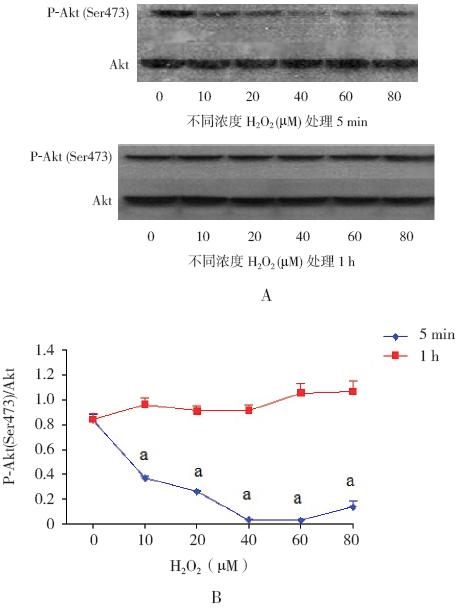 |
图 3 两组治疗前后预测成年身高及接近成年身高的比较 PAHBA0指治疗前预测成年身高,PAHBA1指治疗后停药时预测成年身高,NAH指观察结束时接近成年身高。 |
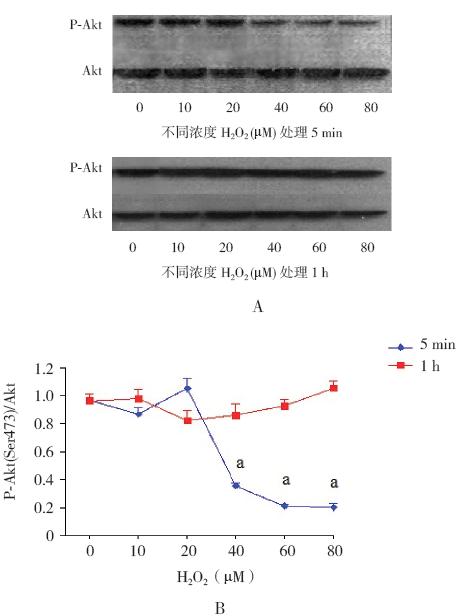 |
图 4 两组治疗前后预测成年身高及接近成年身高的比较 PAHBA0指治疗前预测成年身高,PAHBA1指治疗后停药时预测成年身高,NAH指观察结束时接近成年身高。 |
在目前神经变性疾病的研究中,氧化应激导 致细胞死亡的机制尤为重要[8]。氧化应激被定义为 ROS 的产生和清除持续失衡。在生理条件下,作 为调控自身氧化还原状态的手段,细胞能够精密 的控制内源性的ROS 水平[9],由ROS 产物介导的 细胞死亡很大程度上是由于干扰了调控机制。细 胞内生理剂量下的ROS 对于多种信号通路的传导 是必须的,然而过量的ROS 则可从生理状态转化 为氧化应激从而介导细胞死亡。大脑皮层主要由 神经元细胞和神经胶质细胞构成,其中胶质细胞 主要包括星型胶质细胞及少突胶质细胞。神经元 细胞是最重要的皮层功能细胞,它对氧化应激等 损伤尤为敏感,是氧化应激所致脑损伤的主要靶 细胞[10]。本实验研究表明高浓度的H2O2 对星型胶 质细胞及少突胶质细胞的损伤作用均不明显,而 对神经元细胞则会产生明显损伤。说明神经系统 在氧化应激状态下,恰好是其最重要的功能细胞- 神经元细胞受损最重,这也正好解释了为什么氧 化应激会导致中枢神经系统的严重损伤。
本研究着眼于ROS 对IGF-1 信号的影响和其 在神经细胞死亡中扮演的角色。因为IGF-1 神经 营养通路中有许多组分都对细胞的氧化还原状态 十分敏感,它们极易被过量的ROS 影响。研究表 明,缺氧缺血发生后,循环中IGF-1 水平降低且神 经细胞表达IGF-1 下降,使不成熟神经细胞的生存 和成熟缺乏必要的营养支持[11],理论上此时立即 补充外源性的IGF-1 有效。然而在新生大鼠动物模 型,即使在缺氧缺血发生后立即心腔内注射大剂 量的IGF-1,3 d 后其脑损伤仅能减少40% 左右[12]; 而在缺氧缺血后恢复期的24 h 和48 h 皮下注射 IGF-1 则可显著减轻缺氧缺血诱导的不成熟鼠脑损 伤,并且在2 个月后明显改善它们的记忆和认知 行为发展[13]。这些新的发现提出一个问题,为什 么在缺氧缺血发生后立即给予IGF-1 治疗反而不如 延迟治疗效果明显?那么,我们有理由猜测IGF-1 的治疗作用存在一个时间窗。Akt 作为一种众所周知的致存活因子,对神经细胞的生存和功能成熟 是必须的。研究表明,大多数的神经变性疾病均 与Akt 的缺乏有关,本实验也发现:当缺氧缺血 发生后,Akt 的激活受到抑制,若立即施予IGF- 1,此时存在的急性氧化应激将诱导神经细胞发生 IGF-1 抵抗,Akt 无法激活,故IGF-1 治疗效果不佳; 而在其恢复期,Akt 的活性得以恢复,可被重新激 活,神经细胞又逐渐恢复对IGF-1 的敏感性,此时 再施予IGF-1,则可大量激活Akt 以发挥其最佳神 经保护作用。这些研究结果证实:IGF-1 对皮层神 经元细胞氧化应激损伤的保护作用存在时间窗。 这些发现或将为临床上选择最佳的神经细胞保护 药物干预时间提供理论依据。
志谢:本实验大部分内容在美国印弟安那州立大 学医学院儿科Wei-Hua Lee 教授实验室完成,衷心感谢 Wei-Hua Lee 教授给予的指导和帮助。
| [1] | Maruta T, Noshi M, Tanouchi A, et al, H |
| [2] | Dringen R, Pawlowski PG, Hirrlinger J. Peroxide detoxification by brain cells[J]. J Neurosci Res, 2005, 79(1-2): 157-165. |
| [3] | Alonso A, Gonzalez C. Neuroprotective role of estrogens: relationship with insulin/IGF-1 signaling[J]. Front Biosci(Elite Ed), 2012, 4: 607-619. |
| [4] | Netchine I, Azzi S, Le Bouc Y, et al. IGF-1 molecular anomalies demonstrate its critical role in fetal, postnatal growth and brain development[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(1): 181-190. |
| [5] | Hodge RD, D'Ercole AJ, O'Kusky JR. Insulin-like growth factor-I (IGF-I) inhibits neuronal apoptosis in the developing cerebral cortex in vivo[J]. Int J Dev Neurosci, 2007, 25(4): 233-241. |
| [6] | 刘伟, 常立文, 李文斌, 等. 氧化应激抑制胰岛素样生长因 子1 对新生大鼠皮层神经元细胞的保护作用[J]. 中华儿科杂 志, 2012, 50(6): 455-459. |
| [7] | Zhong J, Lee WH. Hydrogen peroxide attenuates insulinlike growth factor-1 neuroprotective effect, prevented by minocycline[J]. Neurochem Int, 2007, 51(6-7): 398-404. |
| [8] | Pereira MD, Ksiazek K, Menezes R. Oxidative stress in neurodegenerative diseases and ageing[J]. Oxid Med Cell Longev, 2012, 2012: 796360. |
| [9] | Shi DY, Xie FZ, Zhai C, et al. The role of cellular oxidative stress in regulating glycolysis energy metabolism in hepatoma cells[J]. Mol Cancer, 2009, 8: 32. |
| [10] | Jin H, Kanthasamy A, Anantharam V, et al. Transcriptional regulation of pro-apoptotic protein kinase Cdelta: implications for oxidative stress-induced neuronal cell death[J]. J Biol Chem, 2011, 286(22): 19840-19859. |
| [11] | Beresewicz M, Majewska M, Makarewicz D, et al. Changes in the expression of insulin-like growth factor 1 variants in the postnatal brain development and in neonatal hypoxia-ischaemia[J]. Int J Neurosci, 2010, 28(1): 91-97. |
| [12] | Brywe KG, Mallard C, Gustavsson M, et al. IGF-I neuroprotection in the immature brain after hypoxia-ischemia, involvement of Akt and GSK3beta?[J]. Eur J Neurosci, 2005, 21(6): 1489-1502. |
| [13] | Zhong J, Zhao L, Du Y, et al. Delayed IGF-1 treatment reduced long-term hypoxia-ischemia induced brain damage and improved behavior recovery of immature rats[J]. Neurol Res, 2009, 31(5): 483-489. |
 2014, Vol. 16
2014, Vol. 16


