幽门螺杆菌(Helicobacter pylori,Hp)感染是 儿童消化不良、慢性胃炎和消化性溃疡的主要病 因,也是胃恶性肿瘤及胃黏膜相关淋巴样组织淋 巴瘤的主要危险因子,WHO 将其分类为恶性肿瘤 的相关因子[1]。据报道全球近50% 的人感染该细 菌[2]。目前,西方国家发病率在不断下降,而在 发展中国家还有很高的发病率。根据欧洲和北美 出版的指南以及我国Hp 诊治指南推荐使用的一线 治疗方案均为质子泵抑制剂(proton pump inhibitor, PPI)联合阿莫西林和克拉霉素[3]。然而联合应用 抗生素及长期使用PPI 所引起的抗生素耐药及其 相关副作用是导致治疗失败的主要原因。为了提 高以PPI 为基础的一线三联疗法的根除率,以下 临床治疗方案值得提倡,主要包括延长治疗时间、 使用新的抗生素(如喹诺酮类)、初次选择四联 疗法或在三联疗法中增加益生菌等[2]。
由于儿童特殊人群用药的限制,增加益生菌 成为最佳选择。益生菌属于微生物,口服后,在 肠道微生态产生有益作用并改善健康状态。体外 研究发现益生菌有如下作用机制:(1)益生菌产 生的乳酸可以引起胃内pH 值下降,从而对抗Hp 产生的尿素酶;(2)乳酸杆菌产生的细菌素可以 杀死Hp;(3)乳酸杆菌可以阻止Hp 在胃上皮细 胞定植;(4)粘蛋白的产生和免疫反应可稳定胃 黏膜的屏障功能[4]。此外,亦有研究表明益生菌能 减少抗生素的副作用和改善治疗的耐受性[5]。布拉 氏酵母菌是一种从荔枝皮分离出来的天然抵抗抗 生素、胃酸及蛋白酶分解的非致病性酵母菌。布 拉氏酵母菌可通过抑制核因子-κB(NF-κB)易位 入细胞核从而发挥抗菌和抗炎活性,并能刺激胃 肠道固有免疫[6]。故本次研究选取三联疗法联合布 拉氏酵母菌的治疗方法,探讨该方法对Hp 根除率 及其副作用的影响。 1 资料与方法 1.1 研究对象
采用前瞻性随机对照研究。2011 年5~11 月 在我院消化内科门诊及住院部就诊的符合诊断标 准的Hp 感染患儿240 例,其中男164 例(68.3%), 女76 例(31.7%),采用随机数字表法将患儿分 为三联疗法组和益生菌组,每组120 例。 1.2 诊断标准
Hp 阳性诊断标准:胃窦部黏膜尿素快速酶 及13C 呼气试验结果阳性定义为Hp 感染。所有 患儿均接受电子胃十二指肠镜(OLYMPUS GIF- 260QA)检查,排除食管炎、腐蚀性胃十二指肠炎 及胃十二指肠肿瘤。排除标准:(1)大于18 岁; (2)有胃手术史;(3)对本研究使用的药物过敏; (4)就诊前4 周使用抗生素、PPI、H2 受体阻滞剂、 铋盐或益生菌;(5)有心、肺、肾功能不全者。 研究对象均由监护人签署知情同意书。 1.3 治疗方法
三联疗法组给予奥美拉唑[0.7~0.8 mg/(kg . d ), Qd]、阿莫西林[40 mg/(kg . d),Tid] 以及克拉霉素 [15 mg/(kg . d),Bid];益生菌组在三联疗法组 的基础上添加布拉氏酵母菌冻干制剂(250 mg, Bid,亿活,法国百科达制药厂生产)。两组治疗 总疗程均为14 d。所有患儿家属报告治疗期间任 何副作用,并提供记录所有副反应的清单,如上 腹痛、腹泻、食欲减退、便秘和口腔炎等,且给 每个副反应的严重程度分级:轻度(影响可以观 察到,但可以被忽略),中度(影响有时干扰日 常活动)、重度(影响持续干扰日常活动)。 1.4 疗效判断及副作用评估
服用完80% 以上的药物认为是完成了疗程, 患儿的副作用在完成疗程后进行评估。Hp 成功根 除是指在治疗停止后4 周行13C 呼气试验阴性。 1.5 统计学方法
采用SPSS 13.0 统计软件对数据进行统计学分 析,计量资料采用均数± 标准差(x±s)表示, 两组间比较采用t 检验;计数资料以率(%)表示, 组间比较采用卡方检验。P<0.05 为差异有统计学 意义。 2 结果 2.1 两组患儿一般资料比较
两组患儿在年龄、性别及疾病诊断方面差异 均无统计学意义(均P>0.05),见表1。
| 表 1 两组患儿一般情况比较 |
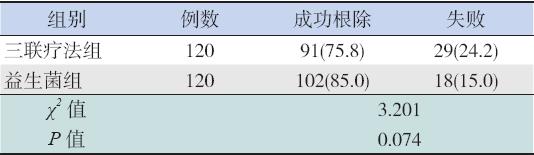
所有患儿都遵照治疗方案进行治疗,无失访 病例。三联疗法组的Hp 根除率为75.8%,而益生 菌组为85.0%,虽然益生菌组根除率高于三联疗法组,但差异无统计学意义(P<0.05),见表2。
| 表 2 两组Hp 根除率的比较 [ 例(%)] |
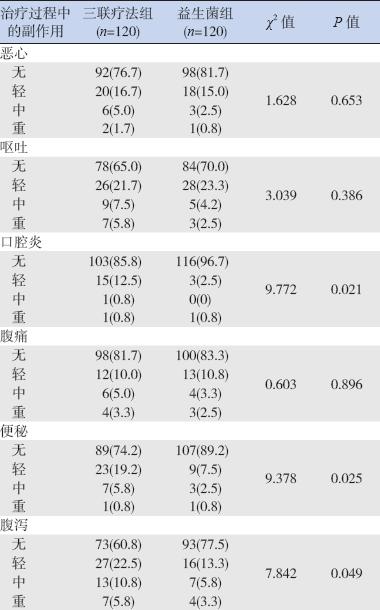
治疗期间记录的副反应中,益生菌组的患儿 口腔炎、便秘及腹泻发生频率均明显低于三联疗法 组(均P<0.05);其他副作用如恶心、呕吐和腹 痛在两组间差异均无统计学意义(均P>0.05)。 见表3。
| 表 3两组治疗期间副作用的比较 [ 例(%)] |
Hp 是儿童胃炎、消化性溃疡的主要病因,有 胃部症状的儿童中感染率达65%,虽然在发达国 家呈明显下降趋势,但在发展中国家仍呈较高的 患病率[7]。Hp 感染在儿童期常常可引起胃炎、胃 溃疡及十二指肠溃疡等,成年后甚至会引起恶性 肿瘤,所以根除Hp 势在必行[8]。目前标准根除性 治疗方案为三联疗法,即PPI 联合两种抗生素(阿 莫西林+ 克拉霉素),疗程为7~14 d[3]。目前使用 传统三联疗法对Hp 的根除治愈率出现下降趋势, 特别是在儿童患者,大约30%~40% 的病人根除失 败[9]。因此,众多学者试图寻找到更好的方法改善 根除率。这些方法包括延长治疗时间或使用新的 抗生素、四联疗法、序贯疗法和增加益生菌等。 其中益生菌能有效减少或阻止Hp 感染。然而,由 于微生态制剂在体外有很高的有效性而在体内无 效,因此临床研究就显得更为重要。本组研究采 用前瞻性随机研究,结果显示,添加布拉氏酵母 菌组根除率增加约10%,但与传统的三联疗法比 较,差异无统计学意义,这与Gotteland 等[10] 的报 告一致。近期一份meta 分析结论也表明,治疗方 案中添加益生菌最高的Hp 根除率为84%,而未加 组最高的根除率为75%[11]。因此,布拉氏酵母菌 作为唯一干预因素,其根除Hp 的有效性还有待进 一步研究。还有其他类似研究报告,如增加益生 菌和乳铁蛋白,但目前还没有对这些研究的全面 评价[12]。
对于根除过程中的副作用,有针对成人的研 究结果显示,布拉氏酵母菌在腹泻、便秘及口腔炎方面的副作用明显减少,耐受性好于治疗组[13]。 这可能是由于抗生素相关副作用(腹胀、恶心、 腹泻、便秘、食欲减退和呕吐)跟肠道内微生物 数量及种类的改变有关。抗Hp 的标准三联疗法可 能会引起肠道菌群紊乱,产生相应的副作用;而 在抗Hp 时补充益生菌,则可以稳定微生态环境, 还可以阻止一些最常见的抗生素相关性副作用, 如腹泻。有学者对益生菌联合治疗Hp 的相关文章 进行了meta 分析,结果显示添加益生菌组副作用 的发生率为25%,而对照组为39%,特别是与腹 泻的相关性,全球的OR 值是0.44[14]。本研究结果 也证实了增加布拉氏酵母菌组能有效降低口腔炎、 便秘和腹泻的发生率,与三联疗法组比较差异有 统计学意义。
综上所述,三联疗法联合布拉氏酵母菌并不 能显著提高Hp 的根除率,但能明显降低治疗过程 中口腔炎、便秘及腹泻的发生率,值得推广以提 高Hp 根除治疗时患儿的耐受性和依从性。
| [1] | 储波, 蒋丽蓉, 周莎, 等. 幽门螺杆菌菌株类型与儿童上消 化道疾病的关系[J]. 中国当代儿科杂志, 2007, 9(3): 201-204. |
| [2] | Go MF, Crowe SE. Virulence and pathogenicity of Helicobacter pylori[J]. Gastroenterol Clin North Am, 2000, 29(3): 649-670. |
| [3] | Malfertheine P, Megraud F, O' Morain C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht Ⅲ Consensus Report[J]. Gut, 2007, 56(6): 772-781. |
| [4] | Lionetti E, Indrio F, Pavone L, et al. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature[J]. Helicobacter, 2010, 15(2): 79-87. |
| [5] | Scaccianoce G, Zullo A, Hassan C, et al. Triple therapies plus different probiotics for Helicobacter pylori eradicaton[J]. Eur Rev Med Pharmacol Sci, 2008, 12(4): 251-256. |
| [6] | Vandenplas Y, Brunser O, Szajewska H. Saccharomyces boulardii in childhood[J]. Eur J Pediatr, 2009, 168(3): 253-265. |
| [7] | Rowland M, Daly L, Vaughan M, et al. Age-specific incidence of Helicobacter pylori[J]. Gastroenterology, 2006, 130(1): 65-72. |
| [8] | Wizla-Derambure N, Michaud L, Ategbo S, et al. Familial and community environmental risk factors for Helicobacter pylori infection in children and adolescents[J]. J Pediatr Gastroenterol Nutr, 2001, 33(1): 58-63. |
| [9] | Oderda G, Shcherbakov P, Bontems P, et al. European Pediatric Task Force on Helicobacter pylori. Results from the pediatric European register for treatment of Helicobacter pylori (PERTH)[J]. Helicobacter, 2007, 12(2): 150-156. |
| [10] | Gotteland M, Poliak L, Cruchet S, et al. Effect of regular ingestion of Saccharomyces boulardii plus inulin or Lactobacillus acidophilus LB in children colonized by Helicobacter pylori[J]. Acta Pediatrica, 2005, 94(12): 1-6. |
| [11] | de Bortoli N, Leonardi G, Ciancia E, et al. Helicobacter pylori eradication: a randomized prospective study of triple therapy versus triple therapy plus lactoferin and probiotics[J]. Am J Gastroenterol, 2007, 102(5): 951-956. |
| [12] | 童锦禄, 冉志华, 木沈骏, 等. 益生菌联合标准三联疗法根 除幽门螺杆菌的荟萃分析[J]. 胃肠病学, 2007, 11(11): 662-666. |
| [13] | Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardiisupplementation on Helicobacter pylori eradication rates and side effects during treatment[J]. Aliment Pharmacol Ther, 2010, 32(9): 1069-1079. |
| [14] | Tong JL, Ran ZH, Shen J, et al. Meta-analysis: the effect of supplementation with probiotics on eradicationrates and adverse events during Helicobacter pylori eradication therapy[J]. Aliment Pharmacol Ther, 2007, 25(2): 155-168. |
 2014, Vol. 16
2014, Vol. 16