2. 福州儿童医院儿科, 福建 福州 350001
噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH) 是一种致命的 失控而无效的免疫应答所致的过度炎症反应疾[1]。该病好发于儿童,表现为T 细胞和巨噬细胞 过度增生和活化,从而导致显著的高细胞因子 症[2]。该病主要特征是NK 细胞、CD8+ 细胞毒 T 细胞(CTL)毒性功能的下降甚至缺失[3]。未 经治疗的HLH 是致命的,而即使获得积极的治疗, HLH 死亡率依然很高[1]。HLH 包括原发性HLH 和继发性HLH 两种形式。原发性HLH 通常发生 于原发基因异常的患者,目前已经证实的9 个相 关基因包括PRF1、UNC13D、STX11、STXBP2、 RAB27A、LYST、AP3B1、SH2D1A 以及XIAP。 其中X 连锁凋亡抑制蛋白(X-linked inhibitor ofapoptosis,XIAP) 基因于2006 年首次被发现与 HLH 有关[4]。本研究采用直接测序技术,对65 例 HLH 患儿进行XIAP 基因突变筛查,并初步探讨 基因型与临床表现之间的关系。 1 资料与方法 1.1 研究对象
选取2009 年1 月至2012 年12 月于广西医 科大学第一附属医院儿科就诊的HLH 患儿65 例 为研究对象,其中男37 例,女28 例;平均年龄 6±4 岁。HLH 诊断及治疗标准为国际组织细胞协 会推荐的HLH-2004 方案[3, 5]。同时选取于我院行 健康体检的儿童70 例作为对照组,其中男40 例, 女30 例;平均年龄6±3 岁。两组间年龄、性别 比较差异均无统计学意义(均P>0.05)。 1.2 主要试剂与仪器
QIAamp DNA Blood Mini Kit(Qiagen,德国); 2×Master Mix(北京天根生化科技公司,中国); 引物合成(上海生工生物工程技术服务有限公司, 中国);多通道PCR 扩增仪(PTC-220,美国); 恒温水浴箱(DK-420,中国);电泳仪(DYY-86 型, 中国);Gel Doc EQ 凝胶成像系统(Bio-RAD,美国); 序列分析仪(ABI3100 Genetic Analyzer,美国)。 1.3 标本采集及基因组DNA 提取
采集两组儿童的外周静脉抗凝血1 mL,按 QIAamp DNA Blood Mini Kit 说明书提取基因组 DNA,于-20℃冰箱保存。 1.4 引物设计
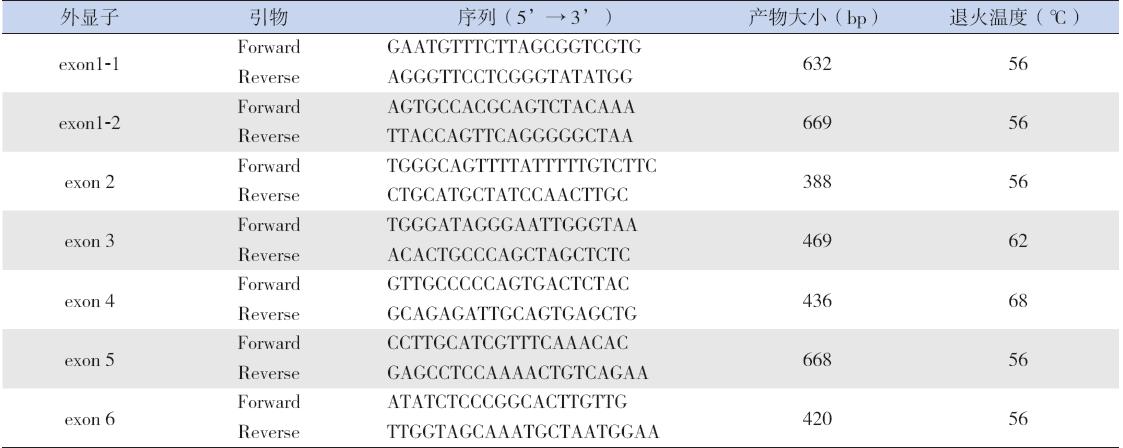
应用Primer 及Oligo 软件对人XIAP 基因序列 (GenBank 序列号:NC_000023.10)进行引物设计, 具体引物序列见表1。
| 表1 扩增XIAP 基因的引物序列 |
PCR 反应总体积为50 μL, 其中包含 2×Master Mix 25 μL、10 μmol/L 上下游引物各 2 μL、DNA 模板2 μL,加ddH2O 至50 μL。反应条件: 94℃预变性4 min;94℃变性30 s,退火(温度参 照表1)30 s,72℃延伸30 s,共35 个循环;72℃ 再延伸7 min。取5 μL PCR 产物在2% 琼脂糖凝 胶中电泳,条件为100 V 电泳35 min,以1 000 bp DNA Ladder 为相对分子质量标准。将凝胶置于Gel 成像系统进行成像并分析。 1.6 PCR 产物测序
采用序列分析仪(ABI3100 Genetic Analyzer)对 所有PCR 产物进行直接测序,测序结果与人XIAP 基因序列(GenBank 序列号:NC_000023.10)进行 比对。 1.7 统计学分析
采用SPSS 17.0 统计软件对数据进行统计学分 析,基因型和等位基因频率采用率(%)表示,组 间比较采用四格表χ2 检验和R×C 列联表χ2 检验,
P<0.05 为差异有统计学意义。 2 结果 2.1 XIAP 基因PCR 产物
XIAP 基因7 个外显子扩增后,经2% 琼脂糖 凝胶电泳后于凝胶成像分析仪观察,可见各外显 子清晰整齐的条带,以DNA marker 为参照,所扩 增的产物均为所需目的条带,见图 1。
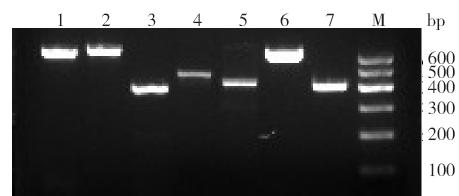 |
图 1 XIAP 基因PCR 扩增产物电泳条带图 M: marker;1~7 分别为外显子1-1、1-2、2~6。 |
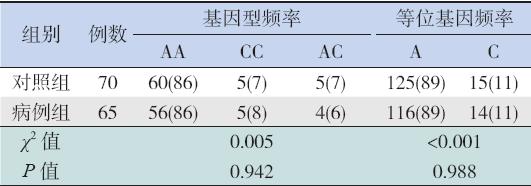
在对XIAP 基因7 个外显子的PCR 扩增产物 进行测序后,用Chromas 软件和GenBank 数据库 中人XIAP 基因序列进行比对,结果全部外显子 编码区均未发现突变点。仅在外显子5 发现1 个 非同义单核苷酸多态性(SNP)位点:rs5956583 (42009A>C)。 2.3 两组rs5956583 基因型频率和等位基因频率 比较
rs5956583 基因型频率和等位基因频率在HLH 患儿和对照组间的分布差异均无统计学意义(均 P>0.05),见表2。
| 表 2 两组rs5956583 基因型和等位基因频率比较 [ 例(%)] |
XIAP 是凋亡抑制因子家族成员之一,其蛋 白结构包含3 个BIR 区和1 个C 端的RING 区。 XIAP 最主要的生物学功能是抑制caspase 活性而达到抗凋亡的作用。此外,XIAP 还在其它多条信 号通路中发挥作用,例如NF-κB、c-Jun N 端激酶 1、转化生长因子-β、核酸结合齐聚区域蛋白以 及E3 泛素酶活性等[6, 7, 8, 9, 10]。2006 年,Rigaud 等[4] 首 次报道在HLH 病人中发现XIAP 基因突变。至今 为止全世界共报道49 例,来自25 个无关家庭。 病例报道来自欧洲28 例、美国12 例和日本9 例。 XIAP 基因定位于染色体Xq25,全长约54 Kb,含 6 个外显子,编码497 个氨基酸。迄今,已发现能 导致发病的XIAP 基因突变25 种,包括位移突变 8 种、无义突变7 种、缺失突变5 种及错义突变5 种。 在XIAP 突变的HLH 患者中可以检测到不同程度 的XIAP 蛋白表达下降甚至缺失。
原发性HLH 包括家族性HLH(FHL)和其它 免疫缺陷相关的HLH。FHL 按照致病基因不同分 为五个亚型:FHL1(位于9q21.3-22 的未知基因)、 FHL2(PRF1)、FHL3(UNC13D)、FHL4(STX11) 及FHL5(STXBP2)。此外还有其它未知基因参 与了HLH 的发生。据Marsh 等[11] 报道,XIAP 基 因突变患者有90% 发生HLH,且50% 的患者有阳 性家族史,认为该病应该定义为X 连锁的FHL 更 为准确,并建议在HLH 患者中筛选XIAP 基因突 变患者。过去通常认为EB 病毒感染是HLH 的触 发点,但XIAP 基因突变患者中却不一定发生EBV 感染,提示也许存在着其他不明抗原刺激能够诱 发XIAP 表现型的发生[12]。
据报道,FHL 各亚型的发病率在不同民族之 间有不同。Molleran 等[13] 报道在日本FHL3 发病 率几近等于或略高于FHL2。Zur 等[14] 报道在德国 FHL2 与FHL3 发病率相等,在FHL 中约占25%。 有相当多的FHL2 病例报道来自非裔美国人、白 人、西班牙人以及亚洲人,但到目前为止在美国 人中尚未见FHL3 病例的报道。在土耳其人中, FHL 的主要亚型是FHL2,而STX11 基因突变所致 的FHL4 型也出现在该民族;与之相反的是,在非 土耳其人包括中国人中尚未发现FHL4 型[14]。目 前尚无各民族HLH 病例XIAP 突变发生率的确切 数据统计,但推测其很可能与其它类型HLH 类似, 即该基因突变在原发性HLH 所占比例亦随民族不 同而各异。本研究对65 例中国HLH 患儿进行了 XIAP 基因突变检测,在外显子编码区未发现任何 致病突变,表明XIAP 基因突变可能仅限于特定的民族和地域。此外,也不排除部分由于非编码区 异常导致的蛋白表达下降,可待进一步蛋白水平 的研究,如流式细胞术检测XIAP 蛋白表达水平等。 FHL 年发病率约0.12/10 万,若未经治疗其 中位生存期仅2 个月。研究已经发现了影响该病 发生发展及预后的诸多因素,其中基因异常是重 要的因素之一[15]。本研究在该组人群发现了1 个 位于编码区的SNP 位点rs5956583。此前曾有报 道该SNP 与特发性周期性发热易感性相关,423Q 携带者与高分泌的促炎因子TNF-α 有关[16]。本 研究首次在中国儿童中进行XIAP 基因rs5956583 (42009A>C)分型,检测到AA、CC、AC 三种基 因型均在该人群中占有一定比例。但未发现各基 因型与儿童HLH 易感性的明显关系,提示其可能 并不参与儿童HLH 的发病过程。未来还需要更多 的对XIAP 其它多态性位点的研究,以期发现能够 揭示儿童HLH 易感性、治疗效果及预后有意义的 分子生物学标志。
| [1] | Janka GE. Hemophagocytic syndromes[J]. Blood Rev, 2007, 21(5): 245-253. |
| [2] | Filipovich AH. Hemophagocytic lymphohistiocytosis and related disorders[J]. Curr Opin Allergy Clin Immunol, 2006, 6(6):410-415. |
| [3] | Henter JI, Horne AC, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. |
| [4] | Rigaud S, Fondaneche MC, Lambert N, et al. XIAP deficiency in humans causes an X-linked lymphoproliferative syndrome[J]. Nature, 2006, 444(7115): 110-114. |
| [5] | 中华医学会儿科学分会血液学组. 噬血细胞性淋巴组织细胞 增生症诊疗建议[J]. 中华儿科杂志, 2012, 50(11): 821-825. |
| [6] | Lewis J, Burstein E, Reffey SB, et al. Uncoupling of the signaling and caspase-inhibitory properties of X-linked inhibitor of apoptosis[J]. J Biol Chem, 2004, 279(10): 9023-9029. |
| [7] | Birkey Reffey S, Wurthner JU, Parks WT, et al. X-linked inhibitor of apoptosis protein functions as a cofactor in transforming growth factor-beta signaling[J]. J Biol Chem, 2001, 276(28): 26542-26549. |
| [8] | Hofer-Warbinek R, Schmid JA, Stehlik C, et al. Activation of NF-kappa B by XIAP, the X chromosome-linked inhibitor of apoptosis, in endothelial cells involves TAK1[J]. J Biol Chem, 2000, 275(29): 22064-22068. |
| [9] | Krieg A, Correa RG, Garrison JB, et al. XIAP mediates NOD signaling via interaction with RIP2[J]. Proc Natl Acad Sci U S A, 2009, 106(34): 14524-14529. |
| [10] | Bauler LD, Duckett CS, O'Riordan MX. XIAP regulates cytosolspecific innate immunity to Listeria infection[J]. PLoS Pathog, 2008, 4(8): e1000142. |
| [11] | Marsh RA, Madden L, Kitchen BJ, et al. XIAP deficiency: a unique primary immunodeficiency best classified as X-linked familial hemophagocytic lymphohistiocytosis and not as X-linked lymphoproliferative disease[J]. Blood, 2010, 116(7): 1079-1082. |
| [12] | Filipovich AH, Zhang K, Snow AL, et al. X-linked lymphoproliferative syndromes: brothers or distant cousins?[J]. Blood, 2010, 116(18): 3398-3408. |
| [13] | Molleran Lee S, Villanueva J, Sumegi J, et al. Characterization of diverse PRF1 mutations leading to decreased natural killer cell activity in North American families with haemophagocytic lymphohistiocytosis[J]. J Med Genet, 2004, 41(2): 137-144. |
| [14] | Zur Stadt U, Schmidt S, Kasper B, et al. Linkage of familial hemophagocytic lymphohistiocytosis (FHL) type-4 to chromosome 6q24 and identification of mutations in syntaxin 11[J]. Hum Mol Genet, 2005, 14(6): 827-834. |
| [15] | 陆文娴, 罗建明. 儿童噬血细胞性淋巴组织细胞增生症的预 后因素分析[J]. 中国当代儿科杂志, 2012, 14(8): 593-597. |
| [16] | Ferretti M, Gattorno M, Chiocchetti A, et al. The 423Q polymorphism of the X-linked inhibitor of apoptosis gene influences monocyte function and is associated with periodic fever[J]. Arthritis & Rheumatism, 2009, 60(11): 3476-3484. |
 2014, Vol. 16
2014, Vol. 16