2. 许昌市中心医院新生儿科, 河南 许昌 461000
新生儿脑损伤是新生儿期最常见、最严重的 疾病之一,是导致新生儿死亡和儿童致残的常见 原因[1]。随着新法复苏技术的普及以及产科分娩技 术水平的提高,新生儿窒息的发生率明显下降[2], 但新生儿脑损伤及其后遗症的发生率未见降低, 却有增加的趋势,其原因可能与近年来早产儿的 出生率大幅增加,而亚低温治疗等早期干预方案 仅适合于足月新生儿脑损伤,早产儿脑损伤目前 尚无公认有效的治疗措施有关[3, 4, 5]。围生期感染是 导致早产及早产儿脑损伤的重要原因,其机制可 能与细胞因子、免疫反应、兴奋性氨基酸等介导 的神经细胞凋亡有关。近年来,随着对促红细胞 生成素(erythropoietin,EPO)功能的进一步探索和 认识,EPO 在脑损伤的保护作用方面也逐渐引起 人们关注,但其机制尚未完全明确。本研究采用 细菌脂多糖(lipopolysaccharide,LPS)诱导法建立 新生鼠脑损伤模型[6],采用新生细胞标记物-5- 溴 脱氧尿嘧啶核苷(BrdU)及细胞凋亡标志物—活 化的半胱氨酸天冬氨酸蛋白酶-3(Caspase-3), 探讨EPO 对新生大鼠感染性脑损伤后神经干细胞 发生区域—海马齿状回颗粒下层神经细胞增生与 凋亡的影响。 1 材料与方法 1.1 主要试剂
兔抗大鼠活化的Caspase-3 多克隆抗体和兔 抗大鼠BrdU 多克隆抗体及两步法免疫组化试剂盒 (SV002)均购于北京博奥森生物技术有限公司, DAB显色剂购自北京中杉金桥生物技术有限公司, 重组人EPO 及重组人EPO 空白对照品(仅含同等 分量的辅料成分)(cEPO)均由成都地奥集团提供。 1.2 实验动物及分组
26 只清洁级2 日龄(P2)Sprague-Dawley(SD) 新生大鼠[ 许可证号:SCXK(豫)2010-0002] 由 河南省实验动物中心提供,雌雄不限,体重6.9± 0.4 g。在光照- 黑暗各交替12 h 条件下,由母鼠 自由喂养,采用随机数字表法随机分成对照组(8 只,腹腔注射等容积的生理盐水+ 等容积的EPO 空白对照品)、LPS 组(9 只,0.6 mg/kg LPS+ 等 容积的EPO 空白对照品)及EPO 干预组(9 只, 0.6 mg/kg LPS+5 000 U/kg EPO)3 组, 各组均连 续注射5 d(即P2~P6)。通过连续腹腔注射5 d LPS(0.6 mg/kg)建立生后感染导致新生鼠脑损伤 模型[6]。各组新生大鼠同时腹腔注射50 mg/kg 的 BrdU,每日1 次,连续注射5 d,并于最后1 次注 药后24 h(即P7)称重,灌注取脑,采用苏木素- 伊红(HE)染色法计数海马齿状回单位面积神经 细胞数,应用免疫组化法检测脑组织海马齿状回 颗粒下层BrdU 和活化Caspase-3 蛋白的表达情况。 1.3 标本制作
3 组新生大鼠于最后一次用药后24 h(P7), 采用乙醚吸入麻醉,取仰卧位,剑突下呈V 字形 剪开皮肤,剪断两侧胸廓暴露心脏,右心耳处剪口, 将连有头皮针的注射器刺入心尖处;生理盐水灌 注,再用4% 多聚甲醛灌注至躯体变硬苍白,打开 颅腔快速剥取脑组织,浸泡固定于4% 多聚甲醛中 48 h,梯度酒精脱水和二甲苯透明,石蜡包埋。以 海马部位为标志,冠状位连续切片,每隔20 张留 取1 张,切片厚度为5 μm,烤片后备用。 1.4 BrdU 及活化Caspase-3 免疫组织化学法
石蜡切片常规二甲苯脱蜡,梯度酒精水化, 蒸馏水洗3 次后,枸橼酸钠微波加热修复8 min (中高火3 min + 低火5 min),冷却后蒸馏水洗 2 次,滴加3% 过氧化氢温育10 min,蒸馏水、 PBS 各冲洗2 遍,加封闭血清温育10 min,甩干 分别滴加一抗(兔抗大鼠BrdU 或兔抗大鼠活化的 Caspase-3,1 : 50),37℃ 温浴1 h,4 ℃ 过夜。其 中BrdU 染色时,在滴加封闭血清及一抗前,需使 DNA 变性,即加 2 M HCl,37℃ 30 min,滴加 0.1 M 硼酸盐缓冲液(pH 8.5),10 min,PBS 洗 3 次, 各5 min。PBS 冲洗后滴加生物素化二抗 37 ℃ 温 育30 min,PBS 洗 3 次,DAB 显色 2~3 min,苏木 素复染 6~8 s,盐酸酒精分化,自来水冲洗,脱水、 透明、中性树胶封片。PBS 代替一抗作阴性对照。 1.5 HE 染色
石蜡切片脱蜡,梯度酒精水化,滴加苏木精 液染色2 min;蒸馏水洗1 min,盐酸酒精分化, 蒸馏水洗2~3 s,滴加伊红溶液染色2 min;脱水、 透明、封片。 1.6 细胞计数
采用Biosens Digital Imaging Systems V1.6 分析 系统进行细胞计数。随机计数每张切片海马齿状 回部位5 个100 μm×100 μm 面积内神经细胞数并计算其均值,每一动物取5 张切片再取均值,作 为该动物海马齿状回单位面积内神经细胞数量 ( 个/mm2)。每一动物取5 张切片,计数每张 切片相同视野下海马齿状回颗粒下层BrdU 与活 化 Caspase-3 的阳性细胞数,取其均值作为该动物 BrdU 和活性Caspase-3 阳性细胞数,阳性细胞均表 现为细胞核呈深棕色染色。 1.7 统计学分析
采用SPSS 17.0 统计学软件对数据进行统计学 分析,计量资料用均数± 标准差(x±s)表示, 多组资料间比较采用单因素方差分析,组间两两 比较采用LSD 法。P<0.05 为差异有统计学意义。 2 结果 2.1 各组新生大鼠体重比较
各组新生大鼠在P2 时,体重差异无统计学意 义(P>0.05);P7 时,各组新生大鼠体重差异明显, EPO 干预组和LPS 组均低于对照组,差异有统计 学意义(P<0.05);但EPO 干预组与LPS 组比较 差异无统计学意义(P>0.05)。见表1。
| 表 1各组新生大鼠不同日龄体重变化的比较 (x±s,g) |
HE 染色显示对照组海马齿状回细胞排列整 齐、层次清晰;LPS 组细胞界限不清、层次紊乱, 细胞数目减少;EPO 干预组较LPS 感染组细胞层 次清晰。EPO 干预组、LPS 组脑组织海马齿状回 单位面积内神经细胞数均低于对照组,差异有统 计学意义(P<0.05),但EPO 干预组与LPS 组比 较差异无统计学意义(P>0.05),见表2。
| 表 2 各组脑组织BrdU、活化Caspase-3 阳性细胞及神 经细胞数的比较 (x±s) |
海马齿状回颗粒下层BrdU 阳性细胞和活化 Caspase-3 阳性细胞表现为细胞核呈深棕色染色。 各组新生大鼠脑组织中均可见BrdU 阳性细胞,其 数量3 组间比较差异有统计学意义(P<0.05)。 EPO 干预组BrdU 阳性细胞数较LPS 组增多,但仍 较对照组减少(P<0.05)。各组新生大鼠脑组织均 可见活化Caspase-3 阳性细胞,EPO 干预组活化的 Caspase-3 阳性细胞数较LPS 组减少,但仍多于对 照组(P<0.05)。见图 1、表2。
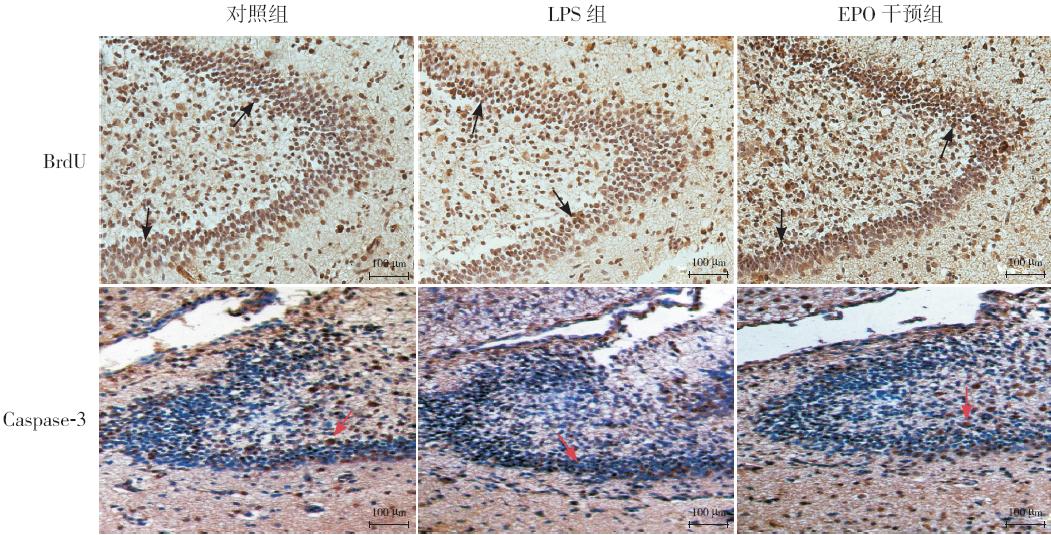 |
图 1 各组新生大鼠海马齿状回颗粒下层BrdU 及活化Caspase-3 的阳性表达(×400) E PO 干预组大鼠 大脑海马齿状回颗粒下层BrdU 表达较LPS 组明显增多,但较对照组减少,BrdU 阳性细胞胞核呈棕褐色(黑色箭头所示)。 EPO 干预组大鼠大脑海马齿状回颗粒下层活化Caspase-3 的表达较LPS 组减少,但仍多于对照组,活化Caspase-3 阳性细胞表 现为胞核呈深棕色(红色箭头所示)。 |
围生期感染是导致早产及早产儿脑损伤的重 要原因,感染所致早产儿脑损伤防治的研究越来 越引起人们的关注。早产儿脑损伤与中枢神经系 统对疾病的易感性、感染诱发的固有免疫应答、 全身性暴露于细菌感染而引起的脑组织炎症反应 有关[7]。目前,LPS 致脑损伤法是新生鼠生后感染 性脑损伤的常用动物模型[8, 9],简单易行,故本研 究采用2 日龄新生鼠连续5 d 腹腔注射0.6 mg/kg LPS 制成生后感染性脑损伤的动物模型[6],探讨 EPO 对感染性新生大鼠脑损伤的保护作用及其相 关机制。
EPO 是一种多功能细胞因子,除具有促进未 成熟前体红细胞增生作用外,近年来研究发现脑 组织内可见EPO 表达,且其与神经干细胞的增生、 分化以及存活有关[10]。在损伤和应激因素作用下, 脑组织内源性EPO 短暂性表达增加作为神经营养 因子减轻脑损伤程度或作为免疫调节因子及干细 胞增生刺激因子促进脑组织的结构与功能重建[11]。 由于损伤后脑组织结构与功能的重建是一个慢性 过程,脑组织内需维持较高EPO 水平以促进脑功 能恢复;然而,外源性EPO 是大分子物质,能否 通过血脑屏障成为关注焦点。动物实验及人体试 验证实外源性EPO 能透过血脑屏障进入脑组织, 对脑损伤有保护作用,显示出较好的应用前景[12, 13]。 外源性EPO 干预可起到神经保护作用,这已在许 多研究中证实。Kumral 等[14] 采用新生大鼠缺氧缺 血性脑损伤(HIBD)模型发现模型制备成功后即 刻腹腔注射小剂量EPO 可以减少脑损伤的体积, 减少神经细胞凋亡数目,说明EPO 对HIBD 有保 护作用,其机制之一可能为减少神经细胞凋亡。 Shen 等[15] 通过建立孕鼠宫内感染模型发现,新生 大鼠生后立即给予3 000~5 000 IU/kg 的EPO 对感 染所致少突胶质细胞损伤、反应性星形胶质化以 及轴突损伤有保护作用,可减轻神经纤维的损伤。 Mizuno 等[16] 采用3 日龄新生鼠脑室周围白质软化 (PVL)模型发现,在缺氧缺血(HI)前15 min 给予小剂量rhEPO 能有效保护HI 后脑损伤。上述 研究[14, 15, 16] 均表明EPO 对脑损伤有保护作用。故本 研究主要探讨EPO 对感染性新生大鼠脑损伤后神 经细胞增生与凋亡的影响,为EPO 治疗感染性脑 损伤提供理论依据。
BrdU 是DNA 前体胸腺嘧啶核苷类似物,对 处于S 期细胞通过竞争方式掺入DNA 单链,通过 免疫组化及免疫荧光技术可观察S 期细胞分布,故 可用来鉴定新生细胞及其增殖情况[17]。在中枢神 经系统内,神经干细胞能不断分裂出新生神经细 胞,而海马齿状回颗粒下层,则是脑组织中主要 的神经细胞增生区域之一,且终身保持生成新生 神经细胞能力。本研究发现, EPO 干预组海马齿 状回颗粒下层BrdU 的表达少于对照组,但较LPS 组明显增多,提示EPO 可促进感染性脑损伤新生 大鼠海马区新生神经细胞的增生。活化Caspase-3 是程序性细胞死亡的关键执行者,且在调控病理 性细胞凋亡中起关键作用,是细胞凋亡的典型标 志物。本研究发现EPO 干预组活化Caspase-3 的表 达较LPS 组减少,但仍高于对照组,提示EPO 可 减少感染性脑损伤新生大鼠海马神经细胞的凋亡。 本研究发现EPO 干预组与LPS 组P2、P7 时体重 差异无统计学意义,提示EPO 对体格生长发育无 明显影响。感染后海马齿状回神经细胞数较对照 组减少,EPO 干预后并未发现能明显增加海马齿 状回总神经细胞数量,其原因可能与本研究仅采 用HE 染色,而未对神经细胞进行特殊染色,不易 针对海马齿状回分子层、颗粒层、多形细胞层等 进行分层计数有关。此外,我们仅研究了海马齿 状回颗粒下层的细胞增生情况,并未探讨其分化情况,这些新生细胞是进一步分化为神经元还是 神经胶质细胞,尚需进一步探讨。
总之,EPO 可减轻感染性脑损伤新生大鼠海 马齿状回神经细胞的凋亡、促进神经细胞的增生, 可能为EPO 对感染脑损伤的神经保护作用机制之 一。
| [1] | Johnston MV, Fatemi A, Wilson MA, et al. Treatment advances in neonatal neuroprotection and neurointensive care[J]. Lancet Neurol, 2011, 10(4): 372-382. |
| [2] | Han W, Song J, Liu A, et al. Trends in live births in the past 20 years in Zhengzhou, China[J]. Acta Obstet Gynecol Scand, 2011, 90(4): 332-337. |
| [3] | Rutherford M, Ramenghi LA, Edwards AD, et al. Assessment of brain tissue injury after moderate hypothermia in neonates with hypoxic-ischaemic encephalopathy: a nested substudy of a randomised controlled trial[J]. Lancet Neurol, 2010, 9(1): 39-45. |
| [4] | 张鹏, 程国强. 亚低温治疗新生儿缺氧缺血性脑病的研究进 展[J]. 中国当代儿科杂志, 2013, 15(10): 918-922. |
| [5] | 刘敬, 杨于嘉, 封志纯."早产儿脑损伤诊断与防治专家共识" 解读[J]. 中国当代儿科杂志, 2012, 14(12): 885-887. |
| [6] | 徐发林, 庄方莉, 白琼丹, 等. 细菌脂多糖对不同成熟度新 生小鼠脑发育的影响[J]. 实用儿科临床杂志, 2012, 27(8): 611-613. |
| [7] | Mallard C, Wang X. Infection-induced vulnerability of perinatal brain injury[J]. Neurol Res Int, 2012, 2012: 102153. |
| [8] | Graf AE, Haines KM, Pierson CR, et al. Perinatal inflammation results in decreased oligodendrocyte numbers in adulthood[J]. Life Sci, 2014, 94(2): 164-171. |
| [9] | Du X, Fleiss B, Li H, et al. Systemic stimulation of TLR2 impairs neonatal mouse brain development[J]. PloS One, 2011, 6(5): e19583. |
| [10] | Neubauer AP, Voss W, Wachtendorf M, et al. Erythropoietin improves neurodevelopmental outcome of extremely preterm infants[J]. Ann Neurol, 2010, 67(5): 657-666. |
| [11] | Fan X, Heijnen CJ, van der KOOIJ MA, et al. Beneficial effect of erythropoietin on sensorimotor function and white matter after hypoxia-ischemia in neonatal mice[J]. Pediatr Res, 2011, 69(1): 56-61. |
| [12] | Zhu C, Kang W, Xu F, et al. Erythropoietin improved neurologic outcomes in newborns with hypoxic-ischemic encephalopathy[J]. Pediatrics, 2009, 124(2): e218-226. |
| [13] | Chen H, Spagnoli F, Burris M, et al. Nanoerythropoietin is 10-times more effective than regular erythropoietin in neuroprotection in a neonatal rat model of hypoxia and ischemia[J]. Stroke, 2012, 43(3): 884-887. |
| [14] | Kumral A, Uysal N, Tugyan K, et al. Erythropoietin improves longterm spatial memory deficits and brain injury following neonatal hypoxia-ischemia in rats[J]. Behav Brain Res, 2004, 153(1): 77-86. |
| [15] | Shen Y, Yu HM, Yuan TM, et al. Erythropoietin attenuates white matter damage, proinflammatory cytokine and chemokine induction in developing rat brain after intra-uterine infection[J]. Neuropathology, 2009, 29(5): 528-535. |
| [16] | Mizuno K, Hida H, Masuda T, et al. Pretreatment with low doses of erythropoietin ameliorates brain damage in periventricular leukomalacia by targeting late oligodendrocyte progenitors: a rat model[J]. Neonatology, 2008, 94(4): 255-266. |
| [17] | Taupin P. BrdU immunohistochemistry for studying adult neurogenesis: paradigms, pitfalls, limitations, and validation[J]. Brain Res Rev, 2007, 53(1): 198-214. |
 2014, Vol. 16
2014, Vol. 16