新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是指各种围生期窒息引起的 部分或完全缺氧、脑血流减少或暂停而导致胎儿 或新生儿脑损伤[1]。HIBD 的发病原因涉及到能量 代谢障碍、氧自由基损伤、钙超载、兴奋性氨基 酸及其受体毒性等各个方面[2]。在哺乳动物的中枢 神经系统中,特别是未成熟脑中,组织的修复和 代偿机制会影响其远期的损伤情况和功能恢复情 况,因此近期的病理或行为评估不一定和远期评 估的结果一致[3]。
焦虑行为是目前越来越受到医学界重视的异 常行为,而其发生与脑功能受损相关。众所周知, 围产期缺氧缺血是导致儿童脑损伤的常见病因之 一,临床回顾性研究报道结果显示,与正常儿童 相比,有围产期窒息和HIBD 病史的患儿青春期和 成年后焦虑症发病率较高[4];同时有研究应用新生 大鼠HIBD 模型发现初生时缺氧缺血损伤可导致大 鼠青春期焦虑行为发生改变[5, 6]。焦虑作为一种情 绪反应,包括本能和所伴随的自主神经反应,二 者与下丘脑边缘系统的活动均有密切的关系。有 研究发现下丘脑部位和杏仁核的fos 磷蛋白在焦虑 机制中起重要作用[7]。同时有研究证实胰岛素样生 长因子-1(insulin-like growth factor-1,IGF-1)具有 促进c-fos 基因表达作用[8],且同一细胞中IGF-1 受体mRNA 的表达与c-fos 免疫活性的表达是相伴 而行的[9]。动物实验证实,大鼠大脑中动脉(MCA) 闭塞再灌注后经侧脑室给予IGF-1,可显著减轻脑 缺血损伤区的神经元缺失[10]。外源性给予IGF-1 可减轻新生鼠HIBD,且该神经保护作用可能与 IGF-1 通过AktGSK3beta 途径减轻神经细胞凋亡有 关[11]。那么,外源性给予IGF-1 是否对HIBD 后的 焦虑行为产生影响,目前未见有关文献报道。酪 氨酸羟化酶(tyroxine hydroxylase,TH)是合成多巴 胺的限速酶以及标记多巴胺神经元的常用指标, 而研究发现多巴胺神经递质功能的改变可导致焦 虑行为异常[12, 13]。本研究的目的是应用新生大鼠 HIBD 模型,观察HIBD 大鼠远期焦虑行为及TH 表达的变化,并通过IGF-1 的干预来探讨IGF-1 对 HIBD 大鼠远期焦虑行为和TH 表达的影响以及相 关可能机制。 1 材料与方法 1.1 动物分组和HIBD 模型制作
健康新生7 日龄(P7)清洁级Sprague-Dawley (SD)大鼠90 只,雌雄不限,体重10~16 g,由 中南大学湘雅动物实验部提供。随机分为正常对 照组、HIBD 组和HIBD+IGF-1 组,每组各30 只。 按Rice 法制作新生大鼠HIBD 模型(即左颈总动 脉分离结扎后,再暴露于8% 氧气和92% 氮气的 低氧环境中2 h)。HIBD+IGF-1 组于缺氧缺血后 即刻腹腔注射IGF-1(产品编号:4119-100,产品 批号Lot:B2029,美国BioVision 公司生产),剂 量为0.2 mg/kg,其余两组腹腔注射等量的生理盐 水。 1.2 高架十字迷宫实验
高架十字迷宫为测试动物焦虑行为的经典实 验。高架十字迷宫由中南大学湘雅二医院精神心 理卫生研究所提供,包括两条50 cm×10 cm×1 cm 相对开放臂和两条50 cm×10 cm×40 cm 相对闭 合臂,中央由10 cm×10 cm 的区域连接,距离地 面50 cm。各组于HIBD 后14 d 和21 d(即P21 和 P28)进行高架十字迷宫实验,每组各时间点取10 只大鼠。大鼠从中央区面向闭合臂放入迷宫,观 察记录5 min 内大鼠的活动情况,主要记录开放 臂停留时间(进入开放臂停留的时间)、开放臂 停留时间比率[ 开放臂停留时间/(开放臂停留时 间+ 闭合臂停留时间)×100%]、开放臂进入次数(进入到任一开放臂的次数,以小鼠4 个爪子均 进入到臂内为准,中途1 爪子从该臂中完全退出 则为该进入活动完成)和开放臂进入次数比率[ 开 放臂进入次数/(开放臂进入次数+ 闭合臂进入次 数)×100%]。 1.3 免疫组织化学方法测定中脑黑质TH 的表达
实验动物于缺氧缺血后7、14、21 d( 即 P14、P21、P28)经麻醉、心脏灌注、固定、断头 取脑,再次固定、脱水、包埋,于海马黑质水平 制作10 μm 厚的脑组织冠状切片进行免疫组化染 色,DAB 显色,每组各时间点取8 只大鼠,每只 大鼠取4 张切片,每张切片随机取4 个视野。一 抗为小鼠抗大鼠脑黑质 TH 单克隆抗体(1 : 100, chemicon 公司),二抗为马抗小鼠的IgG 单克隆 抗体(1 : 400,Vector 公司)。在日本产Nikon Eclipse 80i 显微镜下观察结果,并用Nikon DS 高 分辨率数码像机经NIS-Elements AR3.0 软件拍照, 收集脑组织切片中黑质及海马切面图像。采用 Ver.3.00 程序软件作图像数字采集及半定量分析 (以着色面积占组织切片总面积的比例确定为标 志物免疫组化的阳性数值)。 1.4 统计学分析
采用SPSS 16.0 统计软件对数据进行统计学分 析。在符合正态分布前提下,计量资料以均数± 标准差(x±s)表示;在方差齐性的前提下,多 组间比较采用单因素方差分析,方差不齐时采用 Kruskal-Wills H 检验,组间两两比较采用SNK-q 检 验,P<0.05 为差异有统计学意义。 2 结果 2.1 高架十字迷宫测试结果 2.1.1 开放臂停留时间
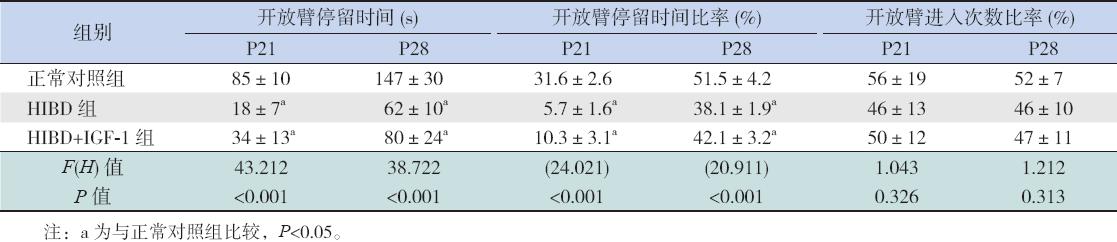
开放臂停留时间越短,表明动物的焦虑情绪越严重。本实验结果显示P21 和P28 两个时间点HIBD 组和HIBD+IGF-1 组动物 的开放臂停留时间均较正常对照组明显减少(均 P<0.05);尽管HIBD+IGF-1 组的开放臂停留时间 较HIBD 组有所延长,但两组之间的差异无统计学 意义(P>0.05)。见表1。
| 表 1高架十字迷宫实验结果 (x±s,n=10) |
开放臂停留时 间比率越小,表明动物的焦虑情绪越严重。本 实验结果显示P21 和P28 两个时间点HIBD 组 和HIBD+IGF-1 组动物的开放臂停留时间比率 均较正常对照组明显减少(均P<0.05); 尽管 HIBD+IGF-1 组的开放臂停留时间比率较HIBD 组有所上升,但两组之间的差异无统计学意义 (P>0.05)。见表1。 2.1.3 开放臂进入次数比率
进入开放臂的次 数减少,表明动物活动性降低。本实验研究结果 显示P21 和P28 两个时间点,正常组、HIBD 组和 HIBD+IGF-1 组大鼠开放臂进入次数比率差异无统 计学意义(P>0.05),见表1。 2.2 免疫组化染色检测各组黑质TH 表达
各组TH 阳性反应物质(棕色)主要分布在 细胞质中,各组阳性细胞的细胞膜基本完整,细 胞形态无明显异常,从细胞形态判断该阳性细胞 为神经元,见图 1。
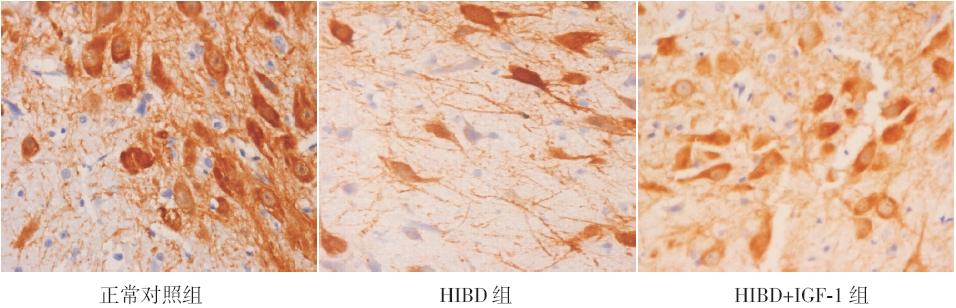 |
图 1 P28 时各组黑质TH 免疫组化染色结果(DAB 显色,×400) 各组TH 阳性反应物质(棕色)主要分布 在细胞质中,各组阳性细胞的细胞膜基本完整,细胞形态无明显异常,从细胞形态判断该阳性细胞为神经元。 |
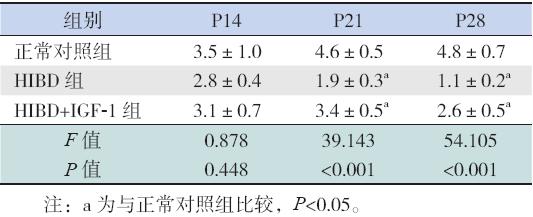
HIBD 后各时间点,HIBD 组TH 的阳性表 达细胞数较正常对照组和HIBD+IGF-1 组减少, 提示HIBD 组TH 阳性表达水平下降(图 2)。 与正常对照组相比,P21 和P28 时HIBD 组和 HIBD+IGF-1 组的TH 免疫染色阳性面积百分比明 显降低(P<0.05),但HIBD 组与HIBD+IGF-1 组 之间差异无统计学意义(P>0.05),见表2。
 |
图 2 各组黑质TH 免疫组化染色结果(DAB 显色,×100) 正常对照组各时间点黑质部位均密布TH 阳性染色 细胞(棕色),HIBD 组的TH 阳性染色细胞数量较对照组明显减少;HIBD+IGF-1 组的TH 阳性染色细胞数量较对照组减少, 但较HIBD 组稍有增加。 |
| 表 2各组各时间点TH 免疫染色阳性面积百分比 (x±s,n=8) |
在儿童生长发育过程中,青春期的心理焦虑 程度处于相对较高的水平。焦虑症是一种并非由 焦虑刺激引起的或不能用焦虑刺激合理解释的, 以焦虑情绪体验为主,可表现为长期或过度的担 忧及紧张、对没有危害或危害甚小的对象的恐惧 等,同时伴有植物神经系统功能紊乱的神经症。 目前焦虑症是儿童期患病率最高的心理障碍之一, 且患病率有逐年增高的趋势。焦虑症的发生与脑 功能受损相关,但目前并无证据证明导致焦虑的 脑功能受损最可能发生在什么时间,而围产期缺 氧缺血导致的脑损伤是常见的导致儿童脑损伤的 病因之一,那么围产期的HIBD 与焦虑症的发病之 间是否存在关联是本课题关注的切入点。本研究 应用HIBD 动物模型,了解了HIBD 恢复期后、当 实验动物处于青春期阶段的焦虑样行为改变,同 时应用IGF-1 在围产期进行干预、了解IGF-1 对该 焦虑行为改变的影响。
SD 大鼠的自然寿命为2.5~3 年,P28 时断奶 并具有交配生殖能力,因此P14~P28 被认为是SD 大鼠的青春期。在研究焦虑行为问题的动物实验 中,高架十字迷宫为非条件反射模型,是测试动 物焦虑水平的经典测量方法,是利用动物对新异 环境的探究特性和对高悬敞开臂的恐惧心理,形 成动物的矛盾行为,来反映动物的焦虑情绪,以 进入开放臂次数和在开放臂停留时间的长短来反 映动物的焦虑状态,在焦虑动物中上述两指标明 显降低。大鼠进入开放臂的次数代表其活动性, 如果大鼠进入开放臂的次数无减少,表明其活动 性无改变。本研究结果显示,就开放臂的进入次数 比率而言,HIBD 组与正常对照组和HIBD+IGF-1 组之间比较差异无统计学意义,表明动物的活动 性无改变。而就开放臂的停留时间及开放臂停留 时间比率而言,HIBD 组和HIBD+IGF-1 组均较正 常对照组明显降低,提示HIBD 后,大鼠青春期的 焦虑程度升高,IGF-1 干预后开放臂的停留时间及 开放臂停留时间比率均较未干预组有所升高,尽 管升高程度无统计学差异,但仍提示IGF-1 可能对 焦虑样行为起到一定程度的抑制作用。该结果与 Fan 等[14] 报道的HIBD 可减轻早产大鼠远期焦虑 行为的结果不相符合,该研究是应用4 日龄早产 大鼠双侧颈总动脉结扎造成HIBD,于P20 时采用 高架十字臂测定动物的焦虑行为,结果显示缺氧 缺血造成了动物青春期的焦虑样行为减轻。临床 回顾性研究报道结果显示有围产期窒息和HIBD 病 史的患儿青春期和成年后焦虑症发病率比正常儿 童高[4],与本次研究结果相同。但由于本研究结果 显示IGF-1 干预后的HIBD 大鼠在P21 和P28 两个 时间点的焦虑程度与HIBD 组比较无统计学差异, 因此目前本研究只能得出以下结论:IGF-1 干预后, 动物的高架十字迷宫各项焦虑指标均未得到改善, 提示其焦虑样行为的异常改变与IGF-1 及其受体可 能无关联,IGF-1 不能对HIBD 造成的焦虑行为产 生保护作用。
众所周知,多巴胺是儿茶酚胺神经递质中的 一种,TH 是多巴胺合成过程的限速因子,TH 的 表达情况反应了多巴胺能神经元的生存情况,因 而在对多巴胺的研究中将TH 作为多巴胺能神经 元的特征。在帕金森病动物模型免疫组化实验研 究中,TH 是用以标记多巴胺神经元最常用的指 标[15]。多巴胺神经递质功能降低可导致5- 羟色胺 (5-hydroxytryptamine,5-HT)功能相对增强,而5-HT 功能增强可导致焦虑。本实验发现在HIBD 后7 d (P14 时间点),大鼠大脑黑质部位的TH 表达未 减少,考虑可能与时间太早导致变化不明显及实 验动物例数较少有关,而在HIBD 后14 d 及21 d (P21、P28),大鼠大脑黑质部位的TH 表达均减 少,与Tatton 等[16] 在老年小鼠缺血性脑损伤模型 中观察的焦虑样行为、多巴胺及其代谢产物的改 变的结果一致,提示HIBD 与单纯缺血均可累及到 处于快速生长发育期动物的多巴胺系统,使多巴 胺神经元受损,可能是多巴胺功能降低使5-HT 功 能相对增强而导致焦虑。
IGF-1 在脑中有广泛的分布,其是由78 个氨 基酸组成的单链多肽,是一种肽能生长因子,具有非选择性神经营养作用,存在于脑组织中,参 与脑的生长发育[17]。有研究报道IGF-1 在HIBD 中 具有减轻细胞凋亡的作用[18]。本实验研究结果显 示HIBD 后即刻给予IGF-1(0.2 mg/kg)腹腔注射, HIBD+IGF-1 组黑质TH 的表达与HIBD 组相比较 差异无统计学意义,提示IGF-1 可能不能改善多巴 胺能神经元功能,不能通过使黑质部位TH 的表达 增多而影响5-HT 水平。
人作为生命活动连续的个体,许多儿童期的 疾病(包括新生儿期某些疾病)与成年之后的疾 病之间存在必然的联系。但是,由于新生儿学科 与身心医学科分别属于两个完全不同的专科,相 互对各自的临床诊治重点和医学基础研究都缺乏 足够的了解;而新生儿科与儿童保健专科尽管都 隶属于儿科范畴,但由于临床诊治对象差异较大, 因此两个亚专科之间的合作也较少。本研究的创 新点是:应用HIBD 动物模型,将属于新生儿专科 的HIBD 与属于身心医学科的焦虑症联系起来,发 现围产期HIBD 可使大鼠青春期焦虑行为发生改 变,其机制与脑黑质TH 表达的减少相关,但初生 时给予IGF-1 干预对大鼠HIBD 远期焦虑行为的异 常不产生作用,且IGF-1 不影响脑黑质TH 的表达, SD 大鼠青春期焦虑样行为的改变可能不受IGF-1 调控。
| [1] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4 版. 北京: 人民卫生出版社, 2011: 699-700. |
| [2] | Northington FJ, Chavez-Valdez R, Martin LJ. Neuronal cell death in neonatal hypoxia-ischemia[J]. Ann Neurol, 2011, 69(5): 743-758. |
| [3] | Bona E, Johansson BB, Hagberg H. Sensorimotor function and neuropathology five to six weeks after hypoxia-ischemia in sevenday-old-rats[J]. Pediatr Res, 1997, 42(5): 678-683. |
| [4] | Van Handel M, Swaab H, de Vries LS, et al. Long-term cognitive and behavioral consequences of neonatal encephalopathy following perinatal asphyxia: a review[J]. Eur J Pediatr, 2007, 166(7): 645-654. |
| [5] | Ming-Yan H, Luo YL, Zhang XC, et al. Hypoxic-ischemic injury decreases anxiety-like behavior in rats when associated with loss of tyrosine-hydroxylase immunoreactive neurons of the substantia nigra[J]. Braz J Med Biol Res, 2012, 45(1): 13-19. |
| [6] | Yan XB, Wang SS, Hou HL, et al. Lithium improves the behavioral disorder in rats subjected to transient global cerebral ischemia[J]. Bhave Brain Res, 2007, 177(2): 282-289. |
| [7] | 卢晓虹, 李凌江, 李昌琦, 等. 应激对中枢神经系统即刻早 期基因c-fos 表达及HPA 轴的调节作用研究[J]. 中国心理卫 生杂志, 2000, 14(1): 10-13. |
| [8] | Li M, Chiu JF, Gagne J, et al. Age-related differences in insulinlike growth factor-1 receptor signaling regulates Akt/FOXO3a and ERK/Fos pathways in vascular smooth muscle cells[J]. Cell Physiol, 2008, 217(2): 377-387. |
| [9] | Aguado F, Rodrigo J, Cacicedo L, et al. Distribution of insulinlike growth factor-1 receptor mRNA in rat brain. Regulation in the hypothalamoneurohypophysial system[J]. Mol Endocrinol, 1993, 11(2): 231-239. |
| [10] | Wang JM, Hayashi T, Zhang WR, et al. Reduction of ischemic brain injury by topical application of insulin-like growth factor-1 after transient middle cerebral artery occlusion in rats[J]. Brain Res, 2000, 859(2): 381-385. |
| [11] | Brywe KG, Mallard C, Gustavsson M, et al. IGF-1 neuroprotection in the immature brain after hypoxia-ischem ia, involvement of Akt and GSK3beta?[J]. Eur J Neurosci, 2005, 21(6): 1489-1502. |
| [12] | Bakos J, Duncko R, Makatsori A, et al. Prenatal immune challenge affects growth, behavior, and brain dopamine in offspring[J]. Ann N Y Acad Sci, 2004, 1018: 281-287. |
| [13] | Winter B, Juckel G, Voktorov I, et al. Anxious and hyperactive phenotype following brief ischemic episodes in mice[J]. Biol Psychiatry, 2005, 57(10): 1166-1175. |
| [14] | Fan LW, Lin S, Pang Y, et al. Minocycline attenuates hypoxiaischemia-induced neurological dysfunction and brain injury in the juvenile rat[J]. Eur J Neurosci, 2006, 24(2): 341-350. |
| [15] | Thomas Tayra J, Kameda M, Yasuhara T, et al. The neuroprotective and neurorescue effects of carbamylated erythropoietin Fc fusion protein (CEPO-Fc) in a rat model of Parkinson's disease[J]. Brain Res, 2013, 1502: 55-70. |
| [16] | Tatton W, Greenwood C, Salo PT, et al. Transmitter synthesis increases in substantia nigra neurons of the aged mouse[J]. Neurosci Left, 1991, 131(1): 179-182. |
| [17] | Lin S, Fan LW, Rhodes PG, et al. Intranasal administration of IGF-1 attenuates hypoxic-ischemic brain injury in neonatal rats[J]. Exp Neurol, 2009, 217(2): 361-370. |
| [18] | Zhu DN, Jia YJ, Wang J, et al. Human insulin-like growth factor 1-transfected umbilical cord blood neural stem cell transplantation improves hypoxic-ischemic brain injury[J]. Neural Regen Res, 2011, 6(19): 1445-1451. |
 2014, Vol. 16
2014, Vol. 16