哮喘是由包括呼吸道炎性细胞、结构细胞等 多种细胞和细胞组分共同参与的慢性呼吸道炎症 性疾病。以气道高反应性、慢性气道炎症、气道重 塑为主要病理特征,其发病机制复杂,目前尚未明 确。近年来儿童哮喘的发病率及病死率逐年提高, 严重影响儿童的健康及生活质量。高迁移率族蛋 白B1(high mobility group box 1,HMGB1)是一种高 度保守的普遍存在的核蛋白,主要由巨噬细胞、单 核细胞、垂体细胞等在炎症因子刺激下主动释放, 也可由坏死细胞主动释放。HMGB1 作为一种免疫 调节因子,当其释放出细胞外会激发免疫系统产 生炎症反应,免疫细胞受到HMGB1 的刺激后同样 会产生特定的应激反应[1]。HMGB1 作为一种晚期 炎症因子,即参与多种细胞因子、血管黏附分子 促炎细胞趋化等相互作用引起的炎症反应又参与 信号转导过程[2]。在信号转导的机制中研究证实: HMGB1可与其受体Toll样受体4(toll like receptors 4, TLR4)相互作用,通过激活NF-κB,引起下游炎 症介质释放。1,25-(OH)2D3 是维生素D3 的活性形式, 除有调节钙、磷代谢作用,还具有调节免疫作用, 主要通过活化的单核细胞及树突状细胞(dendritic cell,DC)来影响免疫状态[3, 4],影响多种细胞的生 长和分化。目前其对哮喘中的作用尚不明确,本研 究通过建立小鼠哮喘模型,并用1,25-(OH)2D3 干预, 观察其对小鼠气道重塑及HMGB1 和TLR4 表达的 影响,以探求哮喘的发病机制,并为哮喘的治疗寻 求新的靶点。 1 材料与方法 1.1 动物及主要试剂
30 只 SPF 级BALB/c 雌性小鼠,6 周龄,体 重20±2 g,购于河南省实验动物中心[ 许可证号: SCXK( 豫)2010-0002],1,25-(OH)2D3 和鸡卵清 蛋白(ovalbumin,OVA)购于Sigma 公司,免疫组 化一抗购于北京博奥森生物技术有限公司,二抗 及显色剂购于北京中杉金桥生物技术有限公司, TRIzol、反转录试剂盒和PCR 试剂购于北京全式 金生物技术有限公司。 1.2 动物分组和哮喘小鼠模型的制备
将30 只BALB/c 小鼠随机分为对照组、哮喘 组和1,25-(OH)2D3 干预组,每组10 只。适应性饲 养1 周后,参照文献[5] 制备动物模型:在第 1、 8、15 天哮喘组和干预组小鼠分别腹腔内注射抗原 混合液0.2 mL( 含10% 氢氧化铝0.15 mL、OVA 50 μg 和生理盐水 0.05 mL) 致敏, 对照组给予 0.2 mL 生理盐水腹腔注射;第22 天开始,哮喘组 和干预组小鼠雾化吸入1% OVA 激发,每日1 次, 每次30 min,持续至第35 天,共计14 次;干预 组在每次激发前0.5 h 给予腹腔内注射1,25-(OH)2D3 混合液0.08 mL[ 含1,25-(OH)2D3 0.08 μg、无水乙 醇2.0 μL、生理盐水0.08 mL],哮喘组每次激发前 0.5 h 给予腹腔注射生理盐水0.08 mL;对照组激发 前0.5 h 腹腔注射和雾化激发均用生理盐水替代。 1.3 肺组织标本制备
各组小鼠于末次雾化激发结束后24 h 内以乙 醚吸入麻醉,开胸、结扎左肺门、取出左肺,冻 存于液氮中,用于RT-PCR 检测。经右心室插管至 肺动脉,用生理盐水快速冲洗至无血液流出,肺 叶颜色呈白色后,换4% 甲醛溶液冲洗,进行内固 定,取出右肺,置于4% 甲醛溶液中行外固定48 h, 酒精梯度脱水,石蜡包埋,采用连续切片,4 μm 厚度切片,每隔3 张切片选取1 张,用于苏木精- 伊红(HE)染色及免疫组织化学染色。 1.4 HE 及免疫组化染色
随机选取每只小鼠肺组织3 张石蜡切片,脱 蜡后行HE 染色,观察支气管壁的形态学改变,每 张切片随机选取5 个以上高倍镜视野,采用 Image Pro Plus 6. 0 图像分析软件测定相同级别支气管横 断面气道壁厚度变化。另随机选取每只小鼠肺组 织3 张石蜡切片,脱蜡后依次滴加山羊抗小鼠一 抗、二抗、辣根过氧化物酶标记的链霉卵白素, DBA 显色、苏木素复染、盐酸分化、脱水封片, 然后进行免疫组化操作,观察阳性细胞中HMGB1 和TLR4 蛋白的表达,每张切片随机选取5 个以上 高倍镜视野,应用计算机病理图像分析系统测定 平均IOD 值作为该片的蛋白半定量结果。 1.5 RT-PCR 检测HMGB1 及TLR4 mRNA 表达
采用TRIzol 提取左肺组织总RNA,使用逆转 录试剂盒合成单链cDNA,再设计引物,扩增目的 基因HMGB1 上游引物为:5'-CGGATGCTTCTGTCAACT- 3',下游引物为:5'-TCAGCTTGGCAGCTTTCT- 3',产物大小为360 bp;目的基因TLR4 上游 引物为:5'-GGTGAGAAATGAGCTGGTA-3', 下游引物为:5'-TCTGCTAAGAAGGCGATA-3', 产物 大小为313 bp;内参GAPDH 上游引物为:5'-CCACTTGAAGGGTGGAGC- 3',下游引物为:5'-TGAAGTCGCAGGAGACAA- 3', 产物大小为 530 bp。反应 体系为50 μL, 其中cDNA 2 μL、上下游引物各 1 μL、缓冲液(含Mg2+) 5 μL、dNTPs 4 μL、DNA 聚合酶1 μL、ddH2O 36 μL。反应条件:94℃预变 性3 min;94℃变性30 s,55℃退火30 s,72℃延 伸1 min,共 35 个循环;72℃延伸10 min。扩增 产物在1.5% 琼脂糖凝胶上进行电泳,并采用凝胶 电泳成像系统观察目的基因,目的基因HMGB1 或 TLR4 mRNA 的表达量以HMGB1 或TLR4 的DNA 条带与内参GAPDH 的DNA 条带灰度值的比值表 示。 1.6 统计学分析
采用SPSS 17.0 统计软件对数据进行统计学分 析,计量资料用均数± 标准差(x±s)表示,多 个样本均数的比较采用单因素方差分析,组间数 据两两比较采用 LSD-t 法,两变量的相关分析采用 Pearson 相关分析,P<0.05 为差异有统计学意义。 2 结果 2.1 小鼠肺组织病理形态学观察
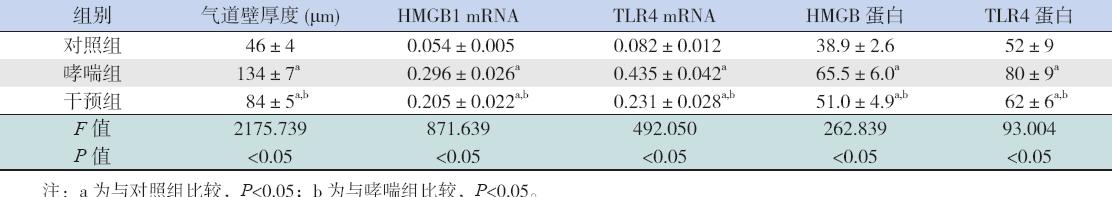
对照组小鼠支气管壁结构完整光滑,上皮细 胞排列整齐,气道壁厚度适中(46±4 μm),少 量炎症细胞浸润;哮喘组小鼠支气管壁受损,上 皮细胞排列紊乱、脱落,气道壁增厚(134±7 μm), 管腔狭窄,支气管周围较多炎性细胞浸润;干预 组气道壁厚度(84±5 μm)及炎症细胞浸润数量 较哮喘组减少,细胞排列程度较哮喘组规则(图 1)。 3 组气道壁厚度比较差异有统计学意义(P<0.05), 见表1。
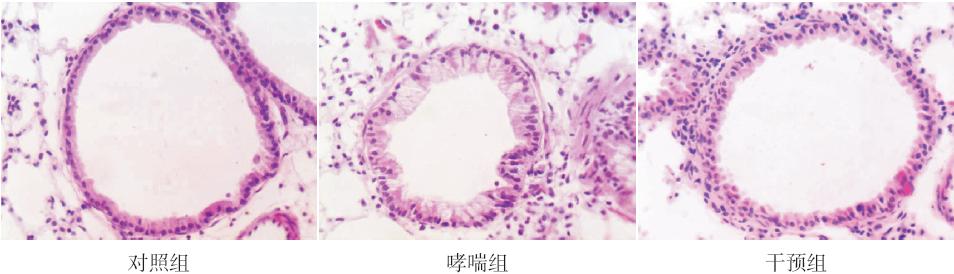 |
图 1 各组小鼠肺组织病理形态学改变 (苏木精- 伊红染色,×400) 对照组气道壁厚度适中,无管腔狭窄,上 皮细胞排列规则,少量炎症细胞浸润;哮喘组气道壁厚度较对照组明显增加,管腔狭窄,上皮细胞排列紊乱、脱落,炎症细 胞浸润增多;与哮喘组相比,干预组气道壁厚度明显减小,细胞排列更为规则,炎症细胞大量减少。。 |
| 表 1各组小鼠气道壁厚度、肺组织HMGB1 和TLR4 mRNA 及蛋白的表达变化 (n=10,x±s) |
HMGB1 和TLR4 蛋白均主要定位于炎症细胞 及上皮细胞的细胞核、胞浆。对照组小鼠HMGB1 及TLR4 蛋白表达较弱;哮喘组小鼠HMGB1 及 TLR4 蛋白呈强阳性表达,与对照组相比差异均有 统计学意义(均P<0.05);干预组小鼠HMGB1 及 TLR4 蛋白的表达明显低于哮喘组,但仍高于对照 组,差异均有统计学意义(均P<0.05)。见图 2、 表1。
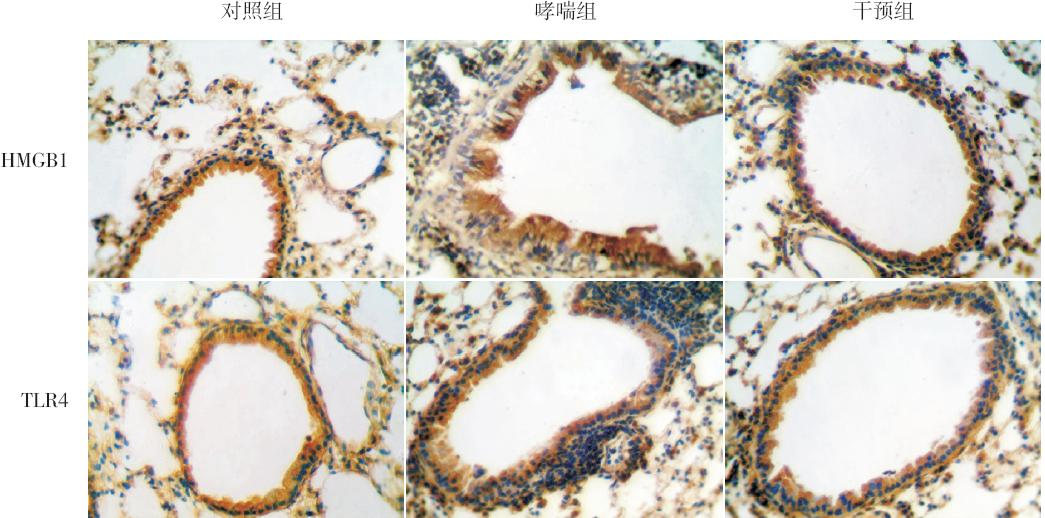 |
图 2 各组小鼠HMGB1 和TLR4 在肺组织中的表达 (DAB 显色,×400) 对照组HMGB1 和TLR4 表达较 弱,而在哮喘组两者均呈强阳性表达;干预组HMGB1 和TLR4 表达较哮喘组降低,但仍高于对照组。深棕黄色为HMGB1 或 TLR4 表达阳性细胞。 |
RT-PCR 检测结果显示, 哮喘组小鼠肺内 HMGB1 和TLR4 mRNA 相对表达量均较对照组显 著增高(均P<0.05) ;干预组小鼠肺内HMGB1 和TLR4 mRNA 相对表达量较哮喘组明显降低, 但仍高于对照组, 差异均有统计学意义( 均 P<0.05)。见图 3~4、表1。
 |
图 3 各组小鼠HMGB1 mRNA 在肺组织中的表达 M:DNA marker;1:对照组;2:哮喘组;3:干预组。 |
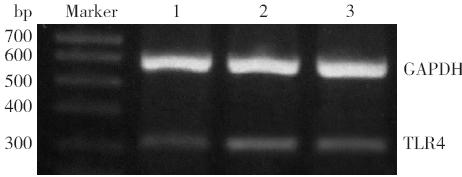 |
图 4 各组小鼠TLR4 mRNA 在肺组织中的表达 M:DNA marker;1:对照组;2:哮喘组;3:干预组。 |
肺组织内HMGB1 蛋白与TLR4 蛋白的表达 呈正相关(r=0.742,P<0.01),HMGB1 mRNA 与TLR4 mRNA 的表达亦呈正相关(r=0.940, P<0.01)。 3 讨论
HMGB1 在外源性微生物侵入或内源性组织损 伤发生时,可以作为应激信号和炎性介质通过两 种方式释放到胞外,一种是由活化的巨噬细胞和 DC 等免疫细胞主动分泌到胞外,另一种由多种病 理过程中组织细胞的坏死、损伤使核内的HMGB1 释放至细胞外。HMGB1 的主要生物学功能包括: (1) 作为促炎细胞因子,HMGB1 可以促进炎 性细胞活化以及刺激促炎因子的产生和分泌,如 TNF-α、IL-1、IL-6、IL-8 表达,这些介质又能够 加强HMGB1 的分泌效应,形成一个复杂的细胞因 子分泌调节网络[6]。(2)HMGB1 能诱导DC 成熟 并分泌多种促炎细胞因子,促进DC 表面共刺激分 子CD80、CD83、CD86 和MHC Ⅱ表达上调[7, 8]。 (3)HMGB1 信号通过RAGE、TLR2 和TLR4 激 活一些与NF-κB 和丝裂霉素激活蛋白激酶P38 有 关的途径。
TLRs 是一类模式识别受体,TLRs 在免疫调节、 炎症反应方面具有重要作用,在固有免疫与适应 性免疫间起桥梁作用[9, 10]。TLR4 是被发现的第一 个哺乳动物TLR,该蛋白在不同细胞中表达,如 气道上皮细胞、血管内皮细胞、平滑肌细胞、巨 噬细胞、骨骼肌细胞[11]。HMGB1 在细胞坏死或某 些炎症因子刺激下,被动或主动地释放至细胞外 液,演变为重要促炎细胞因子,并作为危险相关 的分子模式与TLR4 等结合,启动相关信号途径而 激活NF-κB 诱导炎症因子的表达,促进细胞增殖 并增强细胞抗凋亡作用,HMGB1 还影响DC 的成 熟及迁移。目前有关HMGB1 和TLR4 在哮喘方面 的研究较少,本研究结果显示:哮喘组小鼠支气 管气道上皮细胞、单核巨噬细胞、B 细胞、T 细胞 及DC 的HMGB1 及TLR4 的表达量显著增多,由 此推断,HMGB1-TLR4-NF-κB 信号通路可能参与 哮喘气道炎症及气道重塑过程。
1,25-(OH)2D3 通过与细胞内的维生素D 受体 (VDR)结合发挥生物学效应,除了维持机体钙、 磷平衡,它还具有免疫调节作用。VDR 广泛分布 于全身各处[12],VDR 几乎表达于所有免疫细胞, 包括活化的CD4+T 细胞、CD8+T 细胞、B 细胞、中 性粒细胞和抗原递呈细胞(如巨噬细胞和DC)[13]。 维生素D3 与固有和适应性免疫应答均有密切关 系[14]。据报道,由于日照不足或维生素D3 摄取不 够导致维生素 D3 缺乏可引起多种自身免疫病的发 病,如:1 型糖尿病、多发性硬化症、系统性红斑 狼疮、类风湿性关节炎和炎症性肠病等[15]。动物 实验证明:向小鼠体内注入1,25-(OH)2D3 的类似物 骨化三醇可抑制DC 的成熟与活性,使DC 低表达 其成熟标记CD86、CD40 等共刺激分子和 MHC- Ⅱ 类分子,从而影响Th1/Th2 细胞的增殖[16]。本次 实验研究结果显示:1,25-(OH)2D3 干预不仅能有效 减少哮喘炎症细胞浸润,还可降低气道壁厚度, 从而减轻哮喘小鼠的气道重塑。提示1,25-(OH)2D3干预治疗能有效减轻哮喘气道炎症,改善气道重 塑。RT-PCR 及免疫组化结果显示:干预组小鼠 肺组织HMGB1 和TLR4 mRNA 及蛋白水平均明显 低于哮喘组。提示1,25-(OH)2D3 可能是通过阻断 HMGB1-TLR4-NF-κB 信号传导通路来抑制下游炎 症因子的释放,从而减轻哮喘小鼠气道炎症及气 道重塑。
本次实验研究表明1,25-(OH)2D3 能有效减轻气 道炎症细胞的浸润及气道重塑,其作用于HMGB1- TLR4-NF-κB 通路的具体作用机制,有待于进一步 研究,以为哮喘的治疗提供新的靶点和途经。
| [1] | 逄越, 胡明, 刘欣, 等. 高迁移率族蛋白B1 启动免疫应答的 重要信号分子[J]. 免疫学杂志, 2010, 26(8): 735-738. |
| [2] | 张婷, 夏敏. 高迁移率族蛋白B1 信号转导通路的研究进展[J]. 医学综述, 2011, 17(2): 195-198. |
| [3] | Hansdottir S, Monick MM. Vitamin D effects on lung immunity and respiratory diseases[J]. Vitam Horm, 2011, 86: 217-317. |
| [4] | 马秀丽, 甄艳芬. 支气管哮喘儿童血清25-(OH)D3 和总免疫 球蛋白E 的变化[J]. 中国当代儿科杂志, 2011, 13(7): 551-553. |
| [5] | 王亚哲, 栾斌, 张艳丽, 等. 1, 25-(OH)2D3 对哮喘小鼠肺内 TIM-4 表达的影响[J]. 中国当代儿科学杂志, 2013, 15(1): 68-70. |
| [6] | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418(6894): 191-195. |
| [7] | Messmer D, Yang H, Telusma G, et al. High mobility group box 1 (HMGB1) is an endogenous Th1 polarizing signal fordendritic cellmaturation[J]. J Immunol, 2004, 173(1): 307-313. |
| [8] | Dumitriu IE, Bianchi ME, Bacci M, et al. The secretion of HMGB1 is required for the migration of maturing dendritic cells[J]. J Leukoc Biol, 2007, 81(1): 84-91. |
| [9] | Crespo-Lessmann A, Juarez-Rubio C, Plaza-Moral V. Role of Toll like receptors in respiratory diseases[J]. Arch Bronconeumol, 2010, 46(3): 135-142. |
| [10] | Lafferty EI, Qureshi ST, Schnare M. The role of toll like receptors in acute and chronic lung inflammation[J]. J Inflamm(Lond), 2010, 7: 57. |
| [11] | Ojaniemi M, Lijieroos M, Harju K, et al. TLR-2 is upregulated and mobilized to the hepatocyte plasma membrane in the space of Disse and to the Kupffer cells TLR-4 dependently during acute endotoxemia in mice[J]. Immunol Lett, 2006, 102(2): 158-168. |
| [12] | Hewison M. Vitamin D and immune function: an overview[J]. Proc Nutr Soc, 2012, 71(1): 50-61. |
| [13] | Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences[J]. Am J Clin Nutr, 2008, 87(4): 1080S-1086S. |
| [14] | Back O, Blomquist HK, Hernell O, et al. Does vitamin D intake during infancy promote the development of atopic allergy ?[J]. Acta Derm Venereol, 2009, 89(1): 28-32. |
| [15] | Mathieu C, Adorini L. The coming of age of 1, 25-dihydroxy vitamin D3 analogs as immunomodulatory agents[J]. Trends Mol Med, 2002, 8(4): 174-179. |
| [16] | Eftekharian MM, Zarnani AH, Moazzeni SM. In vivo effects of calcitriol on phenotypic and functional properties of dendritic cells[J]. Iran J Immunol, 2010, 7(2): 74-82. |
 2014, Vol. 16
2014, Vol. 16