2. 福建医科大学福总临床医学院儿科, 福建 福州 350025;
3. 厦门大学附属东方医院儿科, 福建 福州 350025
原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童时期常见的肾小球疾病。 肾脏病遗传学研究表明20多个不同的单基因突变 可导致常染色体隐性遗传型激素耐药型肾病综合 征(steroid-resistant nephrotic syndrome,SRNS), 如NPHS1、NPHS2、WT1、MYO1E基因等 [1, 2, 3, 4, 5]。 SRNS的病理表现为局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)。30%~40%的 SRNS患儿在10年内进展至终末期肾脏疾病(end stage renal disease,ESRD) [1, 6, 7] 。迄今,国外研究者 在3个FGSG家系发现了MYO1E基因纯合突变, 呈常染色体隐性遗传方式 [4, 5] 。MYO1E基因定位于 人染色体15q21-22,有28个外显子;其编码蛋白 myosin 1e含有1108个氨基酸,参与胞吞、细胞信 号传导、细胞膜性结构张力维持等与actin纤维有 关的各种细胞活动 [8, 9, 10, 11] 。早期实验研究证实MYO1E 基因突变可引起鼠肾小球滤过屏障结构和功能损 伤 [12, 13] 。为探讨中国汉族SRNS患儿MYO1E基 因突变及其特点,本研究对4个中国汉族家族性 SRNS家系先证者进行MYO1E基因突变分析。 1 资料与方法 1.1 研究对象
2005~2010年期间南京军区福州总医院儿科 共收集到4个中国汉族常染色体隐性遗传型SRNS 家系,均来自福建省(图 1)。每个家系中均有 2例或2例以上患儿,共9例肾脏病患者,其中 男4例,女5例;1例患者首次就诊即诊断为 ESRD,8例诊断为SRNS;共有6例患儿进行了肾 活检,肾脏病理为FSGS(4例)和系膜增生性肾 小球肾炎(MsPGN)(2例);进入ESRD 5例, 进入ESRD时间为1.2~8年,平均为6.4年;肾移 植3例,移植后随访7.5~11年无复发(表 1)。 本研究选取其中4例先证者为研究对象,男1例, 女3例,发病年龄为1.6~7岁,平均发病年龄4.3岁; 每个家系中先证者的父母均健康,尿检均正常, 无肾脏疾病家族史。对照组为59例尿检正常的健 康志愿者,其中男38例,女21例,年龄18~46岁。
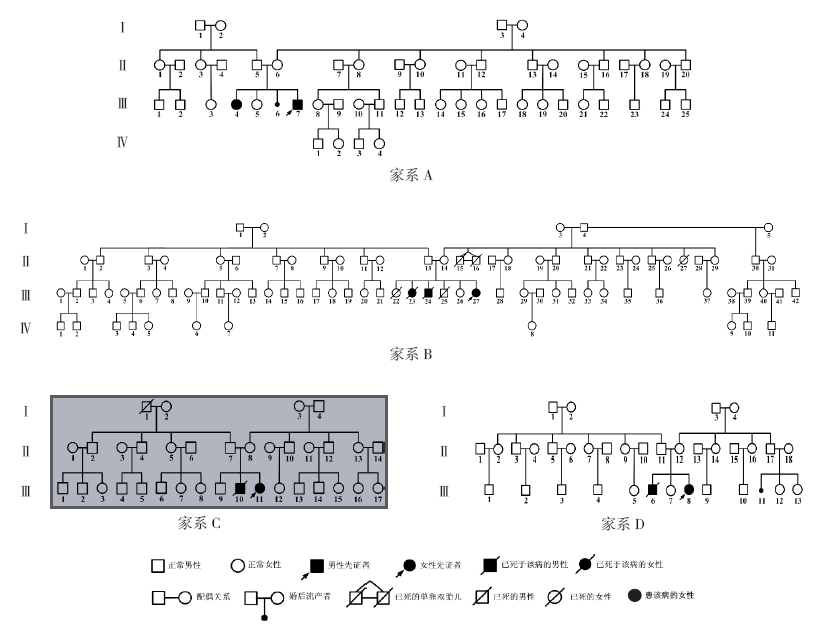 |
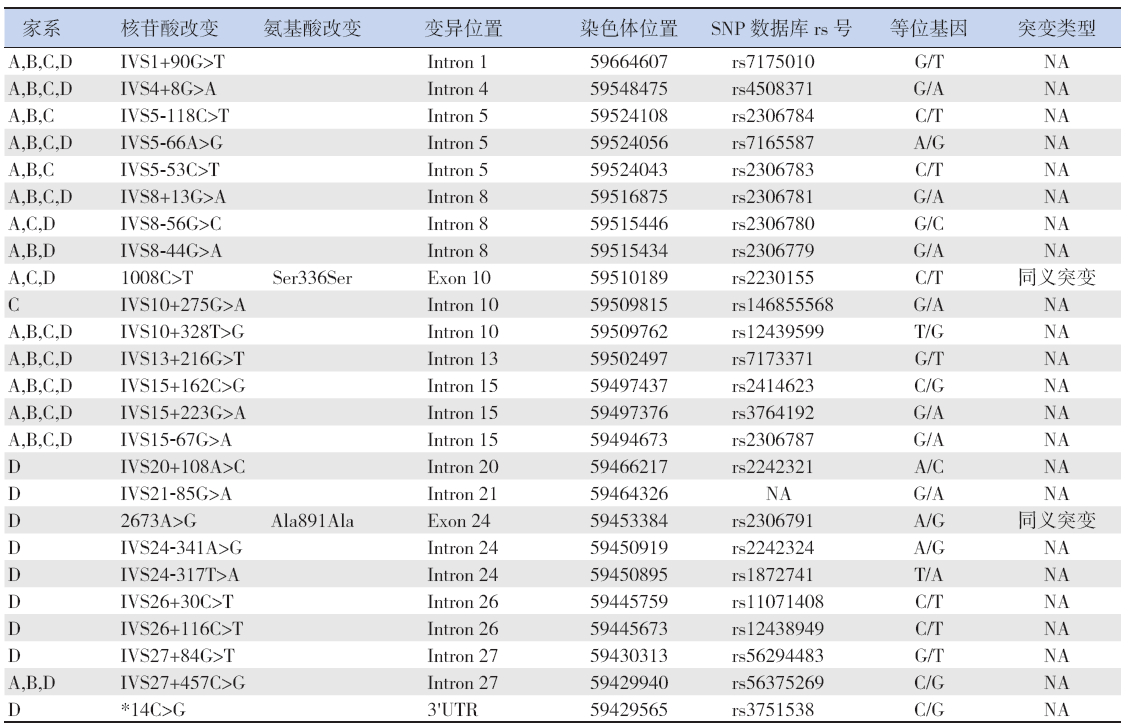
图 14个中国汉族家族性SRNS家系图谱 罗马字母代表世代数,阿拉伯数字代表每世代各成员的编号。A系 谱图中Ⅲ7为先证者,7岁患肾病综合征,对激素耐药;Ⅲ4为先证者之姐;Ⅲ6系人工流产;Ⅱ5、Ⅱ6分别为先证者之父母, 尿检均正常。B系谱图中Ⅲ27为先证者,7岁患肾病综合征,对激素耐药;Ⅲ22为先证者之姐,已死亡;Ⅲ23为先证者之姐, 死于该病;Ⅲ24为先证者之兄,死于该病;Ⅲ25为先证者之兄,已死亡;Ⅱ13、Ⅱ14分别为先证者之父母,尿检均正常。 C系谱图中Ⅲ11为先证者,1岁8个月患肾病综合征,对激素耐药;Ⅲ10为先证者之兄,死于该病;Ⅱ7、Ⅱ8分别为先证 者之父母,尿检均正常。D系谱图中Ⅲ8为先证者,1岁7个月患蛋白尿(肾病水平),4年后进展至肾病综合征,对激素耐 药;Ⅲ6为先证者之兄,死于该病;Ⅲ11系自然流产;Ⅱ11、Ⅱ12分别为先证者之父母,尿检均正常。 |
| 表 1中国汉族家族性SRNS患儿临床病理资料 |
入选标准:(1)发病年龄介于3个月~18岁。 (2)一个家系至少有2个同胞患病,临床诊断 为SRNS。(3)汉族人;父母非近亲婚配,无肾 脏疾病家族史。肾病综合征(nephrotic syndrome, NS)和SRNS的诊断参照2009年3月中华医学 会儿科学分会肾脏病学组制定的诊断标准 [14] 。 NS的诊断标准:(1)大量蛋白尿:1周内3次 尿蛋白定性(3+~4+),随机或晨尿尿蛋白/肌酐 (mg/mg)≥2.0;24 h尿蛋白定量≥50 mg/kg; (2)低蛋白血症:血清白蛋白低于25 g/L; (3)高脂血症:血清胆固醇高于5.7 mmol/L; (4)不同程度的水肿。SRNS的诊断标准:泼尼 松足量[2 mg/(kg·d)或60 mg/(m2·d)]治疗大于4周 尿蛋白仍为阳性。ESRD的诊断标准 [15] :内生肌酐 清除率<10 mL/(min·1.73 m2),如无肾功能替代治 疗难以生存。
排除标准:(1)全身系统性疾病导致的肾损 害,如链球菌感染后肾小球肾炎、紫癜性肾炎、 狼疮性肾炎、乙型肝炎病毒相关性肾炎的病例; (2)肾脏病理为膜增生性肾小球肾炎、IgA肾病 和C1q肾病病例;(3)有小瞳孔或泌尿生殖系 统畸形或Wilms瘤等肾外表现的病例;(4)因 NPHS1、NPHS2、PLCE1、WT1和CD2AP基因突 变所致的病例。 1.3 基因组DNA提取
在获得南京军区福州总医院伦理委员会批准 和征得患儿监护人及对照人群知情同意的情况下, 取所有研究对象外周静脉血3 mL,10%枸橼酸钠 抗凝,用E.Z.N.A.TM SE Blood DNA试剂盒(美国 Omega)提取基因组DNA。 1.4 PCR扩增及DNA测序
采用Mele等 [4] 设计的引物扩增MYO1E基因 外显子1~28。应用ABI 3730XL DNA Analyzer测序 仪进行测序。对PCR产物进行正向和反向测序。 测序结果异常的DNA片段进行重新扩增,至少重 复2次,以验证结果的可靠性。 1.5 DNA序列变异命名
根据美国国立生物技术信息中心(NCBI)的 GeneBank获得MYO1E基因组序列(NC_000015.9)、 mRNA序列(NM_004998.3)和蛋白质序列 (NP_004989.2),按照人类DNA序列变异命名 建议 [16] 命名MYO1E基因变异。 1.6 MYO1E基因突变的致病性预测
应用生物信息学软件对新发现的MYO1E基因 突变进行致病性预测:NetGene 2(http://www.cbs. dtu.dk/services/NetGene2/)。 2 结果 2.1 4例家族性SRNS先证者临床资料及治疗与 预后
4个SRNS家系的先证者分别是家系A的 Ⅲ7、家系B的Ⅲ27、家系C的Ⅲ11和家系D 的Ⅲ8(图1)。家系A先证者(Ⅲ7)为男孩, 7岁发病,尿蛋白4+,24 h尿蛋白3.59 g(参考 值50~80 mg/24 h),血清白蛋白<25 g/L(参考值 34~54 g/L),肾脏病理为MsPGN,应用足量激素 治疗4周,尿蛋白阳性,诊断为SRNS,14岁进 展至ESRD,16岁4个月时行肾移植术,移植后 7年6个月肾病无复发。家系B先证者(Ⅲ27) 为女孩,7岁发病,尿蛋白3+,24 h尿蛋白8.34 g, 血清白蛋白24 g/L,肾脏病理为FSGS,应用足量 激素治疗4周,尿蛋白阳性,诊断为SRNS,对其 它免疫抑制剂(霉酚酸酯、环磷酰胺和雷公藤多 甙)也无效应,15岁进展至ESRD,16岁6个月 时行肾移植术,移植后8年肾病无复发。家系C 先证者(Ⅲ11)为女孩,1岁8个月发病,尿蛋 白3+,24 h尿蛋白4.37 g,血清白蛋白23 g/L, 对激素和环磷酰胺耐药,随访至2岁4个月时尿 蛋白3+,肾功能正常,2岁10个月进入ESRD, 5岁时死亡。家系D先证者(Ⅲ8)为女孩, 1岁7个月发病,因排泡沫尿就诊,尿蛋白3+, 24 h尿蛋白定量67.75 mg/kg,但是患儿无水 肿,血清白蛋白30 g/L,血清胆固醇6.42 mmol/L (参考值1.15~4.70 mmol/L),尿素3.2 mmol/L (参考值2.5~6.4 mmol/L),肌酐28μmol/L (参考值27~62μmol/L),内生肌酐清除率 134.76 mL/(min·1.73 m2)[参考值<1岁65~80 mL/ (min·1.73 m2);2岁以上80~126 mL/(min·1.73 m2)], 诊断为蛋白尿,4年后该患儿血清白蛋白降至22 g/L; 患儿之兄7岁5个月发病,诊断为SRNS,肾脏病 理为FSGS,9岁死于肾功能衰竭;该先证者于发 病16 d后行肾活检,肾脏病理为FSGS,予以口服 足量泼尼松[2 mg/(kg·d)],联合贝那普利(2.5 mg/d) 降尿蛋白治疗,足量激素治疗6周后尿蛋白 2+~3+,泼尼松逐渐减量并加用氯沙坦(12.5 mg/d), 于病程4个月时加用环孢霉素A后蛋白尿能部分 缓解,随访至5岁7个月尿蛋白3+,血清白蛋白 波动于22 g/L,肾功能仍正常。 2.2 4例家族性SRNS先证者MYO1E基因检测 结果
在4例中国汉族家族性SRNS先证者中共检测 出25个MYO1E基因变异,分别是IVS1+90G>T、 IVS4+8G>A、IVS5-118C>T、IVS5-66A>G、 IVS5-53C>T、IVS8+13G>A、IVS8-56G>C、 IVS8-44G>A、1008C>T、IVS10+275G>A、 IVS10+328T>G、IVS13+216G>T、IVS15+162C>G、 IVS15+223G>A、IVS15-67G>A、IVS20+108A>C、 IVS21-85G>A、2673A>G、IVS24-341A>G、 IVS24-317T>A、IVS26+30C>T、IVS26+116C>T、 IVS27+84G>T、IVS27+457C>G和*14C>G。经检 索NCBI所属的PUBMED文献数据库和单核苷 酸多态性数据库(Single Nucleotide Polymorphism database,dbSNP Build 137),上述MYO1E基因的 25个变异中有24个为已经报道的SNP;MYO1E 基因IVS21-85G>A变异(图 2)在59例健康对照 中未检出,表明它是MYO1E基因突变,而且该突 变尚未见报道。见表 2。
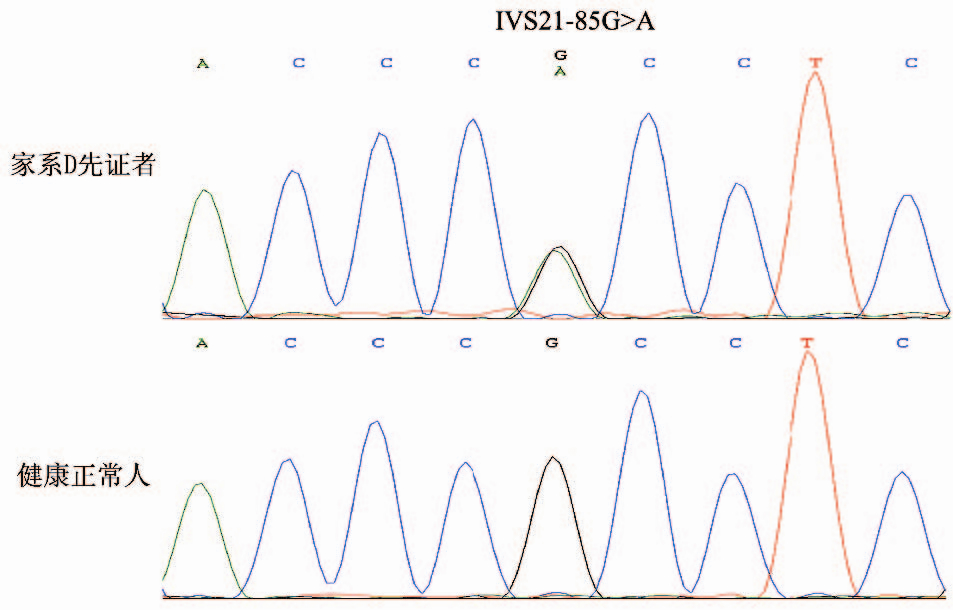 |
图 2MYO1E基因IVS21-85G>A突变测序图 箭头所示为突变位点。 |
| 表 24例中国汉族家族性SRNS先证者MYO1E基因检测结果 |
IVS21-85G>A突变位于内含子区域,属非编 码区的碱基改变,采用NetGene 2平台(http://www. cbs.dtu.dk/services/NetGene2/)进行可变剪切位点的 预测。通过输入碱基改变前后的核苷酸序列,结果 该突变不在被预测的隐匿性剪切位点内,也不产 生其他隐匿性剪切位点数目和评分的改变。提示 MYO1E基因IVS21-85G>A突变为非致病性突变。 3 讨论
本研究采用PCR扩增MYO1E基因全部28 个外显子及其周围的部分内含子,对PCR产物进 行DNA直接序列测定,结果在4个SRNS家系的 先证者中未发现MYO1E基因纯合或复合杂合突 变,提示MYO1E基因突变不是本研究汉族家族性 SRNS家系的主要致病原因。
根据受累患儿的临床病理特点和家系系谱 图,本次研究4个家系均诊断为家族性SRNS, 且遗传方式均为常染色体隐性遗传。前期研究对 家系A、B和C的先证者进行NPHS1、NPHS2、 PLCE1、WT1和CD2AP基因突变分析,对家系D 进行NPHS1、NPHS2、WT1和CD2AP基因突变分 析,但是既未发现家系A、B和C的先证者携带 NPHS1、NPHS2、PLCE1、WT1和CD2AP基因纯 合或复合杂合突变,又未发现家系D的先证者携 带NPHS1、NPHS2、WT1和CD2AP基因纯合或复 合杂合突变 [17, 18, 19] 。近期Mele等 [4] 和Sanna-Cherchi 等 [5] 报道MYO1E基因突变所致家族性SRNS/FSGS呈常染色体隐性遗传,由此推测本次所研究的这4 个中国汉族家族性SRNS家系可能存在MYO1E基 因突变,因此对这4个中国汉族家族性SRNS家系 进行了MYO1E基因突变分析。
本次研究在家系D的先证者中检测出1个 MYO1E基因的IVS21-85G>A,但在59例尿检正常 的对照中未检出,表明该变异为MYO1E基因突变。 由于该变异位于内含子区域,属内含子突变,应 用NetGene2 server公共平台分析,显示该突变不 在被预测的隐匿性剪切位点内,也不产生其他隐 匿性剪切位点数目和评分的改变,表明其为非致 病性突变。MYO1E基因IVS21-85G>A突变在家系 D的先证者(Ⅲ8)中检出,且呈杂合状态;家系 D先证者在应用激素的基础上加用环孢霉素A 24 d 后尿蛋白转阴,提示家系D先证者可能系T细胞 功能紊乱所致。因此,MYO1E基因突变IVS21- 85G>A不是家系D先证者的主要致病原因。
本研究在4个SRNS家系的先证者中除了发现 1个MYO1E基因突变外,还检测出24个MYO1E 基因变异,分别是IVS1+90G>T、IVS4+8G>A、 IVS5-118C>T、IVS5-66A>G、IVS5-53C>T、 IVS8+13G>A、IVS8-56G>C、IVS8-44G>A、 1008C>T、IVS10+275G>A、IVS10+328T>G、 IVS13+216G>T、IVS15+162C>G、IVS15+223G>A、 IVS15-67G>A、IVS20+108A>C、IVS21-85G>A、 2673A>G、IVS24-341A>G、IVS24-317T>A、 IVS26+30C>T、IVS26+116C>T、IVS27+84G>T、 IVS27+457C>G和*14C>G。这24个MYO1E基因 变异在NCBI公共数据库dbSNP build 137中已报 道,表明这24个MYO1E基因变异是MYO1E基因 多态性。
与本研究报道相反,迄今欧美学者在常染色 体隐性遗传SRNS/FSGS家系中检测出2个不同的 MYO1E基因致病突变。Mele等 [4] 在来自欧美的 29个家族性FSGS患者和5个家族性DMS患者中 进行MYO1E基因突变检测,结果在意大利的一个 近亲婚配的FSGS家系中检出A159P纯合突变, 又在土耳其的一个FSGS家系中检出Y659X纯合 无义突变,其突变检出率为5.9%。Sanna-Cherchi 等 [5] 在来自欧美的9个家族性SRNS患者中进 行MYO1E基因检测,结果在一个意大利FSGS 家系中检出A159P纯合突变,其突变检出率为11.1%。与本研究报道一致,McCarthy等 [20] 在来 自欧美的5个家族性SRNS患者中未发现MYO1E 基因突变。此外,Mele等 [4] 在土耳其的一个FSGS 家系中检出MYO1E基因T876R杂合突变(PolyPhen 分值0.006),属非致病性。Sanna-Cherchi等[5]在 意大利的1个家族性SRNS/FSGS先证者中同时检 出MYO1E基因杂合突变D185G(PolyPhen分值 0.593)和P1049H(PolyPhen分值0.079),但是 遗传分离分析显示D185G和P1049H突变均来自 母亲的1条染色体,是MYO1E基因单倍体,而且 此家系中另一个患儿不携带此突变,提示它们不 是该家族性SRNS/FSGS先证者的主要致病原因。 本研究与欧美国家在SRNS/FSGS家系中MYO1E 基因的检测结果存在差异,可能与不同种族具有 不同的遗传背景有关。
总之,本研究在4个中国汉族SRNS家系先 证者中共检测出24个已报道的MYO1E基因多态 性和1个未报道的非致病性MYO1E基因突变,提 示MYO1E基因突变不是本研究中国汉族家族性 SRNS家系的主要致病原因。
志谢:感谢北京大学第一医院丁洁教授在课题申 请方面给予的指导。
| [1] | Benoit G, Machuca E, Antignac C. Hereditary nephrotic syndrome: a systematic approach for genetic testing and a review of associated podocyte gene mutations[J]. Pediatr Nephrol, 2010, 25(9): 1621-1632. |
| [2] | Lowik MM, Groenen PJ, Levtchenko EN, et al. Molecular genetic analysis of podocyte genes in focal segmental glomerulosclerosis-a review[J]. Eur J Pediatr, 2009, 168(11): 1291-1304. |
| [3] | Gbadegesin R, Lavin P, Foreman J, et al. Pathogenesis and therapy of focal segmental glomerulosclerosis: an update[J]. Pediatr Nephrol, 2011, 26(7): 1001-1015. |
| [4] | Mele C, Iatropoulos P, Donadelli R, et al. MYO1E mutations and childhood familial focal segmental glomerulosclerosis[J]. N Engl J Med, 2011, 365(4): 295-306. |
| [5] | Sanna-Cherchi S, Burgess KE, Nees SN, et al. Exome sequencing identified MYO1E and NEIL1 as candidate genes for human autosomal recessive steroid-resistant nephritic syndrome[J]. Kidney Int, 2011, 80(4): 389-396. |
| [6] | Pollak MR. Inherited podocytopathies: FSGS and nephrotic syndrome from a genetic viewpoint[J]. J Am Soc Nephrol, 2002, 13(12): 3016-3023. |
| [7] | Niaudet P. Podocin and nephrotic syndrome: implications for the clinician[J]. J Am Soc Nephrol, 2004, 15(3): 832-834. |
| [8] | Dai J, Sheetz MP. Regulation of endocytosis, exocytosis, and shape by membrane tension[J]. Cold Spring Harb Symp Quant Biol, 1995, 60: 567-571. |
| [9] | McConnell RE, Tyska MJ. Leveraging the membrane-cytoskeleton interface with myosin-1[J]. Trends Cell Biol, 2010, 20(7): 418-426. |
| [10] | Soda K, Balkin DM, Ferguson SM, et al. Role of dynamin, synaptojanin, and endophilin in podocyte foot processes[J]. J Clin Invest, 2012, 122(12): 4401-4411. |
| [11] | Bi J, Chase SE, Pellenz CD, et al. Myosin 1e is a component of the glomerular slit diaphragm complex that regulates actin reorganization during cell-cell contact formation in podocytes[J]. Am J Physiol Renal Physiol, 2013, 305(4): F532-F544. |
| [12] | Krendel M, Kim SV, Willinger T, et al. Disruption of Myosin 1e promotes podocyte injury[J]. J Am Soc Nephrol, 2009, 20(1):86-94. |
| [13] | Chase SE, Encina CV, Stolzenburg LR, et al. Podocyte-specific knockout of myosin 1e disrupts glomerular filtration[J]. Am J Physiol Renal Physiol, 2012, 303(7): F1099-F1106. |
| [14] | 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(一): 激素敏感, 复发/依赖肾病综合征诊治循证指南(试行)[J].中华儿科杂志, 2009, 47(3): 167-170. |
| [15] | 中华医学会儿科学分会肾脏病学组. 小儿肾小球疾病临床分类、诊断及治疗[J]. 中华儿科杂志, 2001, 39(12): 746-749. |
| [16] | den Dunnen JT, Antonarakis SE. Nomenclature for the description of human sequence variations[J]. Hum Genet, 2001, 109(1): 121-124. |
| [17] | 付荣, 陈新民, 王庆华, 等. 中国南方汉族人家族性激素耐药型肾病综合征家系NPHS2基因突变[J]. 中华儿科杂志, 2008, 46(8): 591-596. |
| [18] | 付荣, 陈新民, 余自华, 等. 中国汉族人3个家族性激素耐药型肾病综合征家系WT1和PLCE1基因突变分析[J]. 中华肾脏病杂志, 2009, 25(7): 525-531. |
| [19] | 孟大川, 王道静, 余自华, 等. 中国南方汉族人3个家族性激素耐药型肾病综合征家系CD2AP和NPHS1基因突变分析[J]. 实用儿科临床杂志, 2011, 26(5): 329-332, 344. |
| [20] | McCarthy HJ, Bierzynska A, Wherlock M, et al. Simultaneous sequencing of 24 genes associated with steroid-resistant nephrotic syndrome[J]. Clin J Am Soc Nephrol, 2013, 8(4): 637-648. |
 2014, Vol. 16
2014, Vol. 16