急性肾损伤(acute kidney injury,AKI)是临床 上常见的危重症,目前对其病理生理、发病机制 及早期诊断标志物的研究已取得长足进步,但其 病死率仍高达 50%,故进一步阐明其发病机制、 探索新的治疗靶点及治疗措施成为临床研究的重 要课题。目前研究发现肾小管上皮细胞紧密连接 的破坏导致细胞凋亡、坏死、脱落,从而堵塞管 腔,是 AKI 发生发展的重要机制[1] 。Claudin-2是 细胞紧密连接蛋白的主要组成部分,更为重要的 是 claudin-2 主要表达于近端肾小管上皮细胞,故 其可能与 AKI 的发生、发展有关联。Gonzalez 等[2] 在氧自由基介导的 MDCK II 肾小管上皮细胞损害 的体外研究中证实 claudin-2 水平在 24 h 有显著降 低,但 claudin-2 在 AKI 患儿肾组织中的表达变化 及意义不清楚,少见文献报道。本研究探讨 AKI 患儿肾组织 claudin-2 的表达变化及与肾脏病理损 害、肾功能的关系,为明确 AKI 发生及发展的机 制提供依据。 1 资料与方法 1.1 一般资料及分组
选取 2009 年 12 月至 2011 年 12 月在本院肾 内科住院的 AKI 患儿 24 例为研究对象,其中男 15例,女9例,年龄3个月~10岁5个月,平均 年龄 3.9±2.9 岁。AKI 患儿均符合 2005 年荷兰阿 姆斯特丹急性肾衰竭国际研讨会关于 AKI 的诊断 标准,即肾功能急剧下降,48 h 内血清肌酐水平 增加<0.5 mL/(kg · h),持续 6 h 以上;并依据其进 行 AKI 分期[3],将 AKI 1 期及 2 期的 7 例患儿纳 入轻症病例组,其中男 6 例,女 1 例,中位年龄 3 岁(7 个月 ~10 岁);AKI 3 期的患儿 17 例纳 入重症病例组,其中男 12 例,女 5 例,中位年龄 3 岁(7 个月 ~10 岁)。纳入标准:(1)年龄≤ 14 岁; (2)完善肾活检,明确肾脏病理损害以肾小管 间质损害为主;(3)排除肾前性、肾后性及肾小 球疾病所致的急性肾衰竭。另选择同期本院肾内 科住院的年龄和性别与研究组相匹配的 12 例临床 诊断为孤立性血尿的患儿为对照组,纳入标准: (1)临床表现为单纯镜下血尿;(2)肾脏病理 诊断为肾小球轻微病变,无肾小管及间质损害; (3)排除其他肾脏疾病。 1.2 主要试剂
兔抗人 claudin-2 多克隆抗体购自美国 Biworld 公司;免疫组化染色试剂盒及 DAB 显色试剂盒购 自北京中杉金桥生物技术有限公司。 1.3 血清肌酐水平检测
所有患儿入院后均抽取空腹肘静脉血 3 mL,采用全自动生化分析仪比色法检测血清肌酐水平。 1.4 肾小管间质病理损害的计量评分
4 μm 肾组织石蜡切片,行 HE 染色,每例患 儿肾脏组织随机选取 6 张切片,每张切片随机选 取 10 个视野,参照文献[4] 按照肾脏病理计量评分 法对肾小管间质进行半定量分析,计分标准如下: 评价肾小管间质损害包括肾小管萎缩、上皮细胞 变性、上皮细胞坏死、间质水肿、肾间质纤维化 及炎性细胞浸润共 6 项指标。每 1 项指标分成轻、 中、重度损害,分别计分 1、2、3 分。累计分数 0~18 分,总计分≤ 4 分定为肾小管间质轻度损害,5~8 分定为中度损害,≥ 9 分定为重度损害。 1.5 统计学分析
用 SPSS 18.0 统计软件包对数据进行统计学分 析,数据以均数 ± 标准差(x±s)表示,多组间 比较采用方差分析,组间两两比较采用LSD-t检 验; 有相关趋势的资料用 Pearson 相关分析。P<0.05 为 差异有统计学意义。 2 结果 2.1 血清肌酐水平
3 组患儿间血清肌酐水平比较差异有统计 学意义(F=82.86,P<0.01),其 中 AKI 轻 症 组(190±68 μmol/L) 与 AKI 重 症 组(477± 128 μmol/L)血清肌酐水平均高于对照组 (29±7 μmol/L)(均P<0.01),且 AKI 重症组血 清肌酐水平高于 AKI 轻症组(P<0.01)。 2.2 AKI 患儿肾小管间质病理损害
AKI 患儿肾组织 HE 染色示肾小管均有不同程 度的刷状缘脱落,上皮细胞呈颗粒样、空泡样变 性,部分肾小管上皮细胞脱落、坏死、堵塞管腔; 对照组肾组织 HE 染色均为肾小球轻微病变,肾小 管及间质未见异常(图 1 )。AKI 轻症组患儿肾小 管间质损害计分为 10.4±1.7 分,重症组肾小管间 质病理损害计分为 14.0±1.5 分,两组间比较差异 有统计学意义(t=-5.09,P<0.05)。
 |
图 1各组患儿肾组织 HE 染色(×400) 对照组患儿肾脏病理示肾小管及间质正常,AKI 轻症组患儿肾脏病理示部分肾小管上皮细胞坏死、刷状缘脱落(箭头所示),间质水肿,炎性细胞浸润;AKI 重症组患儿肾脏病理示大部分肾小管上皮细胞坏死、刷状缘脱落(箭头所示),间质水肿,炎性细胞浸润。 |
对照组患儿肾组织 claudin-2 表达于近端肾小管上皮细胞胞膜,主要 为顶端及相邻细胞侧,呈规则的栅栏样均匀连续 排列,胞质区少量染色,胞核及核膜无表达,远 端肾小管、肾小球及肾间质无表达。AKI 患儿肾组 织 claudin-2 表达于近端肾小管上皮细胞胞膜,胞 质区表达增加,胞核及核膜无表达,远端肾小管、 肾小球及肾间质无表达,但近端肾小管上皮胞膜 上的 claudin-2 表达明显降低,排列断裂,表现为 不同程度的淡染及不着色区。见图 2 。
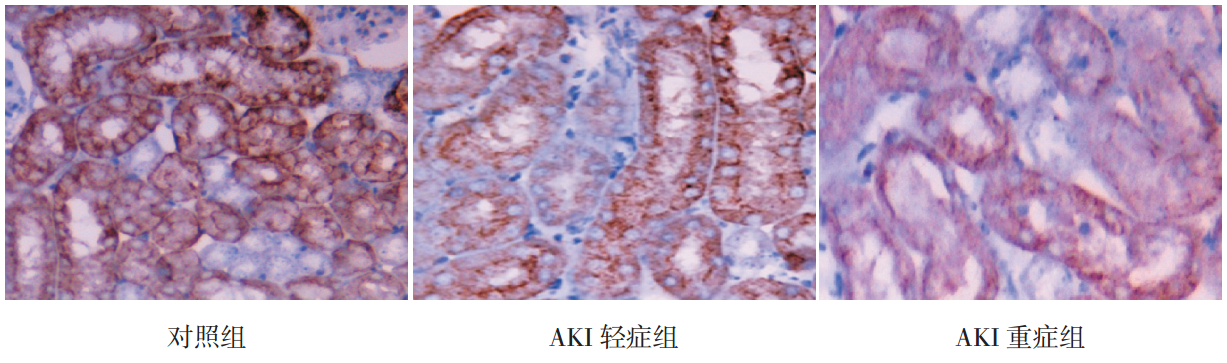 |
图 2各组患儿肾组织 claudin-2 的表达(DAB 显色,×400) 对照组患儿 claudin-2 表达于近端肾小管上皮细胞胞膜,主要为胞膜顶端及相邻细胞侧,呈规则的栅栏样均匀连续排列,胞质区少量表达;AKI 轻症组患儿 claudin-2 表达于近端肾小管上皮细胞胞膜,表达降低、缺如,排列紊乱,胞核及核膜无表达,胞质中表达增多;AKI 重症组患儿 claudin-2 在胞质中表达明显增多,胞膜上表达降低、缺如及排列紊乱更明显。图中 claudin-2 的阳性表达呈现棕色。 |
3组患儿间肾组 织 claudin-2 阳性表达面积比较差异有统计学意义 (F=44.77,P<0.01),其中AKI 轻症组(5.0%±0.5%) 与 AKI 重 症 组(3.7%±0.7%)claudin-2阳 性 表 达 面 积 均 低 于 对 照 组(8.0%±0.7%)( 均 P<0.01),且 AKI 重症组 claudin-2 阳性表达面积 低于 AKI 轻症组(P<0.01)。 2.4 Claudin-2 表达与肾脏病理及血肌酐水平的关系
相关性分析结果示 claudin-2 阳性表达面积与 肾小管间质的病理损害评分呈负相关(r=-0.809,P<0.01),与血清肌酐水平亦呈负相关(r=-0.903,P<0.01)。 3 讨论
正常的结构是细胞及组织器官发挥功能的 基础,正常肾小管上皮细胞的特性是具有极性和 紧密连接,肾小管上皮细胞的极性及紧密连接形 成是维持正常生理功能的重要保证和结构特征。 claudins 蛋白是紧密连接的重要组成部分,维持肾 脏正常生理功能,其异常参与了多种肾脏疾病的 发生与发展[5]。目前已发现 claudins 家族由 24 个 跨膜蛋白亚型组成,分子量约20~27 KD,一个 claudin 分子均由 4 个跨膜结构域组成,氨基和羧 基末端都在细胞内,羧基末端富含丝氨酸、苏氨 酸和酪氨酸残基。claudins 有 2 个长度不等的细胞 外环,在不同 claudin 分子之间,第 1 和第 4 个跨 膜片段以及细胞外环的氨基酸序列具有高度保守 性。
Claudins 的主要生物学功能为栅栏功能和屏障 功能。栅栏功能把上皮细胞质膜分成顶侧的脂质 部分和基侧的蛋白部分,可以阻止两个不同功能 区之间的相互弥散,有助于细胞极性的形成。屏 障功能则对分子大小、离子类型、细胞渗透性等 有选择性,可以调节细胞间小分子的运输,维持 组织的稳态。在肾脏组织中,claudins 蛋白除维持 上皮细胞的极性、控制细胞旁的扩散途径外,还 参与调节细胞增殖和分化、上皮 - 间质转化及肿 瘤的发生与进展[6, 7, 8],是肾组织生理及病理功能的 分子基础。
急性肾损伤的主要病理生理过程包括:各种 原因所致的肾小管上皮细胞去分化、变性、紧密 连接破坏、极性丧失,导致上皮细胞坏死、凋亡、 肾小管基底膜裸露,上皮细胞脱落堵塞管腔,在 修复过程中健存的细胞迁移、去分化、新的上皮 细胞再生增殖、黏附,肾小管上皮极性形成、结 构重建、功能恢复[9, 10]。肾小管上皮细胞紧密连接 破坏是 AKI 的早期病理生理改变,是启动 AKI 发 生的关键点[11] 。在肾组织中,claudin-2 主要表达 于近端肾小管,维持孔道形成,即为“漏孔道”,可以选择性使小分子阳离子通过,维持近端肾小 管对 Na+及水的重吸收[12] 。claudin-2 表达的改变 参与了肾小管的损伤过程,Gonzalez 等[2] 在氧自 由基介导的 MDCK II 肾小管上皮细胞损害中证实 claudin-2 水平在 24 h 显著降低;Ikari 等 [13] 研究发 现 claudin-2 通过下调 MMP-9,能降低细胞迁移造 成的肾小管损伤;另有文献报道重铬酸盐导致的 急性肾衰竭中 claudin-2 分布异常 [14];但目前未见 claudin-2 在急性肾损伤患儿肾组织中的表达情况 的文献报道。
本研究发现在对照组及 AKI 组,claudin-2均 分布于近端肾小管上皮紧密连接的细胞膜,胞核 及核膜无表达,与文献报道的正常 claudin-2 的分 布一致[12]。AKI 轻症病例组及重症病例组患儿肾 组织中 claudin-2 表达水平明显低于孤立性血尿患 儿,另外 claudin-2 在 AKI 组胞质中着色区增多,表明 claudin-2 有不同程度的分布异常。重症病例 组 claudin-2 表达水平低于轻症病例组,差异有统 计学意义,claudin-2 表达与血清肌酐水平及肾间 质损害评分呈负相关。提示 claudin-2 的表达和分 布异常可能参与了肾小管上皮细胞紧密连接紊乱 介导急性肾损伤。
以上提示在 AKI 中肾组织 claudin-2 的表达下 降及分布异常为 AKI 发生及发展的重要机制,这 与 claudin-2 的生理功能意义一致,提示 claudin-2 可作为干预 AKI 进展的研究切入点及治疗潜在靶 点。目前研究已证实多种上游信号分子、生长因 子及信号通路参与 claudins 的调节[2, 15, 16, 17],相信随 着对 claudin-2 调节机制研究的深入,对 AKI 的治 疗措施也将取得新的进展。
| [1] | Eadon MT, Hack BK, Xu C, et al. Endotoxemia alters tight junction gene and protein expression in the kidney[J]. Am J Physiol Renal Physiol, 2012, 303(6): F821-F830. |
| [2] | Gonzalez JE, DiGeronimo RJ, Arthur DE, et al. Remodeling of the tight junction during recovery from exposure to hydrogen peroxide in kidney epithelial cells[J]. Free Radic Biol Med, 2009, 47(11): 1561-1569. |
| [3] | Mehta RL, Kellum JA, Shah SV, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury[J]. Crit Care, 2007, 11(2): R31. |
| [4] | 李志辉, 易著文, 何小解, 等. 激素耐药型和激素依耐型肾病患儿肾脏病理剂量分析[J].中华儿科杂志, 2001, 39(8): 449-452. |
| [5] | Lee DB, Huang E, Ward HJ. Tight junction biology and kidney dysfunction[J]. Am J Physiol Renal Physiol, 2006, 290(1): F20-F34. |
| [6] | Bilder D. Epithelial polarity and proliferation control: links from the Drosophila neoplastic tumor suppressors[J]. Genes Dev, 2004, 18(16): 1909-1925. |
| [7] | Grande M, Franzen A, Karlsson JO, et al. Transforming growth factor-beta and epidermal growth factor synergistically stimulate epithelial to mesenchymal transition (EMT) through a MEK-dependent mechanism in primary cultured pig thyrocytes[J]. J Cell Sci, 2002, 115(Pt 22): 4227-4236. |
| [8] | Lechpammer M, Resnick MB, Sabo E, et al. The diagnostic and prognostic utility of claudin expression in renal cell neoplasms[J].Mod Pathol, 2008, 21(11): 1320-1329. |
| [9] | Cantaluppi V, Quercia AD, Dellepiane S, et al. New mechanisms and recent insights in the pathogenesis of acute kidney injury (AKI)[J]. G Ital Nefrol, 2012, 29(5): 535-547. |
| [10] | 陈香美, 谢院生. 急性肾损伤的修复与再生[J]. 中国中西医结合肾病杂志, 2010, 7 (11): 565-567. |
| [11] | Reyes JL, Molina-Jijon E, Rodriguez-Munoz R, et al. Tight junction proteins and oxidative stress in heavy metals-induced nephrotoxicity[J]. Biomed Res Int, 2013, 2013: 730789. |
| [12] | Rosenthal R, Milatz S, Krug SM, et al. Claudin-2, a component of the tight junction, forms a paracellular water channel[J]. J Cell Sci, 2010, 123(Pt 11): 1913-1921. |
| [13] | Ikari A, Takiguchi A, Atomi K, et al. Decrease in claudin-2 expression enhances cell migration in renal epithelial Madin-Darby canine kidney cells[J]. J Cell Physiol, 2011, 226(6): 1471-1478. |
| [14] | Arreola-Mendoza L, Del Razo LM, Mendoza-Garrido ME, et al. The protective effect of alpha-tocopherol against dichromate-induced renal tight junction damage is mediated via ERK1/2[J]. Toxicol Lett, 2009, 191(2-3): 279-288. |
| [15] | Ikari A, Takiguchi A, Atomi K, et al. Epidermal growth factor increases clathrin-dependent endocytosis and degradation of claudin-2 protein in MDCK Ⅱ cells[J]. J Cell Physiol, 2011, 226(9): 2448-2456. |
| [16] | Van Itallie CM, Tietgens AJ, LoGrande K, et al. Phosphorylation of claudin-2 on serine 208 promotes membrane retention and reduces trafficking to lysosomes[J]. J Cell Sci, 2012, 125(Pt 20): 4902-4912. |
| [17] | Yasuda T, Saegusa C, Kamakura S, et al. Rab27 effector Slp2-a transports the apical signaling molecule podocalyxin to the apical surface of MDCK Ⅱ cells and regulates claudin-2 expression[J]. Mol Biol Cell, 2012, 23(16): 3229-3239. |
 2014, Vol. 16
2014, Vol. 16


